《Endocrinology and Metabolism Clinics North America 》杂志2020 年9月刊载[Sep;49(3):505-515. ]法国Mirela Diana Ilie , Emmanuel Jouanneau , Gérald Raverot 撰写的综述《进袭性垂体腺瘤和垂体癌。Aggressive Pituitary Adenomas and Carcinomas 》(doi: 10.1016/j.ecl.2020.05.008.)。
垂体肿瘤的亚群表现出仍然难以预测的进袭性行为,并且在罕见的情况下会出现转移。目前欧洲内分泌学会(ESE)关于进袭性垂体肿瘤和垂体癌的治疗指南提供了有价值的指导,但由于文献资料的缺乏,一些问题仍然没有得到解决。这篇文章介绍了进袭性垂体肿瘤和垂体癌的关键临床方面,也讨论了欧洲内分泌学会(ESE)指南中一些未回答的集中在诊断和治疗上的问题。
![]()
要点
●垂体肿瘤的一个亚群表现出保持着的难以预测的进袭行行为,而且,在非常罕见的情况下,它们会转移。
●从2018年开始,就有了管理进袭性垂体肿瘤和垂体癌的治疗指南,但由于缺乏可用的数据,一些问题仍然没有解决。
●本文根据体征和症状对临床相关肿瘤生长进行界定,而异常快速的肿瘤生长速度是指肿瘤在不到6至12个月增大了20%。
●替莫唑胺和Stupp协议,不仅是作为挽救性治疗,在进袭性垂体瘤和垂体癌早期治疗中应有其地位。
●尽管替莫唑胺对约40%的患者有效,但替换的治疗方法仍然是需要的,且应该考虑免疫治疗。
![]()
引言
垂体腺瘤和垂体癌是来源于垂体腺前叶内分泌细胞的肿瘤。大多数是良性的,它们或在临床上依然不显性,或可以用现有的常规治疗(药物治疗、手术和在某些情况下的放射治疗)容易地进行治疗(easily treatable)。然而,其中一些肿瘤表现出难以预测的进袭性行为(an aggressive behavior that is difficult to predict),在非常罕见的情况下,会发生转移。图1中呈现的是垂体腺瘤和垂体癌的患病率。进袭性垂体腺瘤和垂体癌均难以治疗,且对并发症发生率和死亡率的增加承担着责任。最近出版的欧洲内分泌学会(ESE)指南提供了有价值的指导,但因为文献中可用的数据稀缺,同时也留下了一些未解决的问题。本文介绍了从定义到诊断、治疗和随访的关键的临床方面。还讨论了一些ESE指南中未解决的问题(例如,如何定义临床相关的肿瘤生长),以及替莫唑胺(TMZ)不仅作为一种挽救性治疗,在进袭性垂体肿瘤和垂体癌早期治疗中的潜在地位。
![]()
目前的定义
进袭性垂体腺瘤被欧洲内分泌学会(ESE)指南定义为,放射影像学上的肿瘤生长异常迅速的侵袭性肿瘤,或是即便合理应用标准化治疗(常规药物治疗、外科手术和放射治疗),仍呈现与临床相关的肿瘤生长的肿瘤。但是,尚未提出对与临床相关的肿瘤生长(clinically relevant tumor growth)或肿瘤生长异常迅速(unusuallyrapid tumor growth rate)的定义。
●垂体癌的定义完全基于存在的(颅脑脊髓和/或全身性)转移,因为到目前为止没有在转移前区分垂体癌和垂体腺瘤的组织学特征。此外,在欧洲内分泌学会(ESE)调查的关于进袭性垂体瘤和垂体癌的临床和组织学资料中,由于两组的相似性,Trouillas和同事们质疑是否进袭性垂体瘤和垂体癌是一枚硬币的两面,并认为进袭性的垂体瘤是具有恶性潜能的肿瘤。然而,尽管两组有相似之处,垂体癌更常(90% 相比63%)表现为每高倍视野下有丝分裂计数大于2 ,且与进袭性垂体瘤相比,其死亡率较高(43% 相比 28%)。
![]()
诊断
从实用性的角度来看,这些肿瘤的诊断应包括:
●影像研究
●内分泌实验室完整评估
●眼科学的评估
●组织病理学分析

图1.垂体腺瘤和垂体癌的患病率
影像学检查主要用于评估肿瘤的尺寸、侵袭和生长。MRI是首选;薄层是必需的,而序列应该包括矢状位T1加权、冠状位T1加权、及其对比强化的,冠状为Y2加权、和(+)轴位T1加权原始序列(native sequence)。除了MRI,需要评估骨质侵袭时,应进行计算机断层(CT)扫描,且临床医生应该筛查转移,后续会加以讨论。
关于侵袭,ESE指南指出,单纯的侵袭性并不等同于进袭性(invasiveness alone is not synonymous with aggressiveness),但侵袭性是不能完全切除的决定因素。担忧的另一点,与基于MRI表现的肿瘤侵袭性的认定(assertion)有关,这可能是有误导性的,因为肿瘤浸润和/或肿瘤扩张(expansion)都可能导致肿瘤向海绵窦的延伸(extend)。当肿瘤在MRI上被归类为Knosp分级的3A、3B或4级时,标记为侵袭性肿瘤已成为一种常见的做法。然而,在最初,改进的Knosp分级(1、2、3A、3B和4级)旨在预测手术中观察到的海绵窦侵袭的可能性(并从而预测手术的结果),而不是定义侵袭本身。研究人员发现,在内镜下经蝶窦手术中,3A级、3B级和4级之间的鞍旁侵袭有重要的差异(分别为26.5%、70.6%和100%)。此外,在10%的Knosp 2级肿瘤患者中发现有侵袭性。作者最近在内镜下经蝶窦手术中证实,3A级和3B级肿瘤在手术观察到的海绵窦侵袭上存在差异。3A级肿瘤术中发现侵袭率(61.5%)高于原来的研究(26.5%),但仍低于3B级肿瘤(78.6%)。此外,全切除率与Knosp分级呈负相关,3A级肿瘤的全切除率为56%,3B级肿瘤的为25%。需要注意的是,对于功能性垂体肿瘤,3A级和3B级肿瘤的术后缓解率没有差异,提示MRI上有不可见的持续残留的肿瘤。
如何对肿瘤生长进行测量和分类以评估治疗效果是一个重要的问题。Imber和同事最近证明,虽然垂体肿瘤形状不规则(特别是在治疗后),采用1D(一维)的方法(即最长的直径,在大多数中枢神经系统以外的癌症中应用的修订后的实体肿瘤反应评估标准[RECIST]指南1.1版中提出),通常与容积评估充分相关。研究者提醒,在特定情况下,垂体肿瘤,如多发性的(multiloculated)垂体肿瘤、多病灶的和有骨质侵袭的肿瘤、小的复发的,和小的区域的残留肿瘤,三维容积评估可能较一维评估更为准确和增加价值,但这似乎是真的,尤其是在诊断部分缓解相比疾病稳定,而不是在肿瘤恶化的情况下。
RECIST 1.1将进展性疾病定义为最长直径总和(与开始特定治疗以来记录的最长直径的最小总和相比)增加20%,所需的直径总和绝对增加5毫米,以及/或出现新的病变。“直径总和(sum of diameters)”一词用于说明可能存在的多个病变。当最长直径的总和非常小,而且增加20%在测量误差的范围内,总和绝对增加5毫米是为了避免对进展性疾病的过度诊断。同样重要的是要注意到,RECIST指南主要基于CT扫描,为了一致性和简便,它建议测量轴位平面上的最长直径(即使真正的最长直径可能在另一个平面上);此外,病变最初必须大于或等于1cm,才能被认为是可测量的。
然而,在有垂体肿瘤的情况下,鉴于病变是独一无二的(因此有一个唯一的最长的直径,而非直径之和),小于5毫米的增加可能会被准确地测量,这也取决于在MRI机器、序列和扫描层厚上如何良好地显现(well delineated)肿瘤。作者建议应该与每个垂体团队的放射科医生讨论什么是最小的可准确测量的增大,但是最长直径20%的增大通常应该足以称为进展性疾病。
回到进袭性垂体瘤的定义,由于文献中没有足够的数据来给出明确的、基于证据的定义,指南没有定义与临床相关的肿瘤生长或肿瘤生长速度异常迅速。因此,最需要对这个问题进行研究,但根据我们自己的经验,在得到这些研究之前,我们提出以下建议。对于第一个术语,在有垂体瘤的情况下,由于其位置,即使肿瘤没有显示疾病进展(即其最长直径增加20%),它仍可能显示有与临床相关的肿瘤生长。这些情况包括肿瘤开始接近或压迫视交叉,加重视野缺损,以及压迫绕过海绵窦窦的颅神经。在这些情况下,如同与临床相关的肿瘤生长这个术语所表达的,(如果肿瘤接触视交叉,出现或预期出现)真正的体征和症状,与肿瘤直径的绝对或相对增加无关,可以独立诊断与临床相关的肿瘤生长,(特别是因为可能不是最长的直径导致并发症)。或者,当肿瘤的最长直径增加超过20%,即使这种增长与临床无关(例如,肿瘤在蝶窦扩张),也应视为进展性肿瘤。肿瘤生长速度异常迅速则更难定义。正常情况下,垂体肿瘤生长缓慢,为了评估肿瘤生长情况,有必要将最后一次影像学检查与倒数第二次影像学检查进行比较,也要与较早的影像学检查进行比较,这是ESE指南所推荐的,如图2所示。因此,如果不到6个月(或如果只每年复查MRI,甚至<12个月),则被归类为异常迅速。图3为快速生长的垂体瘤。
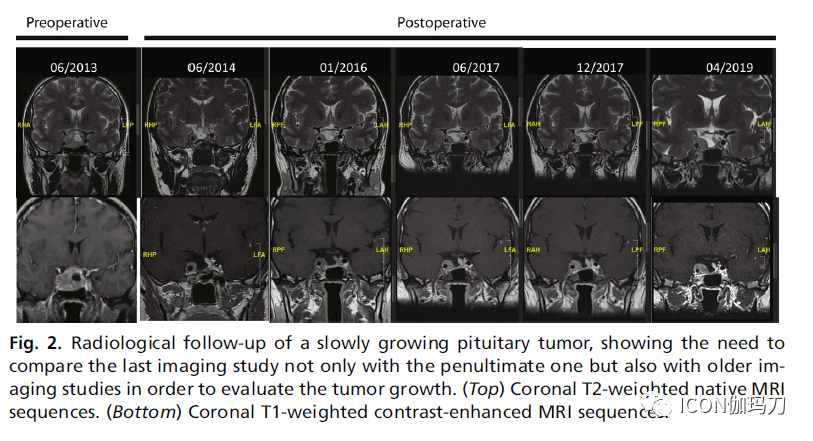
图2.对一个缓慢生长的垂体肿瘤的放射影像学随访显示,为了评估肿瘤的生长,不仅需要将最后的影像学检查与倒数第二次的影像学检查进行比较,而且还需要与以前的影像学检查进行比较。(上排)冠状位T2加权MRI原始序列。(底部)冠状位T1加权对比增强MRI序列。
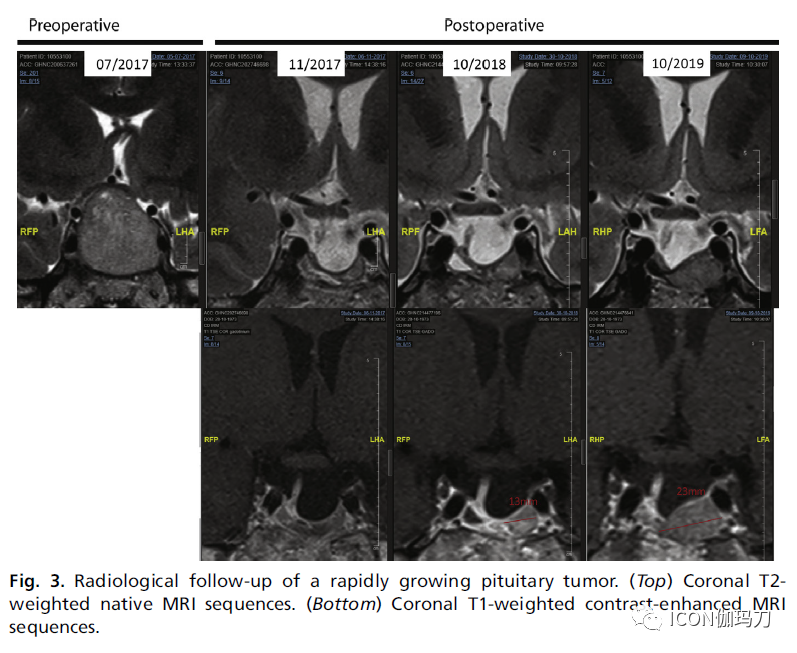
图3.快速生长的垂体瘤的放射影像学随访。(上排)冠状位T2加权MRI原始序列。(底部)冠状位T1加权对比增强MRI序列。
进袭性的行为可能在初步诊断垂体瘤后10年以上才表现出来,到目前为止,没有单一的标志物能够准确地预测它。这一事实是特别重要的,因为它允许对这些肿瘤的早期和更深入的管理。目前,ESE指南建议,至少,应该设想至少对Ki - 67指数≧3%患者进行垂体激素的免疫组化和确定KI- 67指数、陈述有丝分裂计数和p53免疫检测。相比之下,欧洲垂体病理组(EPPG)最近提出了一种对这些肿瘤的标准化诊断方法,其中Ki-67指数和有丝分裂计数都被系统地列出,每个高倍镜视野下的有丝分裂计数超过2个有丝分裂作为截断值。对于进袭性的预测,EPPG还建议在常规临床实践中引入Trouillas和同事们的5层分类 (1a,无侵袭性和无增殖性;1b,有增殖性和无侵袭性;2a,有侵袭性和无增殖性;2b,有侵袭性和有增殖性;3,垂体癌),鉴于其预测手术后进展和复发风险的能力已被多个独立研究所验证。
![]()
治疗
替莫唑胺(TMZ)是一种口服烷基化剂,对TMZ肿瘤有反应的进袭性垂体肿瘤和垂体癌患者的5年的总体和无进展生存率有显著的改善。在标准治疗失败后,TMZ单药治疗现在被ESE指南推荐作为一线化疗,并随访记录肿瘤生长。然而,在迄今为止最大规模的系列研究中,只有约40%的接受TMZ第一疗程治疗的患者被发现有放射影像学的反应,临床功能性肿瘤对TMZ的反应优于无功能肿瘤(临床功能性肿瘤的退缩率是无功能肿瘤的3.3倍)。此外,停止TMZ后,中位随访1年,25% - 48%的肿瘤有进展,而对第二个疗程TMZ的反应很少有效。因此,显然需要其他的治疗选择。
由于文献资料不足,ESE指南仅建议,对于肿瘤生长迅速且先前未达到最大放疗剂量的患者,使用Stupp协议(即,同步和辅助TMZ进行放疗)。然而,在胶质母细胞瘤中,第一次验证Stupp方案(在Stupp方案之前,新诊断的胶质母细胞瘤通过手术切除,然后辅助放射治疗),加上同步放疗和辅助TMZ可以在附加毒性最小的情况下获得生存受益。对于进袭性垂体肿瘤和垂体癌,在ESE对157例将TMZ作为一线化疗治疗的患者的调查数据中,14例患者接受同步放疗、显示一线TMZ 加同步放疗与增加反应率(在71%的患者中有完全或部分放射影像学反应)相比TMZ单药治疗(在34%的患者中有完全或部分放射影像学反应)。虽然研究者指出,这两个治疗组之间没有明显的临床病理学差异,但他们也注意到,接受一线TMZ联合同步放疗的大多数患者之前没有接受过放疗,因此,这种反应率的增加也可能反映出有选择性偏倚。然而,在体外和体内,TMZ显示有放射增敏剂的特性,在意大利对27例接受放射治疗的进袭性垂体瘤或垂体癌患者的研究中,除了3例放疗同步或放疗1个月后替莫唑胺给药的患者,其余都在放射治疗后肿瘤复发。在我们的临床实践中,我们在2例以前未接受放疗的患者中尝试了Stupp方案,并且在这两例患者中(1例男性泌乳素瘤患者为参考文献中缩描述的,1例男性患者为静默性促肾上腺皮质激素垂体癌)均取得部分缓解。我们认为,在某些垂体肿瘤患者中,Stupp方案可能是替代单独放疗的一种选择。然而,这样做不仅意味着使用Stupp方案代替TMZ单药治疗,还意味着在单独放疗失败之前使用它。这种选择带来了第二点,即使用TMZ仅仅作为(在所有常规治疗失败后的)挽救性治疗。到目前为止,这是TMZ的主要使用方式,也是ESE指南推荐的方式。然而,有几个研究者认为TMZ可能在进袭性垂体肿瘤的早期治疗中有其地位。只要好处大于风险评估(描述的用于治疗垂体肿瘤时的TMZ最常见的副作用是疲劳、恶心/呕吐、血细胞球减少(cytopenias),但其他副作用,包括肝功能异常、头痛、听力损失、脑水肿、低血压、肾上腺危象,也被注意到。在其他癌症中,虽然继发性血液恶性肿瘤很少被提及,但作者同意在某些病例的治疗中值得早期尝试TMZ,而且不仅作为挽救性治疗,而且更有说服力的证据也会受到欢迎。
另一个关于TMZ的问题是治疗的持续时间。ESE指南建议,对于有反应者,TMZ应至少使用6个月,如果有持久的治疗获益,应考虑延长治疗的持续时间。目前尚不清楚较长期的持续治疗是否会提高有反应者持续缓解的机会,但是,已知的是,在停用TMZ后,有反应者的一个重要的百分比显示疾病进展,且对第二疗程的TMZ的反应很差。相比之下,赞成缩短治疗持续时间的论点是TMZ引起的骨髓毒性的累积效应,特别是因为有垂体瘤患者更有可能是长期的幸存者。因此,分析TMZ最佳治疗持续时间的前瞻性研究将是最受欢迎的。在我们的实践中,只要观察到有抗肿瘤和激素的效果,且治疗是可耐受的,我们通常会继续TMZ治疗。然而,我们试图在24个周期后将TMZ的剂量减少到一半,以限制潜在的累积毒性。
我们团队最近回顾了其他主要的治疗方案,所涉及的患者人数有限:20例患者接受肽受体放射性核素治疗(PRRT), 12例接受贝伐珠单抗(血管内皮生长因子受体靶向治疗), 10例接受酪氨酸激酶抑制剂治疗, 6例患者接受依维莫司(everolimus)(哺乳动物雷帕霉素靶蛋白抑制剂),和2例患者接受免疫检查点抑制剂。没有足够的数据可以得出任何明确的结论,但是,基于放射影像学反应,目前最有希望的治疗是贝伐珠单抗、肽受体放射性核素治疗(PRRT)和免疫检查点抑制剂。图4显示了这50例患者在上述治疗中的放射影像学反应。

图4.到目前为止,用肽受体放射性核素治疗(PRRT)、贝伐珠单抗、酪氨酸激酶(TK)抑制剂、依维莫司和免疫检查点(IC)抑制剂治疗的进袭性垂体肿瘤和垂体癌的放射影像学反应。值得注意的是,其中一些患者之前曾使用过替莫唑胺治疗,而在一些患者中,上述治疗与其他治疗(包括替莫唑胺)同时使用。到目前为止2例使用免疫检测点抑制剂的治疗中,伊匹单抗(ipilimumab)和纳武单抗(nivolumab)联合治疗的促肾上腺皮质激素垂体癌患者出现部分反应,而派姆单抗(pembrolizumab)治疗的进袭性促肾上腺皮质激素腺瘤患者出现疾病进展。完全缓解=未见肿瘤;部分反应=肿瘤体积缩小大于30%;疾病稳定=肿瘤增大小于10%,或缩小小于30%;疾病进展=新的转移或肿瘤大小增加超过10%。
![]()
随访
建议每3到12个月进行一次(通常是MRI)影像学检查和完整的内分泌评估,具体取决于肿瘤的位置、以前的生长速度和临床情况。随访应是终生的,因为可能在诊断多年后才出现进袭性垂体瘤的生长速度加快和发生转移。
在最近对72例垂体癌的回顾中,从最初诊断到转移的平均潜伏期是9年。最常见的转移是颅内和脊柱,其次是肝脏、颈淋巴结和骨转移,(肺、内淋巴囊和眼眶转移罕见)。对于进袭性垂体瘤患者,目前建议在生化和放射影像学检查结果不一致时(如激素水平升高而肿瘤尺寸没有相应增加)或有特定部位症状(颈部疼痛、背部疼痛和/或神经系统主诉)时筛查转移灶。在这些情况下,指南建议进行结构性(MRI和CT扫描)和/或功能性成像研究,如氟脱氧葡萄糖(fluorodeoxyglucose)和/或生长抑素受体(somatostatin receptor)PET-CT扫描。关于转移的治疗,同一指南建议对孤立性转移/局部疾病和低转移性疾病负荷进行限于局部的治疗。
![]()
总结
特别是考虑到进袭性垂体肿瘤和垂体癌的罕见性,以及可获得的数据的稀缺性,ESE指南对临床医生提供了巨大的帮助,为此类肿瘤的治疗提供了至关重要的指导。然而,对诊断(如何分类肿瘤生长速度,如何预测进袭性行为,等等)和治疗(是否应在早期对部分选择的进袭性肿瘤患者使用TMZ治疗,是否有时应该用Stupp协议来代替单独放疗,等等)重要的几点,仍然没有答案或只是部分性得到回答。因此,迫切需要对这些问题进行研究,以提供基于证据的答案和建议,这将极大地帮助这些肿瘤患者和治疗他们的临床医生。






