Tomohiro Aoki等人认为仔细比较具有不同特征的IAs能够提供关于IAs破裂机制的重要见解。因此,他们开展了此项研究,利用新建立的IA自发破裂的大鼠模型,对该模型进行了仔细检查评估,目的是阐明与IAs病变破裂相关的组织病理学特征。
——摘自文章章节
【REF: Miyata H, et al. J Neurosurg. 2019 Aug 16:1-11. doi:10.3171/2019.5.JNS19405.】
研究背景
颅内动脉瘤(intracranial aneurysms, IAs)是颅内动脉的局部膨出,常见于一般人群,患病率为1%-5%。虽然大多数IA由于尺寸较小(直径通常<5mm)属于无症状病变,但先前存在的IAs破裂后容易发生致死性的蛛网膜下腔出血(subarachnoid hemorrhage, SAH)。SAH后死亡率高达50%,存活者多遗留永久性残疾。考虑到SAH发病后预后不良,了解IAs破裂的机制和预防破裂显得非常重要;然而,关于引发此类病变破裂的许多机制仍有待阐明。既往研究中利用大鼠颅内动脉瘤模型来研究颅内动脉瘤形成和进展的调节机制,在该模型中,基于血流动力学应力触发IAs形成的概念,通过增加颅内动脉分叉部位负载的血流动力学应力来诱导IAs病变。
目前普遍认为IAs的存在是由高的壁剪切应力所触发的慢性炎症性疾病,并由炎症反应维持或加剧,主要由浸润的巨噬细胞调节。最近,有研究报道建立了半数以上IAs自发破裂的大鼠模型,导致实验期间发生SAH。来自日本大阪国立大脑和心血管中心分子药理学系的Tomohiro Aoki等人同样报道独立建立了以上的新的大鼠模型,在新的大鼠模型中,切除双侧卵巢,结扎一侧颈总动脉(common carotid artery, CCA)后,增加结扎对侧颈外动脉(externalcarotid artery, ECA)和翼腭动脉,可以最大限度地增加雌性大鼠颈动脉结扎对侧分叉部位的血流负荷。重要的是,在大脑前动脉(anterior cerebral artery, ACA)-嗅动脉(olfactoryartery, OA)分叉处诱导的IA从未发生破裂。这意味着在新的大鼠模型中,可以获得具有不同特征的标本,即破裂的IAs、易破裂的IAs和从不破裂的IAs。Tomohiro Aoki等人认为仔细比较具有不同特征的IAs能够提供关于IAs破裂机制的重要见解。因此,他们开展了此项研究,利用新建立的IA自发破裂的大鼠模型,对该模型进行了仔细检查评估,目的是阐明与IAs病变破裂相关的组织病理学特征,结果发表在2019年8月的《Journal of Neurosurgery》上。
研究方法
为诱导IAs,研究者对雌性Sprague Dawley大鼠进行双侧卵巢切除术后结扎左侧颈总动脉、右侧颈外动脉和右侧翼腭动脉;联合高盐饮食及/或血管紧张素II以及一种特异的一氧化氮合酶抑制剂来诱导全身性高血压;结扎左侧的肾动脉;术后即刻喂食含8%NaCL和0.12%3-氯基丙腈(赖氨酰氧化酶的抑制剂)的食物在动脉瘤诱导后的观察期内,对所有死亡动物进行尸检,检查由于IAs破裂所导致的SAH发作;随后剥离右侧ACA-OA分叉部位及其他包括诱导的IAs病变在内的动脉如前交通动脉(anterior communicating artery, ACoA)或后交通动脉(posteriorcommunicating artery, PCoA)用于制备连续冰冻切片并进行组织病理学分析。滋养血管被定义为IAs病变血管外膜中存在的毛细血管样结构,免疫组化中α-SMA染色呈阳性,计算每张切片中滋养血管的总数,使用ImageJ软件计算总面积。巨噬细胞、中性粒细胞或T细胞分别定义为免疫组化中CD68、MPO或CD3阳性细胞。通过比较大鼠模型中破裂IAs、易破裂IAs(ACoA或PCoA处未破裂IAs)和ACA-OA分叉处IAs的组织病理学特征,确定触发或调解IAs病变破裂的因素。
研究结果
结果提示,约1/3(16/42)的手术动物发生动脉瘤性SAH,使用7T MRI的MRA分析中发现,外科干预诱导IAs后颈部和颅内动脉血流显著改变,Willis环血管系统变得迂曲;相位对比MRI分析中发现手术操作后右侧ICA和BA的平均血流量和流速显著增加,与血流模式的改变一致;另外,破裂IAs的部位仅在ACoA或PCoA,与人类IAs病例中最常见的破裂部位一致(图1)。

图1. 动脉瘤诱导后SAH的发生率、血管系统的形态学改变、血流改变以及ACoA或PCoA处动脉瘤的形成。A:结扎左侧CCA、右侧ECA和右侧翼腭动脉以及钠超负荷诱导全身高血压的10周龄雌性双侧OVX大鼠(n=20)SAH的累积发生率。B:动脉瘤诱导后血管的形态学变化。在10周龄雌性大鼠手术操作诱导IAs之前(前面)和之后(后面)获取MRA图像。箭和箭头分别表示ACoA或PCoA。注意手术操作后PCoA的显著扩张和弯曲。C:右侧ICA和BA的平均血流量和流速的连续变化。在手术操作前和操作后1、12和29天,通过相位对比MRI分析连续测量右侧ICA和BA的平均血流量和速度。所有条形图均显示平均值±SEM(n=4)。采用Kruskal-Wallis检验进行统计学分析。*p<0.05。D和E:未破裂(容易破裂,D)和破裂(E)动脉瘤大鼠的脑表面和Willis环的宏观视图。箭和箭头分别表示ACoA或PCoA诱导的IA病变。
使用破裂的IAs、PCoA或ACoA处诱发的易破裂IAs和大脑前动脉-嗅动脉分叉处诱发的从未破裂的IAs进行的组织病理学检查时发现:与人类IAs病例报道的结果一致,IAs体积较大、内皮细胞或平滑肌细胞丢失、血栓形成、CD68阳性巨噬细胞和MPO阳性中性粒细胞浸润病灶的数量增加、存在脂质蓄积,滋养血管的形成是破裂和易破裂IAs病变的显著特征(表1)。有趣的是,只有IAs的大小和病变中存在滋养血管在破裂和未破裂IAs之间存在显著差异(表1)。
表1. ACA-OA分叉处、未破裂但易于破裂的IAs和破裂IAs的组织病理学特征
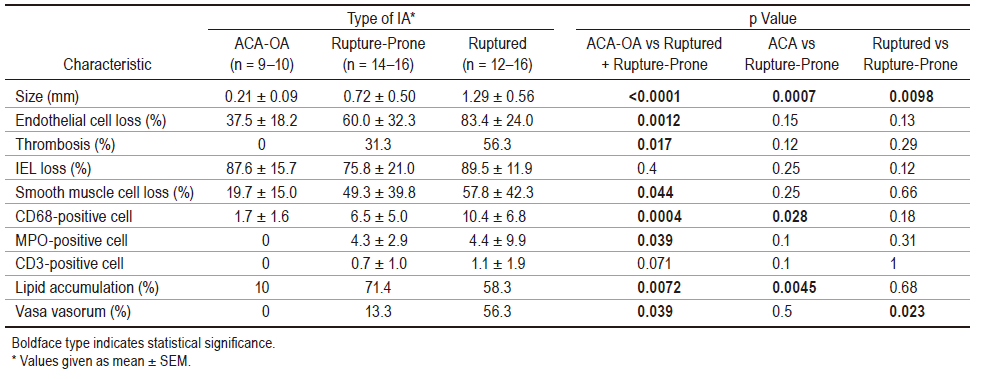
此外,破裂IAs中滋养血管的平均数量(1.75±2.84,n=16)显著高于易于破裂的IAs(0.2±0.54,n=16)或ACA-OA分叉处诱导的IAs(0, n=10;图2左)。破裂IAs中滋养血管的面积(601.1±812.8 um², n=16)也显著大于易于破裂的IAs(59.8±158.7 um²,n=16)或ACA-OA分叉处诱导的IAs(0 um², n=10;图2右)。
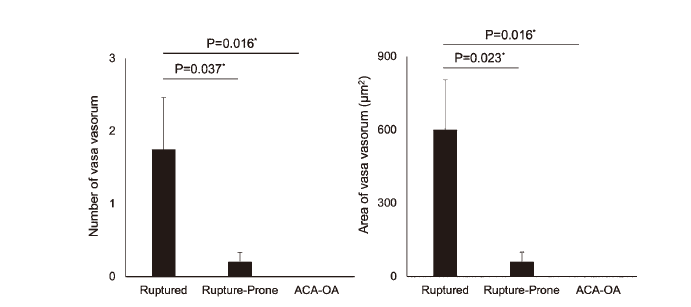
图2. 破裂的IAs病变中滋养血管形成的丰富程度。显示了破裂IAs(n=16)、易于破裂的IAs(n=16)或ACA-OA分叉处诱导的IAs(n=10)中滋养血管的数量(左侧)和面积(右侧)。所有条形表明了平均值±SEM。采用Kruskal-Wallis检验和Steel检验进行统计分析。*p<0.05。
组织病理学同时提示破裂病变周围的外膜中可以检测到滋养血管夹带着中层的平滑肌细胞,尤其是破裂点周围(图3A和3B),滋养血管形成附近的部分病灶中可观察到丰富的CD68阳性细胞聚集(图3C和3D)。而且,破裂点周围有许多免疫组织化学MMP-9阳性信号(图3E和3F)。
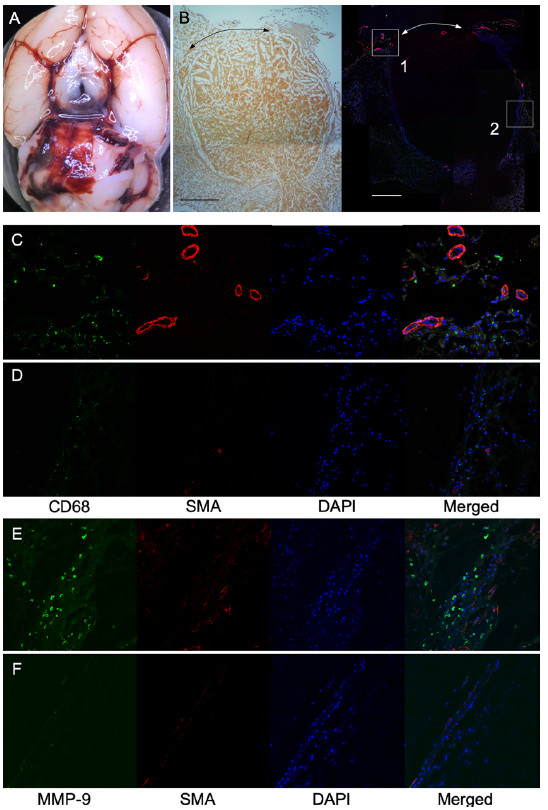
图3. 图像显示破裂部位周围滋养血管和浸润的巨噬细胞。A:SAH大鼠脑表面的宏观图像。B:通过EVG染色(左)和免疫组化(右)对破裂的动脉瘤进行组织学检查。B中的箭头表示动脉壁的破坏。C-F:存在具有α-SMA阳性中膜的滋养血管、CD68 阳性巨噬细胞的大量浸润和破裂部位周围MMP-9阳性信号占优势。免疫染色图像中CD68(绿色,C和D),MMP-9(绿色,E和F)和SMA(红色,B-F),DAPI(核染色)。
以上结果显示滋养血管形成是与IAs破裂相关的事件,另外,鉴于巨噬细胞通过介导微环境中的慢性炎症对IAs的形成和进展发挥重要作用,滋养血管的形成可能是一个促进病变中巨噬细胞浸润的事件,从而进一步触发/加剧炎症反应和动脉壁的破坏,导致病变破裂。
研究结论
最后,作者指出,他们成功改良了已建立的大鼠颅内动脉瘤模型从而诱导IAs病变自发破裂和动脉瘤性蛛网膜下腔出血。通过在已建立的模型中诱导的破裂IAs病变和未破裂IAs病变之间的组织病理学特征比较,研究者确定滋养血管形成是与损伤破裂相关的事件。这种外膜的结构变化可能提供了IAs病变中巨噬细胞聚集的途径,并进一步触发炎症导致IAs破裂。因此,可能可以通过识别滋养血管形成来检测容易破裂的“危险”病变,或通过干扰滋养血管形成来防止IAs破裂。本研究的发现为IAs的发病机制提供了重要见解。





