TTfields treatment affects tumor growth rates: a post-hoc analysis of the pivotal phase 3 EF-14 trail
Ze’ev Bomzon, PhD, Director of Science, Novocure
EF-14试验结果
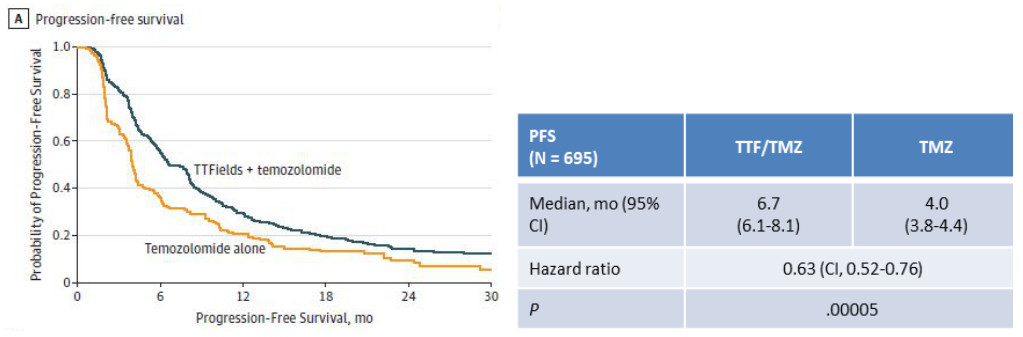
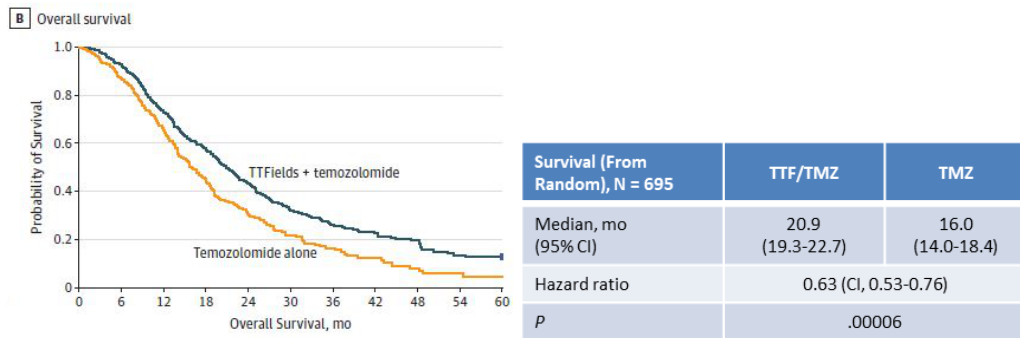
在新诊断WHO IV级胶质母细胞瘤患者中进行的一项III期临床试验(EF-14)中, TTFields+TMZ联合治疗组中位无进展生存期(PFS,图A)为 6.7个月,而TMZ单用组中位PFS仅有4.0个月;总生存期(OS,图B)分别为20.9个月和16.0个月,P<0.01[1]。加用TTFields治疗,可以使患者的无进展生存期和总生存期得到获益。
EF-14研究中,TTFields剂量与患者生存的相互关系
EF-14研究的亚组分析显示,TTFields的局部最低剂量密度(LMiDD;用mW/cm³表示)与患者生存获益存在相关性。
LMiDD≥0.77mW/cm³的患者中位总生存期OS为25.2个月(95% CI, 21.7-30.5),而LMiDD<0.77mW/cm³的患者的中位总生存期OS为20.4个月(95% CI, 16.6-22.7)。中位无进展生存期PFS分别为8.5个月(95% CI, 6.6-10.6)和6.7个月(95% CI, 5.8-8.1)[2] 。

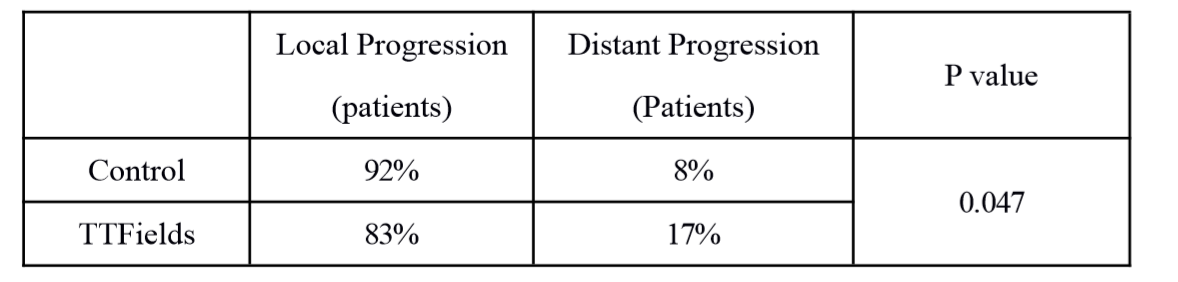
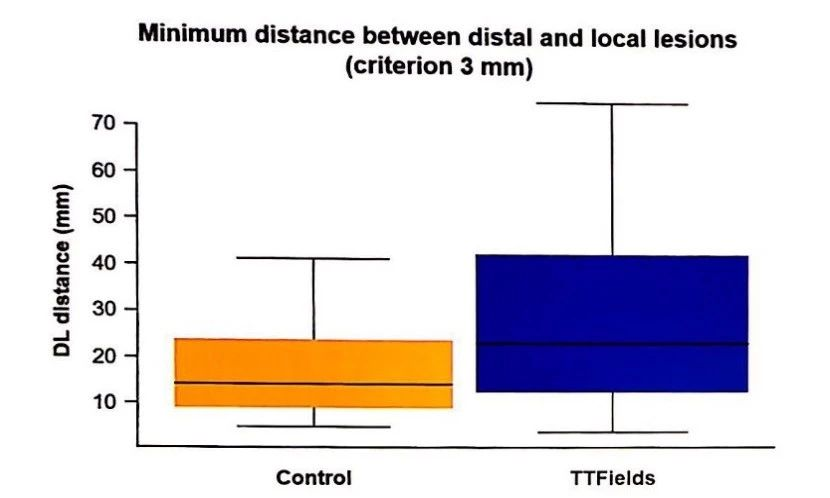
TTFields治疗患者更少出现原位进展
数据表明,使用TTFields治疗的患者,原位进展发生率为83%,而在对照组中,原位进展发生率为92%;与之相应的是,远端进展在TTFields治疗组中显得更为常见。TTFields治疗组的远端病灶与原发病灶的距离,比对照组更远。
对EF-14试验中只进行活检手术的患者进行的一项亚组分析显示,TTFields+TMZ联合治疗组和TMZ单用组呈现出不同的肿瘤比生长速率。这也说明,TTFields治疗可以影响肿瘤的生长模式。
远端进展的出现可能由于以下几个原因导致。首先,TTFields根据肿瘤位置进行个体化定位,电场强度集中于肿瘤发生位置,以达到最佳治疗效果;其次,在出现远处肿瘤复发脑区,放射野未覆盖或覆盖剂量不足,是原因之一;第三,使用TTFields的患者生存时间延长,所以更有机会观察到远端转移的发生。
肿瘤生长速率改变
比生长速率Specific Growth Rate (SGR):

在Stensjøen等人进行的一项未经治疗的胶质母细胞瘤体内生长动态研究中,共有106位GBM患者入组。研究发现,肿瘤体积的自然对数和SGR之间有着明显的负相关。中位SGR在不同大小的肿瘤中有着明显差异。小体积肿瘤 (<3.88mL, n=26), 中体积肿瘤 (≥3.88mL ,<36.88mL, n=54), 和大体积肿瘤(≥36.88mL, n=26) 的中位SGR分别每天3.9%, 1.2%和0.3%。[3]
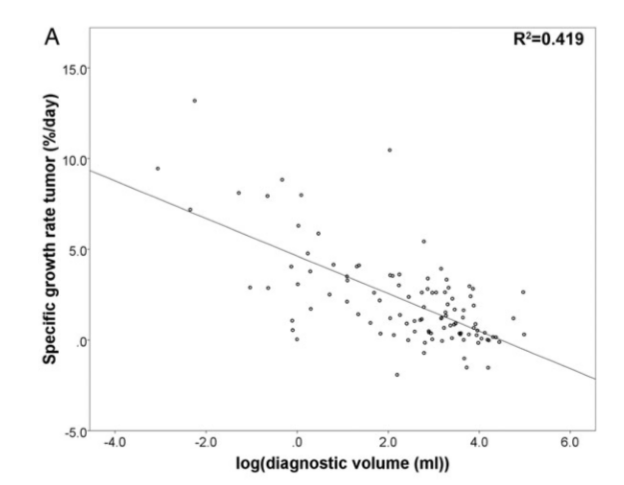
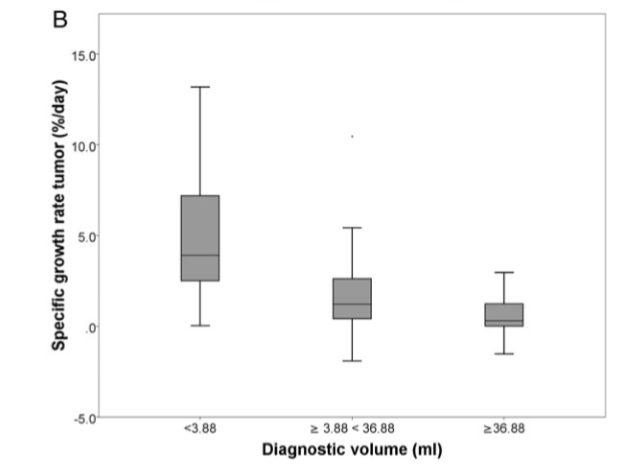
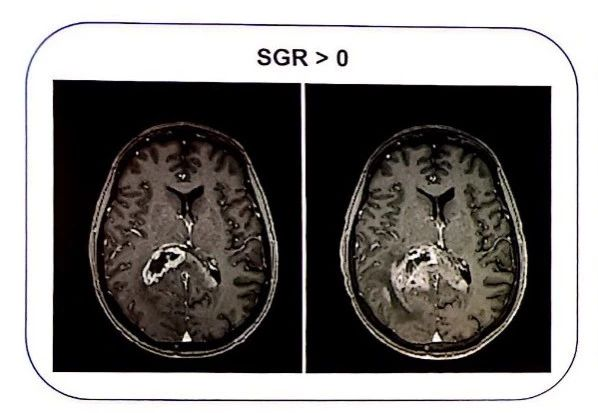
肿瘤生长模式举例
下面两组MRI图像分别展示了SGR>0和SGR<0两种不同的肿瘤生长模式。SGR>0,肿瘤体积增大;SGR<0,肿瘤体积缩小。

总结
1. TTfields减缓原发肿瘤生长,影响肿瘤生长模式。
2. 考虑调整TTFields治疗计划,例如TTFields覆盖范围、剂量密度,以便更好的控制肿瘤进展。
3. TTFields剂量分布和肿瘤进展之间的关联还需要进一步研究。
展望
TTFields是一种新的脑胶质瘤治疗模式,在传统的放疗、化疗和靶向治疗之外,为医生和患者提供了新选择。循证医学证据表明,TTFields无论是用于复发还是新诊断GBM均有治疗作用,EF-11、EF-14两项临床试验的结果,奠定了TTFields的基础。TTFields与放化疗以及靶向治疗联合,是否有1+1>2的协同效果,患者是否可以得到更好的获益,还值得我们继续进行科学探讨。
TTFields可以影响肿瘤的生长模式,其内在机理、基因表达以及表观遗传学的改变,同样值得深入研究。另外,在卫生经济学加以改善的情况下,TTFields在广大患者和医护人员中的使用率和接受率都将进一步提高。
[1] Stupp R, Taillibert S, Kanner A, et al. Jama, 2017, 318(23):2306.
[2] Matthew T. Ballo et al. Int J Radiation Oncol Biol Phys, Vol. 104, No. 5, pp. 1106-1113, 2019.
[3] Growth dynamics of untreated glioblastomas in vivo. A L Stensjøen et al. Neuro-Oncology 17(10), 1402–1411, 2015.

马文斌教授




