
摘要
目的:
探讨不同QST分型儿童颅咽管瘤的临床特点及其在预后评估中的作用。
方法:
回顾性纳入1998年12月至2015年12月南方医科大学南方医院神经外科收治的149例原发儿童颅咽管瘤患者,其中70例(47.0%)采用经前纵裂入路,46例(30.9%)采用经翼点入路,33例(22.1%)采用经蝶窦入路切除肿瘤。术后对所有患者行临床随访,包括复查鞍区MRI判断肿瘤切除程度和复发情况,根据临床症状、Karnofsky功能状态评分、生活工作情况等综合评价患儿预后。按照QST分型标准对149例患儿进行分型,比较不同类型患儿的临床特点。进一步采用多因素logistic回归分析影响患儿预后的临床因素。
结果:
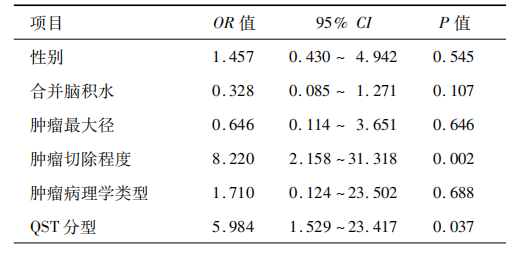
149例患儿手术均成功,其中138例(92.6%)为全切除,11例(7.4%)为次全切除。149例患儿的中位随访时间为87个月(11~236个月)。随访期间,134例预后良好,15例预后不良。按照QST分型标准,149例患儿中,Q型91例(Q型组),S型14例(S型组),T型44例(T型组)。3组患儿的年龄、性别、肿瘤最大径、肿瘤钙化程度、肿瘤切除程度及术后肿瘤复发间的差异均无统计学意义(均P>0.05),但在临床症状、合并脑积水、术前和术后垂体功能、手术入路及肿瘤病理学类型方面的差异均有统计学意义(均P<0.05);其中T型更常合并脑积水,Q型垂体功能更易出现异常,S型更易出现视力、视野受损。多因素logistic回归分析显示,QST分型(OR=5.984,95%CI:1.529~23.417,P=0.037)和肿瘤切除程度(OR=8.220,95%CI:2.158~31.318,P=0.002)是影响预后的独立危险因素。
结论:
不同QST分型颅咽管瘤患儿的临床特点不同,且QST分型是影响颅咽管瘤患儿预后的独立危险因素之一。
1.临床资料:回顾性纳入1998年12月至2015年12月南方医科大学南方医院神经外科行手术治疗的149例儿童颅咽管瘤患者,其中男89例,女60例;年龄为(6.5±1.3)岁(2~14岁)。149例患儿中,34例(22.8%)存在脑积水症状,63例(42.3%)头痛,30例(20.1%)恶心、呕吐,30例(20.1%)复视,62例(41.6%)视力下降,47例(31.5%)视野缺损,99例(66.4%)生长迟缓,11例(7.4%)记忆障碍,7例(4.7%)注意力不集中,4例(2.7%)意识障碍。纳入标准:(1)年龄≤14岁;(2)由同一术者手术并参与围手术期管理和随访;(3)术后病理学证实为颅咽管瘤;(4)获得5年以上随访。本研究经南方医科大学南方医院伦理委员会批准(批准号:2010伦审字96号)。
2.影像学资料:所有患儿均行头颅CT、MRI检查,必要时行蝶鞍区薄层扫描。根据CT扫描评估肿瘤钙化的严重程度,分级标准为:(1)无明显钙化;(2)轻度钙化:散在小片状及蛋壳样钙化;(3)重度钙化:斑块或骨样钙化直径>1cm[7]。149例患儿肿瘤的最大径为(3.8±1.1)cm(1.3~7.4cm);其中83例(55.7%)患儿的肿瘤轻度钙化,10例(6.7%)严重钙化,56例(37.6%)无钙化。
3.内分泌评估方法:术前和术后评估患儿的垂体功能。(1)促肾上腺皮质激素(ACTH)缺乏症:刺激试验(胰岛素低血糖试验、胰高血糖素试验、短期促皮质素试验)后皮质醇峰值<500nmol/L,或血中皮质醇峰值<100 nmol/L;(2)生长激素(GH)缺乏症:胰岛素有效刺激试验结果峰值<10ng/ml,或根据患儿延迟发育和矮小体征进行诊断;(3)促甲状腺素(TSH)缺乏症:TSH水平低下或“不适当地正常”,伴随甲状腺激素低于正常值。(4)促性腺激素缺乏症:根据卵泡刺激素(FSH)和促黄体激素(LH)水平判断。149例患儿术前的评估结果为,80例(53.7 %)ACTH缺乏症,102例(68.5%)GH缺乏症,72例(48.3%)TSH缺乏症,65例(43.6%)促性腺激素缺乏症。
4.手术方法:149例患儿中,70例(47.0%)采用经前纵裂入路,46例(30.9%)采用经翼点入路,33例(22.1%)采用经蝶窦入路。术后3d行头颅MRI平扫及增强扫描,判断肿瘤切除程度。术后复查MRI未见肿瘤残留为全切除,存在强化的微小残留病灶为次全切除。
5.QST分型方法(图1):根据围绕垂体柄的蛛网膜膜性结构将其分为4段,分别为鞍膈下、袖套外、袖套间及袖套内疏松部[8]。颅咽管瘤的起源位置与蛛网膜关系密切。根据颅咽管瘤起源位置不同,可将其分为Q型、S型及T型:Q型起源于垂体柄的鞍膈下,垂体柄蛛网膜外、蛛网膜内及蛛网膜下节段均位于肿瘤上方,通常被硬脑膜和鞍上蛛网膜包裹;S型起源于垂体柄的蛛网膜外节段和内节段,肿瘤主体位于垂体柄周围的蝶鞍上蛛网膜下腔;T型起源于垂体柄远侧部周围Rathke囊残存的上皮细胞,肿瘤将第三脑室向上推,第三脑室腔常被肿瘤所占据[2,9]。

6.随访方法:术后对所有患儿进行临床随访,随访内容包括复查鞍区MRI以判断肿瘤复发情况;采用Duff等[10]的方法评估患儿预后,预后良好符合以下标准:(1)患者依然存活;(2)无与治疗或肿瘤发展相关的严重运动障碍或功能性视力减退;(3)Karnofsky功能状态评分(KPS)≥80分;(4)儿童和青少年在接受治疗后1年内在校情况良好,适龄成年人就业能力正常;(5)不因心理或情绪问题受打击。若未完全符合预后良好标准的患儿即预后不良。
7.统计学方法:采用SPSS 22.0软件进行统计学分析。符合正态分布的计量资料以x±s表示,3组间比较采用方差分析;计数资料采用例数和百分率表示,组间比较采用卡方检验或Fisher精确检验。采用多因素logistic回归分析影响患儿预后的临床因素。以P<0.05为差异有统计学意义。
结果
1.手术结果:149例患儿手术均成功,其中138例(92.6%)为全切除,11例(7.4%)为次全切除。术后病理学诊断结果为,145例为造釉细胞型颅咽管瘤,4例为鳞状乳头型颅咽管瘤。术后内分泌检查结果为,84例(56.4%)ACTH缺乏症,97例(65.1%)GH缺乏症,72例(48.3%)TSH缺乏症,66例(48.3%)促性腺激素缺乏症。
2.随访结果:149例患儿的中位随访时间为87个月(11~236个月)。随访期间,MRI显示14例(9.4%)肿瘤复发。149例患儿中,134例(90.0%)预后良好,15例(10.0%)预后不良。
3.QST分型结果和各型临床特点的比较结果:按照QST分型标准,149例患儿中,Q型91例,S型14例,T型44例。由表1可见,3组患儿的年龄、性别、肿瘤最大径、肿瘤钙化程度、肿瘤切除程度及术后肿瘤复发间的差异均无统计学意义(均P>0.05),但在临床症状、合并脑积水、术前垂体功能、手术入路、肿瘤病理学类型及术后垂体功能方面的差异均有统计学意义(均P<0.05);其中T型更常合并脑积水,Q型垂体功能更易出现异常,S型更易出现视力、视野受损。
表1. 不同QST分型颅咽管瘤患儿临床资料的比较结果
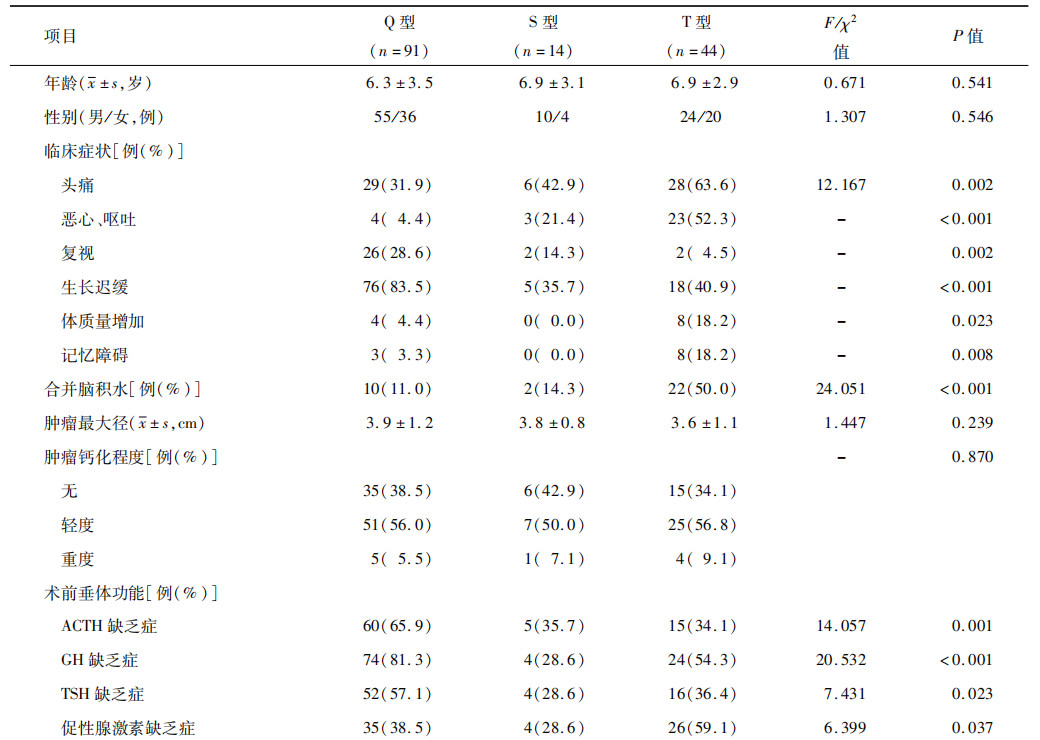
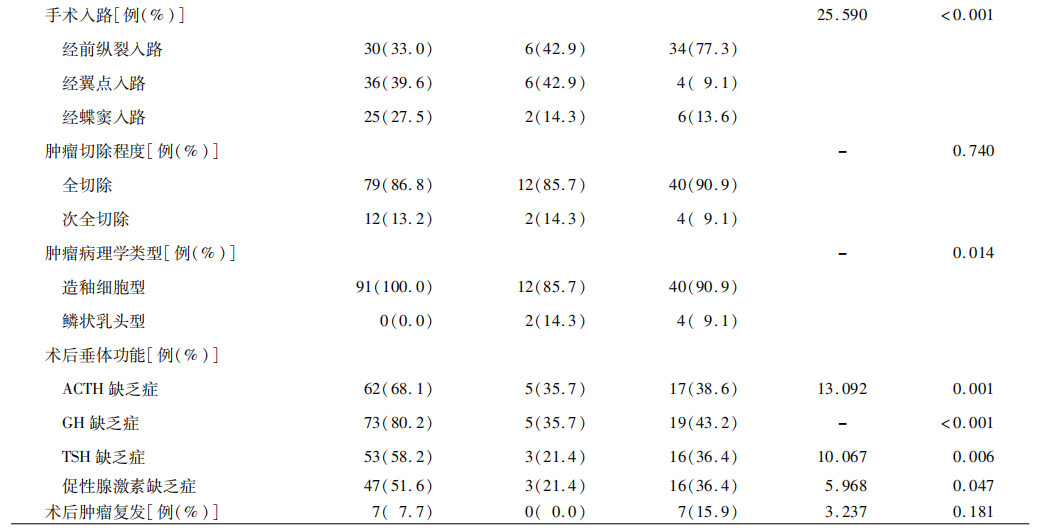
注:ACTH为促肾上腺皮质激素,GH为生长激素,TSH为促甲状腺素,“-”为无此数据。
4.影响颅咽管瘤患者预后的多因素logistic回归分析结果(表2):多因素logistic回归分析显示,患儿的性别、合并脑积水、肿瘤最大径及肿瘤病理学类型不是影响预后的独立危险因素(均P>0.05),QST分型和肿瘤切除程度是影响预后的独立危险因素(均P<0.05)。
讨论
颅咽管瘤是一种治疗难度较大的鞍区肿瘤[8],治疗方案多样,得到多个领域的共同关注。目前,颅咽管瘤有诸多分型方法,主要依据包括肿瘤与鞍膈或垂体柄的关系[9]、肿瘤的范围[10]、肿瘤与结节漏斗的关系[11-12]及下丘脑的受累程度[13]等。然而,在临床实际工作中发现,很多颅咽管瘤无法根据上述方法进行确切分型。文献报道,由于颅咽管瘤的错误分型导致手术入路选择不当[8,14-15],从而导致肿瘤不完全切除或部分切除,同时术后需辅以放疗。QST分型是基于颅咽管瘤起源的分型方法,本研究据此对149例患儿进行分型,探讨每种类型的临床特点,进一步采用多因素logistic回归分析QST分型对预后的影响,以期加深神经外科医生对颅咽管瘤的认识,同时有助于选择合适的手术入路。
一、QST分型的临床意义
1.选择正确的手术入路:颅咽管瘤的手术治疗以全切除为主要目的[11-13],恰当的手术入路是成功完成手术的重要保障。而QST分型为术者正确选择手术入路提供帮助,因此具有重要意义。本研究发现,经蝶窦入路是治疗Q型颅咽管瘤的最佳通道,可避免损伤视交叉和第三脑室;经轴外入路是治疗S型颅咽管瘤的最佳通道,可较好地保护第三脑室–垂体柄-垂体的连续性。经前纵裂经终板入路是治疗肿瘤上边缘超过中间块的T型肿瘤的最佳通路,可使肿瘤得到充分显露。
2.对手术的预测作用:文献报道,预测颅咽管瘤对周边结构的粘连情况对于手术成败至关重要[14]。QST分型可预测手术的关键位置和肿瘤切除难度,同时还可预测肿瘤与周边结构的粘连情况,其中T型颅咽管瘤由于与下丘脑关系密切,甚至部分肿瘤与下丘脑粘连严重,因此手术难度大。而由于S型肿瘤与第三脑室底之间存在可靠的蛛网膜边界,所以即便是纵向延伸分级体系中V级肿瘤[15],S型颅咽管瘤的根治性全切除通常较Q、T型更为容易。
二、不同QST分型的临床特点
诸多文献报道颅咽管瘤患者会出现头痛、视力下降、视野缺损、发育迟缓、肥胖等临床症状[16-18]。同时也有研究发现,颅咽管瘤患者早期可出现食欲异常、记忆缺陷、行为异常及心理社会障碍等症状[19-20]。本研究发现,不同QST分型颅咽管瘤患儿的临床症状、病理学类型、脑积水的发生率及内分泌功能障碍的差异均有统计学意义(均P<0.05)。其中T型颅咽管瘤患儿更易出现头痛、恶心、呕吐等颅高压症状,以及下丘脑功能下降的相关症状。Q型颅咽管瘤患儿更易出现生长发育迟缓等内分泌功能障碍相关症状,考虑可能由于肿瘤对垂体的直接压迫和炎性反应所致[21]。S型颅咽管瘤主要在蛛网膜下腔生长,多数仅轻度压迫垂体柄和第三脑室底部,所以S型患者的垂体功能障碍通常不严重。而T型颅咽管瘤易卷入第三脑室底内生长,造成下丘脑损伤,所以下丘脑-垂体功能障碍常发生于此型肿瘤中。
三、QST分型对预后的指导作用
QST分型是以肿瘤起源及其与蛛网膜的关系为基础的分型方法[7],Q型起源于鞍膈下方,S型起源于垂体柄的蛛网膜外段和内段,T型起源于垂体柄袖套间段。本研究结果发现,QST分型是影响颅咽管瘤患儿预后的独立危险因素之一。文献报道,颅咽管瘤患者的下丘脑受累与较差的预后相关[16]。QST分型中,T型的下丘脑受累最为严重,分级可达到Sainte-Rose等[22]报道的最高级别(2级),其顶端被覆第三脑室室管膜和神经组织,主体突向第三脑室方向,经蝶入路手术时会破坏部分第三脑室底,造成软脑膜进入第三脑室底壁及第三脑室内,进而有碍于肿瘤的显露和切除,当手术切除时会不可避免地破坏第三脑室前部下丘脑及其血供,术后常会并发严重的下丘脑反应,因此T型预后较差。Q型起源于鞍膈下,肿瘤细胞与神经垂体细胞直接接触,其间存在胶质增生带,因此确保肿瘤全切除的同时会部分切除神经垂体组织,同时部分肿瘤可沿垂体柄长轴从鞍膈孔突出向鞍上生长,并卷入第三脑室底,因此Q型术后也会出现不良结局,但较T型发生率低。
S型主要向蛛网膜下腔池横向生长,与第三脑室底的下丘脑结构粘连不紧密,肿瘤与周边结构间存在不同形式的蛛网膜结构间隔,术中完全在蛛网膜下腔池内分离肿瘤,因此预后最好。另外,本研究结果显示肿瘤切除程度亦是颅咽管瘤预后的独立影响因素,说明颅咽管瘤应尽可能完全切除。
综上所述,QST分型是基于颅咽管瘤起源的分型方法,有充足的胚胎学证据,能切实反映肿瘤与周边结构的关系。不同QST分型颅咽管瘤患儿的临床特点不同,其中T型更常合并脑积水,Q型垂体功能更易出现异常,S型更易出现视力、视野受损。QST分型是影响颅咽管瘤患儿预后的独立危险因素之一。
参考文献










