在《Journal of Neurosurgery》创刊75周年之际,特邀美国杜克大学医学中心神经外科的John H. Sampson教授等回顾上述免疫治疗方式的最新经验、发展和预期挑战,发表在2019年9月的《Journal of Neurosurgery》上。
——摘自文章章节
【Ref: Fecci PE & Sampson JH . J Neurosurg. 2019 Sep 1;131(3):657-666. doi: 10.3171/2019.5.JNS181762.】
研究背景
近十年来,免疫治疗在实体性肿瘤,包括黑色素瘤、肺癌、乳腺癌、前列腺癌、膀胱癌和肾癌的应用越来越多,但对胶质母细胞瘤(GBM)的治疗仍未获得突破性进展。经过40多年的研究探索,针对GBM的免疫治疗有,嵌合抗原受体T细胞免疫疗法(CAR-T)、个性化新抗原疫苗、融瘤病毒和免疫检查点阻断等。在《Journal of Neurosurgery》创刊75周年之际,特邀美国杜克大学医学中心神经外科的John H. Sampson教授等回顾上述免疫治疗方式的最新经验、发展和预期挑战,发表在2019年9月的《Journal of Neurosurgery》上。
研究结果
一、过继淋巴细胞输注
该治疗属于肿瘤的被动免疫疗法,即收集靶向肿瘤抗原的自体T细胞,在体外激活扩增后再输回体内。早期的淋巴细胞过继转移(adoptive lymphocyte transfer,ALT)方法通过提供经过基因修饰的抗原特异性T细胞受体(T-cell receptor,TCR)-a和-b链,试图解决肿瘤特异性T细胞数量有限的问题。后期的研究集中解决绕过主要组织相容性复合物(major histocompatibility complex,MHC)的限制并靶向非蛋白性抗原两个难题,共同促进嵌合抗原受体T(chimeric antigen receptor,CAR-T)疗法的发展(图1)。
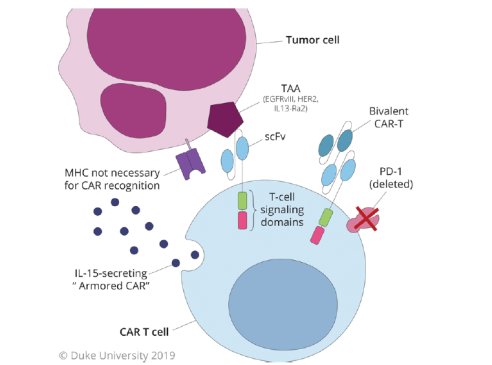
图1. CAR-T细胞疗法。转染CAR的T细胞能够以不依赖MHC的方式识别肿瘤细胞表面抗原,从而促进对肿瘤细胞的杀伤。
在GBM中,与CAR-T细胞相关的大多数研究都以EGFRvⅢ、IL13Ra2或HER2为靶点;最新的第四代CAR整合能够过度表达并可增强CARs在体内的功能和/或持久性的细胞因子,如IL-15,但其在临床上是否具有足够的抗肿瘤能力还有待观察。CAR治疗GBM的最主要的限制是肿瘤异质性(即肿瘤细胞可表达多种不同抗原),即使在单细胞水平也是如此。
应对肿瘤异质性的一种方法是设计具有多种特异性的CARs。如同时靶向HER2的scFv与靶向IL13Ra的IL-13突变蛋白连接组成的双特异性CAR以及靶向HER2、IL13Ra2和EphA2的三价CAR。与单价和二价CAR相比,三价CAR在GBM的临床前模型和在体外与原代人GBM细胞共培养时表现优越的抗肿瘤活性。应对肿瘤异质性的另一种方法是,着眼于赋予CARs诱发表位扩散和刺激内源性肿瘤特异性免疫力的能力,如设计新型CAR,使其能够鉴定宿主抗原呈递细胞(antigen-presenting cell,APC)启动内源性T细胞对抗多种未识别的肿瘤抗原,从而规避抗原丢失变异。
二、疫苗策略
目前大多数肿瘤疫苗都是在肿瘤确诊、标准治疗失败后作为治疗的选择。用于GBM的癌症疫苗可分为两大类:肽类疫苗和基于细胞的疫苗(图2)。
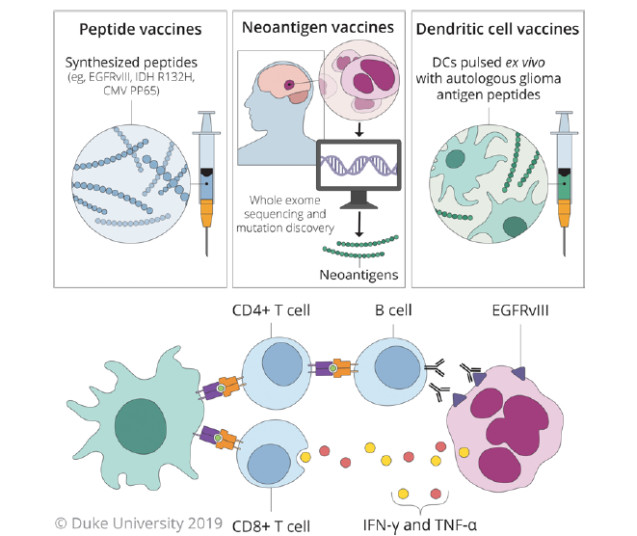
图2. GBM中使用的疫苗形式:肽类、新抗原和DC。每种疫苗形式的合成方法,包括肿瘤全外显子测序和新抗原鉴定技术(上图)。肽类和新抗原疫苗的递送目标是被内源性DC摄取,而DC疫苗则为给药前离体负载抗原。两种疫苗均刺激DC启动CD8+和CD4+T细胞,以实现针对肿瘤的细胞和体液免疫应答反应(下图)。版权归杜克大学所有,经许可后发布。
1.肽类疫苗
肿瘤的典型特征是大量的基因突变。突变基因编码蛋白/肽类能产生只在肿瘤中表达的抗原,称为肿瘤特异性抗原(tumor-specific antigen,TSA)。新发现的TSA称为“新抗原”。只有少数突变可加工成新表位,通过APC提呈至人类白细胞抗原(HLA)上引发T细胞应答。许多潜在的肿瘤抗原并非来自于突变,而是来源于其它组织中仍有错误表达或过度表达的正常蛋白(TAA)。由共有抗原为靶点可发生附带性自身免疫风险,如脑炎。因此,GBM中相对缺乏特异性和高度表达的抗原表位是限制开发疫苗的因素。
目前EGFRvⅢ仍然是针对GBM的最相关而且无争议的TSA,可在20%-30%的肿瘤中发现。上世纪90年代末,设计的一种肽类疫苗Rindopepimut(CDX-110),在鼠脑肿瘤模型中表现出极好的临床前疗效,包括诱导体液和细胞毒性T细胞应答。随后包含745例新诊断GBM患者的多中心、双臂Ⅲ期临床试验(ACT Ⅳ)显示,接受Rindopepimut治疗的患者表现良好的体液免疫应答,但中位总生存期(overall survival,OS)并未出现显著改善。ACT Ⅳ的结果令人失望,影响靶向EGFRvⅢ的多肽疫苗开发速度。目前,仍有其它靶向EGFRvⅢ的疫苗正在进行临床研究,如ADU-623(注册号:NCT01967758 clinicaltrial.gov)。
异柠檬酸脱氢酶(IDH)是一种罕见的、真正均匀表达的TSA。大约80%的低级别胶质瘤存在IDH突变,最常见的是IDH1中的R132H突变(占所有IDH突变的70%)。在临床前小鼠模型中,靶向R132H的多肽在MHC Ⅱ类(缺乏Ⅰ类抗原决定簇)抗原递呈后可引起抗原特异性CD4+T细胞和体液免疫应答。在IDH1R132H突变的Ⅲ级和Ⅳ级胶质瘤(注册号:NCT02454634,clinicaltrial.gov)及复发性Ⅱ级胶质瘤(注册号:NCT02193347,clinicaltrial.gov)中,正在进行研究多肽疫苗的Ⅰ期临床试验。
GBM的突变负荷相对较低,但肿瘤异质性仍然是无法回避的问题,尤其是只能选择单靶点设计疫苗治疗时。这种单靶点治疗也可引起抗原逃逸,即肿瘤不再表达靶向抗原,导致治疗失败。未来发展的首要方向是识别和组合多种新抗原候选物,并预测其HLA表现的能力。
最近的两项重要试验强调研制靶向新抗原的个体化癌症疫苗。在第一项研究中,通过比较来自切除的肿瘤和来自匹配的正常组织的全外显子测序数据,提取7-20个肽段制备个体化的癌症疫苗。第二项研究将两种新抗原与未突变的TAA结合使用,以增加可活化表位的数量。这两项Ⅰ期临床试验都产生数量可观的具有记忆表型和新抗原特异性克隆扩增的浸润性肿瘤反应性T细胞。
2.基于细胞的疫苗
基于细胞的抗肿瘤疫苗主要有两个种类:肿瘤细胞疫苗和树突状细胞(dendritic cell,DC)疫苗;其中DC疫苗最为常见,它的原理是将携带肿瘤抗原的树突状细胞扩增、负载和活化,进而发挥抗肿瘤功效。基于该原理设计开发的sipuleucel-T疫苗,是FDA批准的首个癌症疫苗。关于胶质瘤,美国、欧洲和日本已经发表大量采用DC的临床试验。但缺乏Ⅲ期临床研究证据证实其疗效,治疗试验过程需耗费大量人力与财力。Northwest Biotherapeutics根据Linda Liau及其同事开发的DC疫苗项目DCVax已进入Ⅲ期临床试验(注册号:NCT00045968和NCT02146066,clinicaltrials.gov),正等待结果。目前也有多项Ⅰ期和Ⅱ期临床试验(注册号:NCT00639639、NCT02465268和NCT02366728,clinicaltrials.gov)着眼于疫苗位点的预处理,以获得更好的淋巴结归巢效果,延长患者生存期。
三、基于病毒的治疗
在过去的30年中,针对GBM的病毒疗法已经过多次迭代,但尚未获得完全成功。最近的研究采用溶瘤病毒,目的是通过肿瘤细胞溶解启动内源性二次免疫应答反应(图3)。
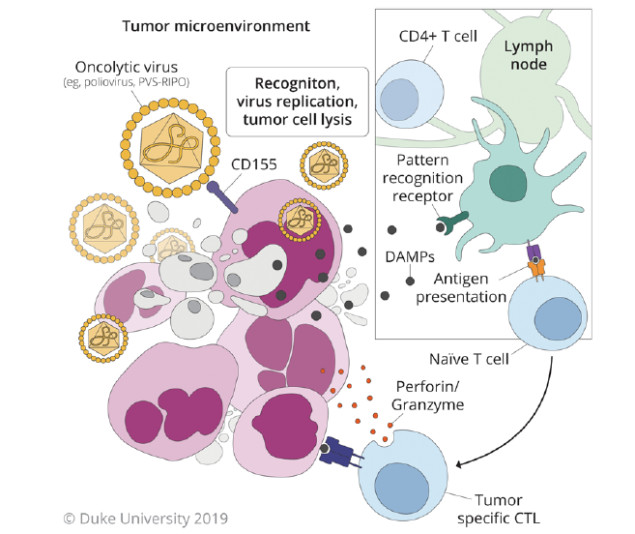
图3. 溶瘤病毒治疗。PVS-RIPO等病毒均为局部给药,目的是实现肿瘤特异性摄取或感染。肿瘤细胞的溶解促使抗原和DAMP的释放,从而刺激继发性免疫反应。版权归杜克大学所有,经许可后发布。
溶瘤病毒通常直接瘤内注射或置入手术切除后的瘤腔内。治疗的目标是感染和裂解肿瘤细胞,激发免疫原性细胞的死亡途径,通过损伤相关分子模式(damage-associated molecular pattern,DAMP)和TAA/TSA启动免疫应答,招募免疫细胞抵达位点。除促使DAMP释放外,溶瘤病毒本身还携带有与病原相关分子模式,能被免疫系统所识别,有望激发对肿瘤细胞的额外攻击。
FDA快速审查通过两种溶瘤病毒(DNX-2401和PVS-RIPO)。DNX-2401是一种具有复制能力的腺病毒,通过特定的突变限制病毒复制。该病毒含有精氨酸/甘氨酸/天冬氨酸基序,能够靶向GBM上的整合素,从而增加对肿瘤细胞的感染特异性。PVS-RIPO是具有复制能力的脊髓灰质炎减毒活疫苗/人鼻病毒嵌合体。这种病毒进入表达受体CD155细胞,CD155在恶性细胞上表达上调,也在APC上表达。在体外,PVS-RIPO对肿瘤细胞具有细胞毒性,并促进APC的慢性、亚致死性感染,从而导致促炎细胞因子的产生。在一项含61例复发性IV级恶性胶质瘤患者接受瘤内注射PVS-RIPO 的Ⅰ期研究中,发现24个月和36个月时的OS率均为21%。相比之下,历史对照组提示的24个月时OS率为14%,36个月时为4%。PVS-RIPO目前正在进行Ⅱ期临床试验。
四、检查点阻断治疗
免疫检查点是活化T细胞表面的分子,起“刹车”作用,防止炎症反应失控。通过经典的免疫检查点CTLA-4和PD-1发出的信号分别导致活化T细胞失活,甚至凋亡。阻断或拮抗免疫检查点分子可使T细胞持续激活(图4)。
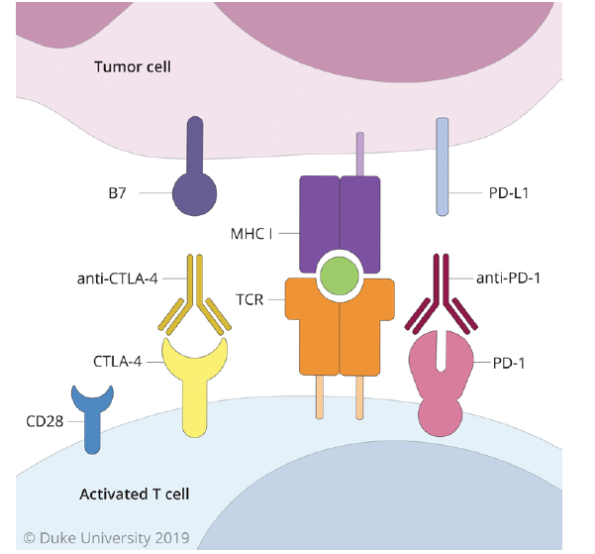
图4. 检查点阻断。活化的T细胞上调CTLA-4和PD-1等检查点,可分别结合肿瘤细胞上的B7和PD-L1。通过检查点传递信号导致T细胞失活、衰竭,甚至凋亡。检查点阻断疗法包括给予干扰配体与检查点结合的抗体,保持并延长T细胞活化状态。版权归杜克大学所有,经许可后发布。
CTLA-4是深入研究的免疫检查点受体。用ipilimumab等药物阻断CTLA-4可导致CD28的利用率增加,从而放大T细胞反应;2010年FDA批准治疗转移性黑色素瘤以来,现在已成为治疗几种类型癌症的药物,但其毒性限制应用于GBM。与CTLA-4类似,PD-1在生理条件下可调节免疫反应。PD-1与其配体PD-L1的结合通过降低TCR信号传导,减少关键转录因子(如激活蛋白1[activator protein, AP-1]和活化T细胞核因子[nuclear factor of activated T cells, NFAT])的诱导,导致T细胞活化受损。抗PD-1治疗其它癌症的早期试验显示,可促进持久的抗肿瘤反应,FDA已经批准nivolumab(抗PD-1,Bristol-Meyers-Squibb公司)和pembrolizumab(抗PD-1,Merck公司)的使用。检查点阻断疗法处理许多癌症已取得成功,但至今在治疗GBM上几乎未观察到显著疗效。现在的研究重点应是发现和解决导致治疗失败的原因。
五、未来的挑战
具独特性的GBM给免疫治疗带来一系列障碍,包括肿瘤突变负荷较低、肿瘤异质性广泛、药物/免疫细胞进入CNS受限以及最重要的可能是T细胞功能障碍。John H. Sampson教授提出要重点关注免疫接入和免疫抑制。
1.免疫接入
既往认为血脑屏障(blood-brain barrier,BBB)是阻碍免疫细胞进入CNS的限制因素,但新的研究结果逐步打破这一观点。因为失去血脑屏障保护的颅内肿瘤仍然会产生独特的免疫逃逸方式,阻碍免疫反应,阻止T细胞进入,并对免疫疗法构成新的障碍。例如,最近发现,颅内肿瘤可将T细胞“封印”在不会对肿瘤造成伤害的骨髓中,从而促进抗原忽视和免疫逃逸。因此,既往公认的CNS是 “免疫盲区”的概念已经在逐步淡化。但大脑免疫环境的特殊性继续挑战免疫平台。
2.免疫抑制
免疫功能紊乱是GBM患者的特征。对于GBM患者,有效的抗肿瘤反应所需的T细胞受到损害,表现为患者发生T细胞淋巴细胞减少症,以及典型的各种特征形式的T细胞功能障碍。隔离骨髓中的T细胞是一类新发现的T细胞功能障碍模式,它导致GBM患者血液中T细胞计数至AIDS水平,并严重限制T细胞进入CNS杀伤肿瘤。随着研究重点越来越多地转移到免疫检查点阻断和破译治疗耐药性,T细胞功能障碍成为首要的中心问题。T细胞衰竭可能是限制治疗成功的重要功能障碍模式。T细胞衰竭在早期是可逆的,但可迅速发展而无法挽救。联合多检查点阻断可成为阻止衰竭发生的希望;临床前研究发现在小鼠胶质瘤活体模型中,PD-1、TIM-3和LAG-3阻断间存在协同作用。目前正在进行单用靶向TIM-3和LAG-3及联合抗PD-1治疗GBM的临床试验(注册号:NCT02658981和NCT02817633,clinicaltrials.gov)。未来的研究需聚焦于理解肿瘤诱导衰竭的机制。
结论
最后,John H. Sampson教授总结性指出:①数十年来针对GBM的免疫治疗的努力,获得的成绩仍然有限。②肿瘤及中枢神经系统的特征向免疫治疗作出限制性挑战,包括限制药物和免疫途径、显著的异质性、低突变负荷以及肿瘤引起的严重T细胞和其它免疫功能障碍。③最新的挑战,如肿瘤导向将T细胞隔离于骨髓,强调研究大脑限制免疫反应复杂机制的重要性。④各种失败有利于更好地理解各种疗法所存在的局限性,并做出相应的调整。⑤必须重新关注预防和逆转T细胞功能障碍。





