
今天为大家分享的是,由上海交通大学医学院附属瑞金医院功能神经外科孙伯民教授团队带来的“脑深部电刺激的电极固定装置比较”,欢迎阅读、分享!
背景:
脑深部电刺激(deep brain stimulation, DBS)的准确性取决于精确的电极位置,从而实现理想的治疗效果。作为DBS装置重要的组成部分,电极固定装置的性能逐渐受到研究关注。本研究主要分析电极位移的可能原因,并提供相应的解决方案,以减少潜在人为误差。
方法:
回顾性分析2017年4月至11月在上海瑞金医院接受DBS手术的79例患者数据。通过C臂机透视测量术中的电极移位距离,记录并比较下列三种电极固定装置的调整次数:美敦力Stimloc、景昱TouchLoc以及传统电极固定装置。
结果:
研究提示电极位移的平均距离(±标准差)中,Stimloc为0.29±2.42mm,TouchLoc为0.43±0.55mm,传统固定装置为1.52±1.05mm(p=0.0001)。Stimloc平均调整次数为0.3±0.5次,TouchLoc为0.3±1.3次,传统固定装置为1.1±1.0次(p=0.0001)。三者两两比较(TouchLoc与Stimloc:p=0.273;TouchLoc与传统装置:p=0.0001;Stimloc与传统装置:p<0.0001)提示电极位移存在显着差异,并且主要归因于传统固定装置。
结论:
本研究对三种电极固定装置在电极固定精度方面的性能进行比较,其中新型电极固定装置已发挥其优势。除应用Stimloc和TouchLoc电极固定装置外,还应进行C臂机透视成像,从而在DBS电极植入时直观呈现电极位置深度偏差。
关键词:脑深部电刺激、电极固定装置
脑深部电刺激(deep brain stimulation, DBS)已成为难治性运动障碍的主要神经外科手术,包括帕金森病(Parkinson’s disease. PD),特发性震颤(essential tremor, ET)及原发性肌张力障碍[1]。电极位置的准确性始终被认为是DBS获得最佳治疗结果的重要因素,并且能够减少不必要的刺激相关副作用[2]。因此,已有多种成像方法用于测量DBS电极的实际位置,通常分为术中及术后影像学检查,包括C臂机透视,计算机断层扫描(computed tomography, CT)和磁共振成像(magnetic resonance imaging, MRI)[3,4]。随着DBS的发展,已有多项手术步骤经过优化改进以降低电极位移的可能性,其一便是电极固定装置[5,6]。
过去二十年DBS在国内快速发展,三家DBS制造商(美国美敦力公司、清华品驰及苏州景昱)提供了诸多DBS产品,其中也包括申请过专利的电极固定装置[7]。虽然这些电极固定装置的外观与规格不尽相同,但电极固定的性能对DBS的准确性至关重要,通常由上述成像方法在术中进行检验。然而国内的功能神经外科中心并非普遍具备术中CT和(或)MRI。因而C臂机因其可获得性及可靠性,在术中确认电极位置方面发挥了有效作用[4,8]。目前,描述电极固定装置中电极固定性能差异的文献并不多,但这样的比较将有助于DBS的手术优化并提高手术准确性。因此,本研究除提供这三种电极固定装置电极固定性能的分析外,还提供一种电极固定手术技术,旨在依据我中心DBS手术的丰富经验以降低人为误差(过去十年植入DBS电极超过2000侧)。
研究对象
本研究回顾2017年4月至11月期间在上海交通大学医学院附属瑞金医院接受DBS治疗的79名患者,包括顽固性运动障碍(PD,ET和肌张力障碍)以及难治性精神障碍(强迫症,神经性厌食症,药物成瘾和重度抑郁症)。经我中心至少两名神经外科医生常规术中C臂机透视检查确认电极位置。所有患者术前提供手术知情同意书,使用匿名患者数据已获得上海交通大学医学院附属瑞金医院伦理委员会的批准。
电极固定装置
本研究的电极固定装置来自三家DBS制造商,包括美国美敦力(Medtronic)、清华品驰(PINS Medical)及苏州景昱(SceneRay)。传统电极固定装置即美敦力与品驰DBS的固有装置,而Stimloc与TouchLoc装置分别由美敦力与景昱拥有相关专利(图1)。其中,传统电极固定装置即安装在颅骨钻孔的基环与盖子,以便在没有电极夹的情况下将电极压在基环凹槽。
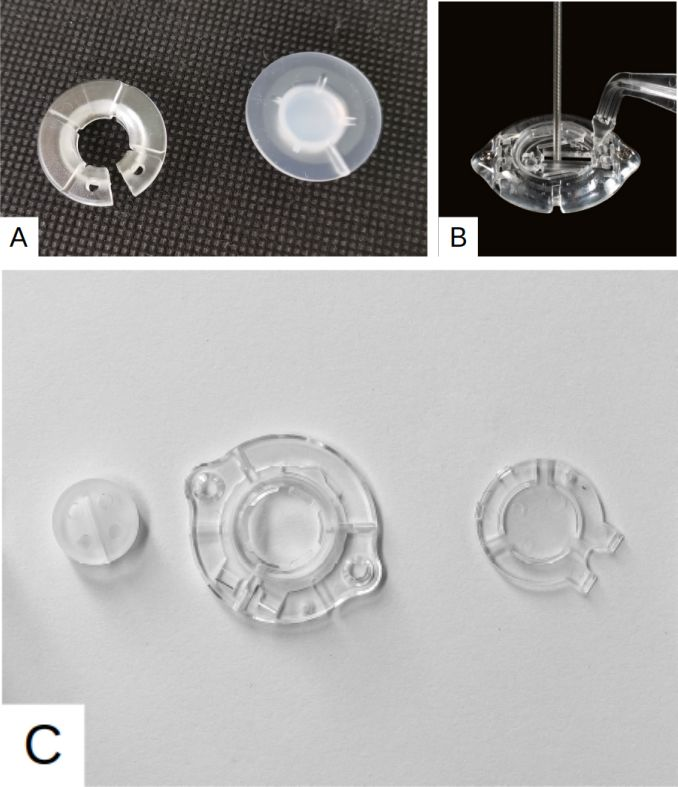
图1:本研究使用的三种电极固定装置。A. 传统电极固定装置:左侧为安装在颅骨钻孔的基环,右侧为盖子,将电极压在基环凹槽;B. 美敦力Stimloc电极固定装置:电极通过内置电极夹与辅助手柄固定在基环中间;C. 景昱TouchLoc电极固定装置:左侧为电极锁,安装在基环(中间),盖帽(右侧)以密封钻孔。
手术方案
以往研究对DBS手术的标准方案已有叙述[9,10]。简言之,靶点定位与全身麻醉后,患者仰卧位,根据靶点坐标作颅骨钻孔。钻孔中心应尽可能精确地位于DBS电极的放置位置。将电极固定装置安置在钻孔颅骨,以便DBS电极植入后固定导线。随后经C臂机透视首次确认电极位置,并利用电极末端触点到附着在DBS头架的十字参考环的距离作量化评价。当DBS导线的导丝和插管移除后,手术医生谨慎地将导线按压在固定装置的凹槽上。随后利用C臂机透视检查比较两次成像的电极位置。比较两者的相对位移并以电极触点的长度测量,故最小测量单位为0.5mm(图2)。继续调整电极深度,直至实际位置与原始位置间的差异在允许误差(0.5mm)范围内。此外,本研究还记录了电极固定期间的电极调整次数。完成调整后,将固定装置的盖子盖住锁定导线。使用传统电极固定装置时,应当使用C臂机透视进行第三次确认。当电极位置锁定,则将剩余导线环绕基环继续完成电刺激器的植入。
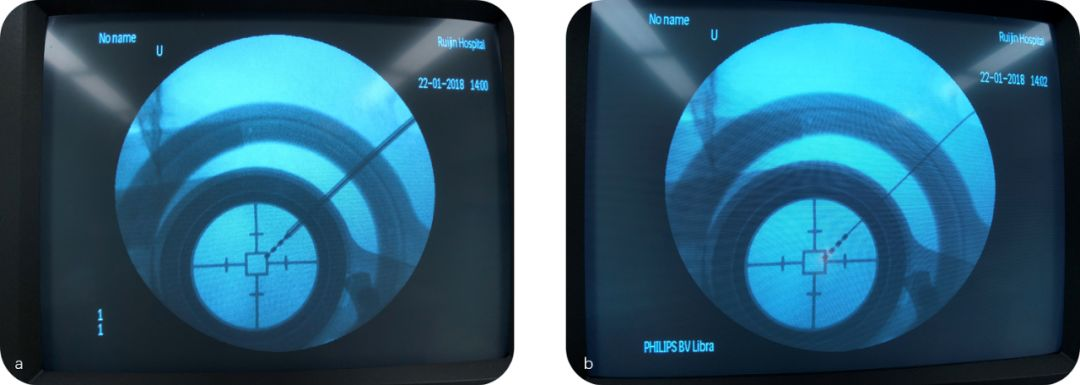
图2:使用C臂机透视的电极移位成像。a. 首次植入后的电极位置;b. 将导线压入基环凹槽后的电极位置。
统计分析
本研究的主要指标包括电极位移距离及电极调整次数。移位距离正值提示实际位置较手术计划偏深,负值即偏浅。除患者人口统计学特征的描述性统计数据外,鉴于电极位移距离及调整次数的非正态分布,本研究利用Kruskal-Wallis检验作为三种电极固定装置单因素方差分析(ANOVA)的非参数替代方法进行检验,并作配对比较。所有统计分析均使用SPSS 23.0版(IBM Corporation, Armonk, NY, USA),描述性结果表示为平均值±标准差(standard deviation, SD);显着性水平设定为0.05。
被试特征
本研究回顾接受DBS手术的79名患者(41名男性,38名女性;平均年龄56.8±16.2岁[范围17-79岁])(表1)。28名患者使用Stimloc,25例TouchLoc,其余26例使用传统电极固定装置。在传统装置中,6名患者使用美敦力的传统装置,其余为品驰的传统装置。这些患者分别包括49例PD、3例帕金森综合征、4例ET、14例肌张力障碍、1例强迫症、1例焦虑症、3例物质依赖、2例抽动障碍及2例患有抑郁症。手术电极靶点包括6例丘脑底核(subthalamic nucleus, STN)患者8根电极,66例苍白球内部部(globus pallidus internal, GPi)患者123根电极,5例腹侧内囊/腹侧纹状体患者10根电极,2例缰核患者4根电极,2例底丘脑后部患者4根电极,2例丘脑腹侧中间核患者4根电极。其中,5例患者因单侧症状(n=4)或调整刺激靶点(n=1)接受单侧DBS电极植入手术。所有手术均在全麻下进行,除3例ET患者在植入期间保持清醒,以进行术中刺激并观察潜在不良反应。
表1:三种电极固定装置入组患者的人口统计学特征
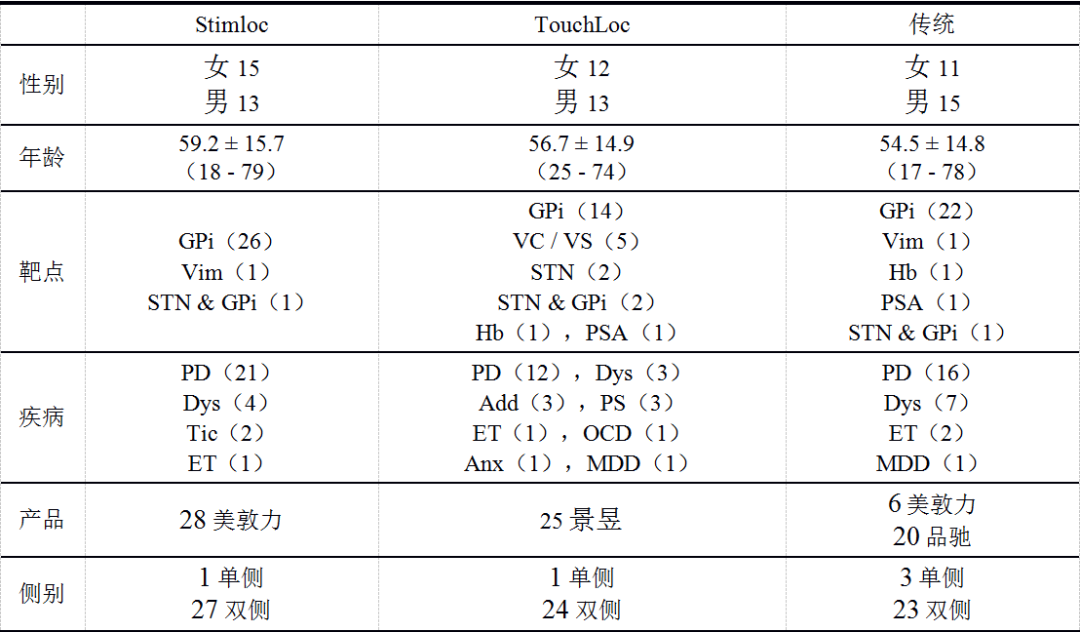
注:GPi:苍白球内侧部;Vim:丘脑腹中间核;STN:丘脑底核;VC/VS:腹侧内囊/腹侧纹状体;Hb:缰核;PSA:底丘脑后部;PD:帕金森病;Dys:肌张力障碍;Tic:抽动障碍;ET:特发性震颤;Add:物质依赖;OCD:强迫症;PS;帕金森综合征;Anx:焦虑障碍;MDD:抑郁症。
电极测量
研究结果提示多数记录的位移距离为0.5mm(占比30.7%)与1.0mm(15.7%)。尽管在34例患者的41侧电极植入中记录到0.0mm(26.8%),但鉴于误差允许范围,C臂机透视的两次成像间存在实质差异(图3)。三种电极固定装置所示平均位移距离分别为0.29±2.42 mm(Stimloc共55项记录)、0.43±0.55mm(TouchLoc共49项记录)、1.52±1.05mm(传统装置共49记录)。Kruskal-Wallis检验显示三种装置间存在显着的统计学差异(检验统计量=34.593,p<0.001)。与传统固定装置相比,Stimloc和TouchLoc装置表现出相近的电极固定性能。但是在Stimloc装置的位移距离中记录到-15.0mm和-6.0mm各1次的异常值。此外,负值位移距离记录(3.4%)提示表明电极位置通常在固定期间存在比手术计划偏深的倾向。
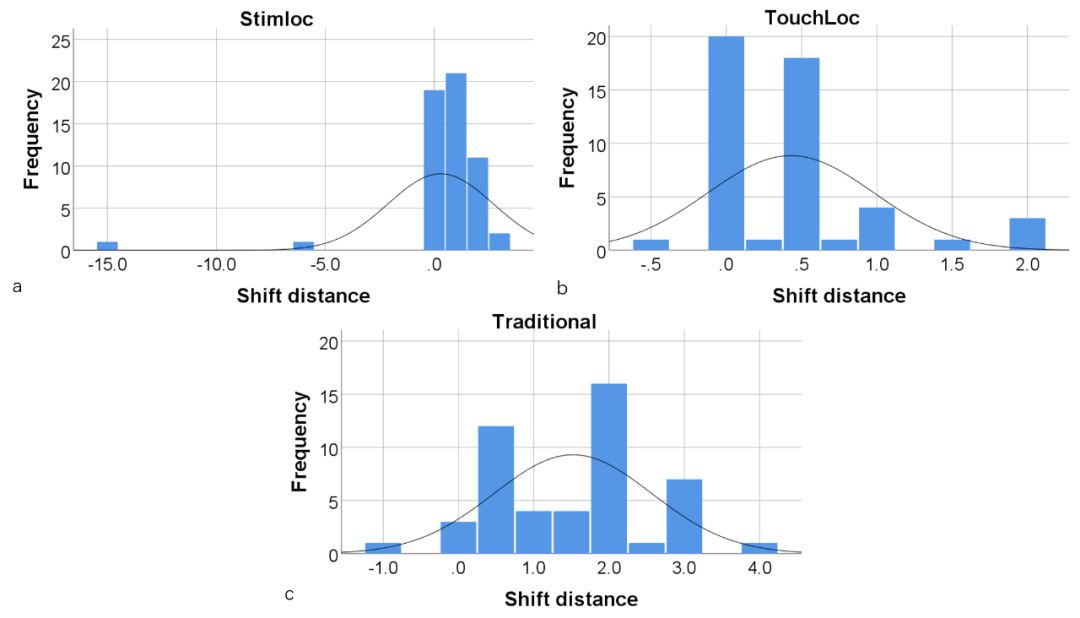
图3:电极固定装置电极位移距离的频数图。a. 美敦力Stimloc;b. 景昱TouchLoc;c. 传统电极固定装置。
随着DBS手术的经验积累,电极调整次数通常限于0(65.4%)或1次(24.8%)(图4)。三种电极固定装置的平均调整次数为:1.1±1.0(传统装置)、0.3±1.3(TouchLoc)、0.3±0.5(Stimloc)次。同时,使用Kruskal-Wallis检验的三种装置间也显示出统计学显着性差异(检验统计量=42.905;p<0.001),表明传统电极固定装置的电极调整次数较多。
电极位移距离的差异主要是由传统电极固定装置性能不太稳定造成,而Stimloc和TouchLoc装置的性能差别较小(TouchLoc与Stimloc:统计值=9.280,P=0.273;TouchLoc与传统:统计值=-48.082,P=0.0001;Stimloc与传统:统计值=-38.801,P<0.0001)。另一方面,传统固定装置性能不稳定导致电极调整次数存在显着差异,而Stimloc和TouchLoc装置则表现出相近的性能(TouchLoc与Stimloc:统计值=6.106,P=0.403;TouchLoc与传统:统计值=-45.112,P<0.001;Stimloc 与传统:统计值=-39.006,P<0.001)。
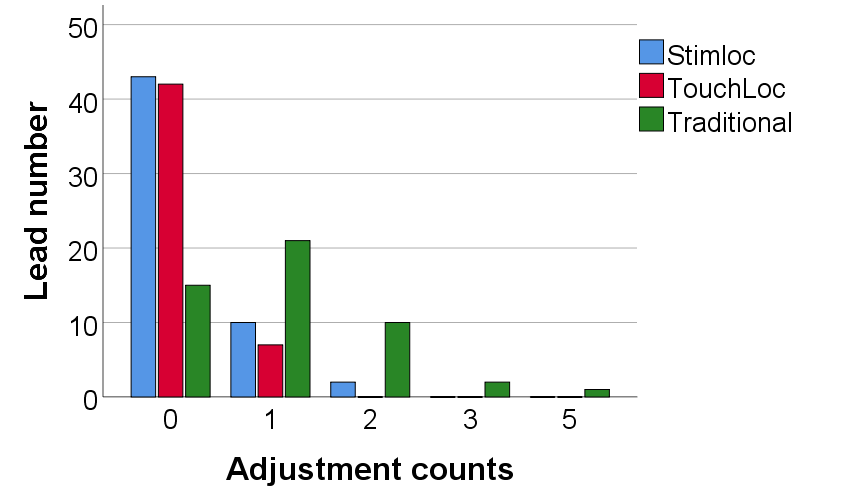
图4:电极固定装置调整电极次数的频数图。
本次研究回顾接受DBS手术的患者,经术中C臂机透视确认电极位置,反映新型电极固定装置相对稳定的性能。这两项专利装置较传统固定装置具有更少的电极位移与调整次数,我中心使用的手术方案也为减少上述电极位移与调整次数提供了切实可行的操作方案。
目前国内市场的电极固定装置包括三大主要产品。在过去的二十年中,传统的电极固定装置通过简单地将盖子按压在基环凹槽而在电极固定方面发挥了重要作用,而美敦力Stimloc与景昱TouchLoc装置则成为新型电极固定装置。凭借专利设计,上述装置牢固地锁定DBS电极并最大限度地减少了手动误差[13,14]。本研究中,Stimloc与TouchLoc装置与较短的电极移位距离和较少的电极调整次数相关联。因此,其不仅验证了新型电极固定性能,而且巩固了固定装置在DBS手术的作用地位。此外,本研究结果反映了传统电极固定装置的基本缺陷。首次电极位移出现在移除电极导丝和套管,将电极按压固定装置的凹槽上可能出现电极的二次位移,甚至将盖帽按压在基环上可能出现三次位移。若上述三项常规步骤没有谨慎操作,那么即使是Stimloc装置锁定电极也可以出现惊人的位移距离(-15.0mm、-6.0mm)。
尽管本中心DBS手术累积的经验丰富,以至于半数记录的电极调整次数为0或1次,但无论何种电极固定装置在电极固定期间仍需谨慎操作并在术中确认电极位置。在颅骨钻孔时,应特别注意精确定位DBS电极的植入点。鉴于Stimloc和TouchLoc装置的结构特性,只有基环中心方能提供最佳的电极固定性能。因此,以电极植入点为中心的钻孔是最佳选择。此时,严格按照手术方案将基环牢固地安装在钻孔上,并确保颅骨与基环之间没有多余空间。一旦电极就位,C臂机透视电极位置后,将电极固定装置装配于基环,而非手动夹持电极,在移除电极导丝和套管时应注意不能造成电极位移。
另外,电极锁开口尽可能与基环凹槽接近直角(或形成较大夹角),以降低将电极压到基环时的潜在偏移。此时,应进行第二次C臂机透视检查以验证按压电极对电极位置的影响;尤其是在应用传统电极固定装置时,当盖子按压在基座以密封钻孔时,盖子对电极挤压也会造成电极位移,因此需要第三次成像确认电极位置。尤为重要的是,在电极调整过程中应绝对避免触碰C臂机,以免不恰当的图像比较。因此,本研究结果与我中心的常规操作保持一致,多数电极位移方向(96.6%)表明实际电极位置比手术计划更深,可能是按压电极造成,而偏浅的结果可能是由固定装置的固定不充分造成。
此外,选择C臂机透视作为主要的术中成像方法实际上取决于工作流程,因为术中CT和MRI相对耗时,并且国内多数中心尚未普及,因此在DBS手术期间需要多次成像。C臂机透视可直观显示DBS植入期间电极位置的深度偏差,该维度也是最容易调节电极位置的维度。近期文献已报道多种有效保护DBS电极的补充方法,包括钛板与骨水泥的应用[6,15]。然而,鉴于术中手动操作电极的潜在偏移风险,这种术中成像方法对于电极位置的即时确认仍然是必不可少的。如研究结果所述,除在电极植入之后的第一次成像外,第二次通常在移除导丝和套管后成像,而第三次成像主要验证传统电极固定装置盖帽时按压电极的影响。术中所有调整电极后,均需要相应的C臂机透视成像评估电极位置。
局限
本研究主要包括以下局限。首先,电极位移的测量具有固有的缺陷。最小测量单位基于参考长度(DBS电极触点以及两触点间隙),并且不同的手术医生通过图像人工测量这些移位时,测量结果可能不一致(如图2所示)。其次,本次研究入组多种疾病的患者,并且手术靶点多样,这可能是不同深度的颅内靶点不同位移趋势潜在来源,不同年龄、病种等因素所致脑状态差异造成潜在选择偏倚。最后,三种电极固定装置的显着差异不应被理解为上述产品质量差异。
比较三种电极固定装置在电极固定精度方面的性能后,新型电极固定装置已发挥其优势。由人工误差引起的电极位移仍然需要通过多次的C臂机透视成像进行校正以验证电极调整结果。虽然许多术中成像方法已用于验证电极位置,但C臂机透视仍然在国内医院中占主导地位。

参考文献
1. Edwards CA, Kouzani A, Lee KH, Ross EK. Neurostimulation Devices for the Treatment of Neurologic Disorders. Mayo Clin Proc. 2017 Sep;92(9):1427–44.
2. Morishita T, Hilliard JD, Okun MS, Neal D, Nestor KA, Peace D, et al. Postoperative lead migration in deep brain stimulation surgery: Incidence, risk factors, and clinical impact. Toft M, editor. PLoS One. 2017 Sep 13;12(9):e0183711.
3. Shahlaie K, Larson PS, Starr PA. Intraoperative Computed Tomography for Deep Brain Stimulation Surgery: Technique and Accuracy Assessment. Oper Neurosurg. 2011 Mar;68(1 Suppl Operative):ons114-ons124.
4. Israel Z, Bergman H. Location, location, location: Validating the position of deep brain stimulation electrodes. Mov Disord. 2016 Mar;31(3):259.
5. Ughratdar I, Samuel M, Ashkan K. Technological Advances in Deep Brain Stimulation. J Parkinsons Dis. 2015 Sep 14;5(3):483–96.
6. White-Dzuro GA, Lake W, Eli IM, Neimat JS. Novel Approach to Securing Deep Brain Stimulation Leads: Technique and Analysis of Lead Migration, Breakage, and Surgical Infection. Stereotact Funct Neurosurg. 2016 Feb 17;94(1):18–23.
7. Hu W-H, Zhang K, Meng F-G, Ma Y, Zhang J-G. Deep Brain Stimulation in China: Present and Future. Neuromodulation Technol Neural Interface. 2012 May;15(3):251–9.
8. Verhagen Metman L, Pilitsis JG, Stebbins GT, Bot M, Bakay RAE. Intraoperative x-ray to measure distance between DBS leads: A reliability study. Mov Disord. 2012 Jul;27(8):1056–9.
9. Cao C, Pan Y, Li D, Zhan S, Zhang J, Sun B. Subthalamus deep brain stimulation for primary dystonia patients: a long-term follow-up study. Mov Disord. 2013 Nov;28(13):1877–82.
10. Li D, Cao C, Zhang J, Zhan S, Chen S, Sun B. Subthalamic nucleus deep brain stimulation for Parkinson’s disease: 8 years of follow-up. Transl Neurodegener. 2013;2(1):11.
11. Neumaier F, Paterno M, Alpdogan S, Tevoufouet EE, Schneider T, Hescheler J, et al. Surgical Approaches in Psychiatry: A Survey of the World Literature on Psychosurgery. World Neurosurg. 2017 Jan;97:603–634.e8.
12. Panagiotis N, Spyridon N. Effectiveness and Adverse Effects of Deep Brain Stimulation : Umbrella Review of Meta-Analyses Effectiveness and adverse effects of deep brain stimulation : umbrella review of meta-analyses of Neurosciences , Southampton University Hospital , Tremona Road. 2016;78:180–90.
13. Weizhong Y. Brain electrode lead anchoring device. Suzhou, China; US9020606, 2011.
14. Bruce A. Behymer, Bonde EH. MEDICAL DEVICE ANCHORING APPARATUS AND METHODS. U.S.; US20140155860A1, 2014.
15. Patel N V., Barrese J, DiTota RJ, Hargreaves EL, Danish SF. Deep brain stimulation lead fixation after Stimloc failure. J Clin Neurosci. 2012 Dec;19(12):1715–8.





