胶质瘤是最常见的颅内恶性肿瘤,占颅内肿瘤的40%-50%。目前胶质瘤的主要治疗手段仍然是手术和放化疗。目前胶质瘤获批的化疗药物是替莫唑胺(TMZ),该药物是一种烷基化试剂,能很好的透过血脑屏障,是治疗胶质瘤的一线用药。但不是所有的胶质瘤患者使用TMZ的疗效都显著,研究表明携带有MGMT启动子甲基化的患者对TMZ药物敏感。MGMT甲基化导致MGMT基因表达沉默,使得烷基化药物起作用。MGMT启动子甲基化检测已经被纳入脑胶质瘤分子诊断的各项指南。然后,随着时间的推移,临床医生和科研人员发现MGMT启动子区的甲基化情况与MGMT基因表达的状况存在不一致的现象。这一现象说明了除MGMT甲基化这种调节MGMT基因表达的机理外,还存在着其他未知的调节方式。
哥伦比亚大学,癌症研究中心张志国教授等团队,在nature子刊,报道一种新型增强子调节MGMT表达和促进胶质母细胞瘤对TMZ耐药性的机理研究。该团队首先鉴定到了一个远端增强子区域(被称为位于MKI67和MGMT启动子之间的K-M增强子,距离MGMT启动子560 kb)。研究发现在胶质瘤的PDX模型中即使在MGMT启动子区甲基化阳性的背景下,K-M增强子也能激活MGMT基因的表达。其次,该团队还发现敲除K-M增强子能显著的降低MGMT基因和Ki67基因的的表达,与此同时,K-M增强子区域中H3K27乙酰化位点的调节起着重要作用。最后通过细胞水平实验发现,缺乏K-M增强子的胶质瘤细胞能明显增强对化疗药物TMZ的敏感性和显示出降低脑胶质瘤细胞的增殖率。这一研究揭示了胶质瘤新的耐TMZ机制和胶质母细胞瘤的增殖机制。

大致的实验过程和结论如下:
在MGMT启动子区甲基化阳性的胶质瘤母细胞瘤细胞系中,发现一个细胞GBM12-3080仍然具有高水平的MGMT基因的表达。进一步研究后发现存在一个K-M增强子区域中的H3K4位点甲基化修饰和H3K27乙酰化修饰位点可能对MGMT蛋白的表达具有调节作用。
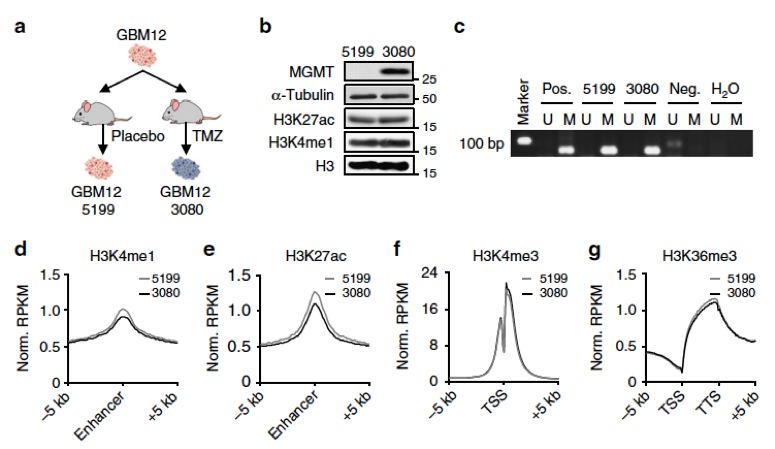
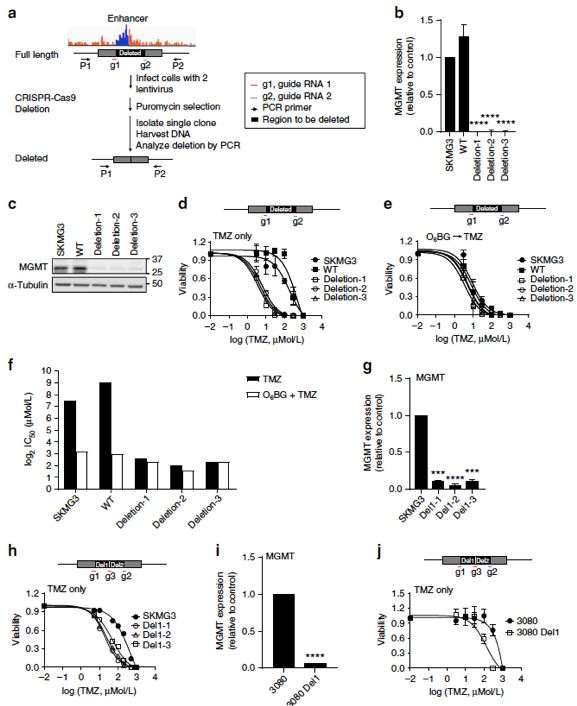
紧接着,该团队利用crispri-cas9的技术将K-M增强子区进行基因敲除,然后对敲除K-M增强子区的细胞进行TMZ处理实验,结果表明,敲除K-M增强子区能显著的降低MGMT基因的表达和增强对TMZ的敏感性。
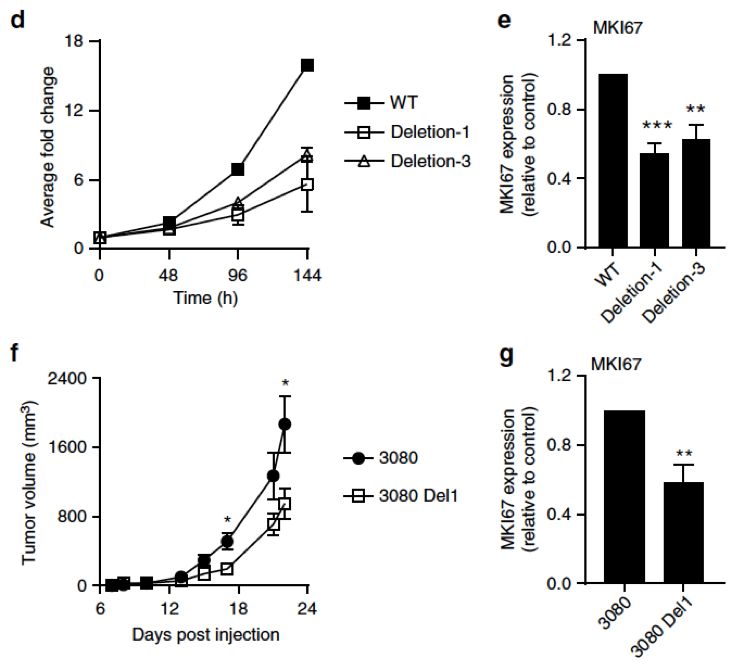
通过基因敲除K-M增强区的实验还发现了,K-M增强区能明显影响胶质瘤细胞的增殖和Ki67基因的表达。
原文网址:
https://www.nature.com/articles/s41467-018-05373-4




