端粒在抵抗两个内在生物缺陷-末端保护和末端复制方面起着至关重要的作用,它将DNA双链断裂的天然染色体末端分开,以防止因诱导DNA损伤信号导致的末端融合和基因组不稳定。核糖体蛋白,端粒酶能有效的抵消由于DNA复制的固有限制(末端复制问题)导致染色体末端DNA逐渐缩短现象。
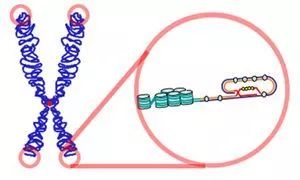
端粒酶逆转录酶(TERT)是端粒酶的催化亚基,它与端粒酶RNA组分(TERC)一起构成端粒酶复合物中最重要的单元。有研究表明,大约85%的肿瘤表现出核糖体蛋白复合物端粒酶活性的上调,这种现象的产生有利于肿瘤细胞的无限增殖。TERT基因核心启动子区域的突变已在许多类型的肿瘤中发现,包括黑色素瘤,唇肉瘤,膀胱癌,尿道癌和神经胶质瘤。
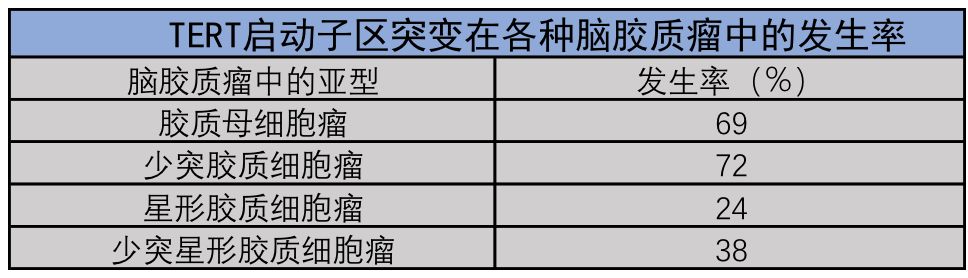
在神经胶质瘤患者中,已发现TERT启动子突变的存在根据神经胶质瘤的类型而变化。 大多数原发性胶质母细胞瘤或少突胶质细胞瘤患者有较高比例的TERT启动子突变,但在星形细胞瘤或大多数少突星形细胞瘤患者中,这些突变发生率较低。具体发病率见下表:
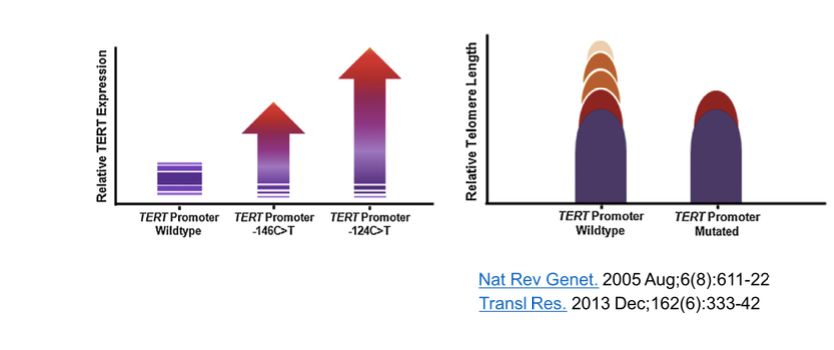
有研究表明,在脑胶质瘤中TERT在启动子区的-124C>T和-146C>T处发生相应的突变能在明显的上调TERT的表达水平,值得一提的是在胶质瘤中TERT启动子-124C>T处的突变导致TERT的表达量增加的倍数是-146>T处突变的两倍。许多的科学研究显示TERT的表达量与端粒酶的活性和端粒的长度存在着紧密的关系,TERT启动子区发生突变不仅能增加TERT的表达量,同时也能增强端粒酶的活性和缩短端粒的长度。
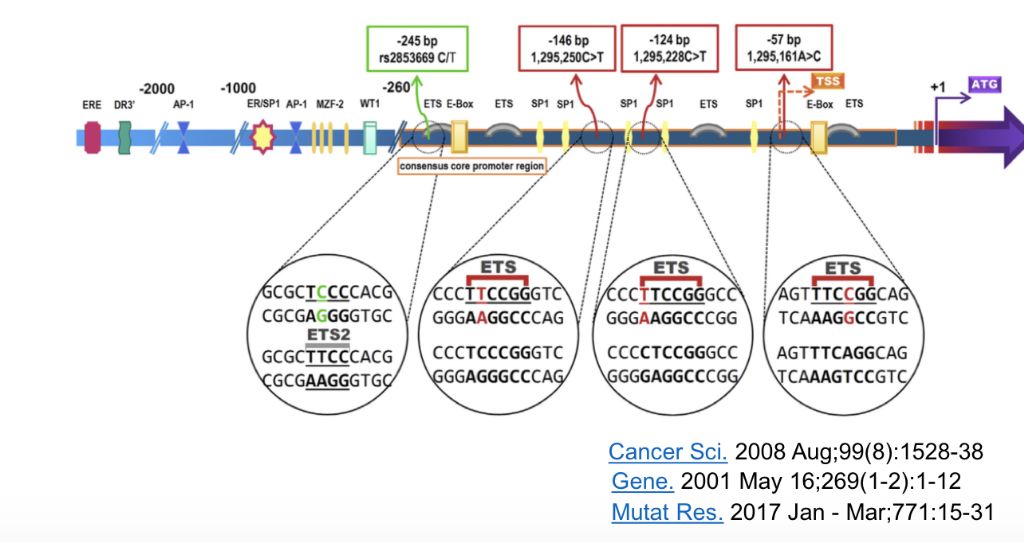
TERT启动子区域突变促进TERT的高表达的分子机理已被广泛研究。TERT的启动子区通常被许多转录因子调控,其中具有30个成员的ETS转录因子是调控TERT表达和调节端粒酶活性的主要转录因子之一。实验表明当TERT的启动子区域发生突变时能够显著的增强ETS转录因子与TERT启动子区域的物理相互作用而使TERT基因高表达。
TERT启动子区域的突变与肿瘤的发生发展和治疗预后都有密切的关系。在脑胶质瘤中TERT启动子区突变在高级别的原发性和继发性胶质母细胞瘤中发生频率很好。具有TERT启动子突变的胶质母细胞瘤患者通常具有较差的预后和短的生存期。TERT启动子区域突变不仅在脑胶质瘤中发生,在其它的癌症中也存在,其突变总的来说发生在癌症的较晚期,预后表现差,生存期短。具体情况如下表所示:

因此,在脑胶质瘤的分子分型中,检测TERT启动子区域的变异情况,对于明确病理诊断非常关键。
我们的脑胶质瘤分子诊疗解决方案中,涵盖了IDH1/2、MGMT甲基化、1p19q和TERT启动子等十三个分子标志物,辅助临床明确病理诊断。



