【Ref: Bejarano L, et al. Cancer Cell. 2017 Nov 13;32(5):590-607.e4. doi: 10.1016/j.ccell.2017.10.006.】
50年来,在胶质母细胞瘤(GBM)分子学方面的研究取得不少进展,但GBM患者的中位生存期并未改善,仍为14-16个月。GBM是高度异质性肿瘤,具高增殖和高浸润性特征。肿瘤内的细胞呈现不同表达谱,对放射线和化学药物的反应不同。有研究表明,肿瘤中存在一小部分称为神经胶质瘤干细胞样细胞,表现出抗放疗和抗化疗的特性,治疗后易复发。西班牙国立癌症研究中心分子肿瘤学部的Leire Bejarano等进行一项研究发现,端粒蛋白TRF1在小鼠和人类GBM中上调。脑特殊的Trf1基因缺失增加端粒DNA损伤,减少其增殖和干性(图1),结果发表在2017年11月的《Cancer Cell》上。
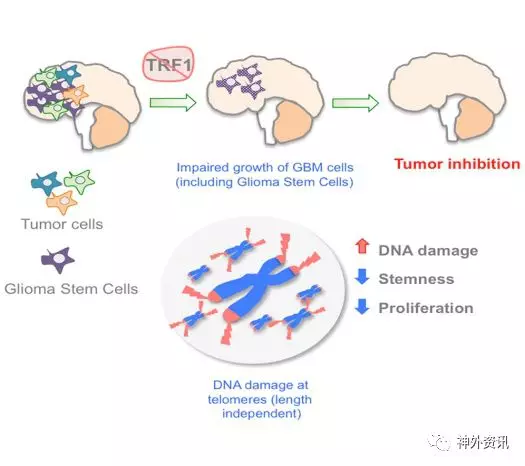
图1. 研究流程示意图。
端粒对维持染色体的稳定性至关重要。哺乳动物端粒是由TRF1、TRF2、POT1、TPP1、TIN2和RAP1形成的端粒蛋白复合物结合TTAGGG序列重复串联所形成的。细胞分裂时,染色体末端不完全复制,因此端粒缩短,然后通过端粒酶重新形成端粒加帽来补偿。端粒酶是作为合成TTAGGG重复序列的模板。然而,在正常的成年细胞中,端粒酶通常不表达,因此端粒逐渐缩短,与机体老化有关。端粒保持在最小长度以上对于维持细胞的无限增殖潜力至关重要,因此端粒可作为是潜在的抗癌靶点。
GBM患者预后不良与GBM细胞高增殖和细胞异质性有关,包括胶质瘤干细胞(GSCs)。端粒基因经常发生突变。端粒结合蛋白TRF1对于端粒保护成年的和多能的干细胞至关重要。GBM小鼠模型中,大脑特异性Trf1基因缺失,抑制GBM发生和发展,增加存活率(图2)。敲除Trf1基因的小鼠在GBM移植时肿瘤发生率更低,即使在快速增长的肿瘤中,肿瘤体积也比未敲除Trf1的小鼠肿瘤小,与Trf1 + / +对照组相比,Trf1缺失小鼠的存活率增加80%。TRF1化学抑制剂(ETP-47037)可以阻止来自人类GBM细胞原代GSCs的异种移植物的肿瘤球体形成和肿瘤生长,模拟在人类GBM细胞中的作用。
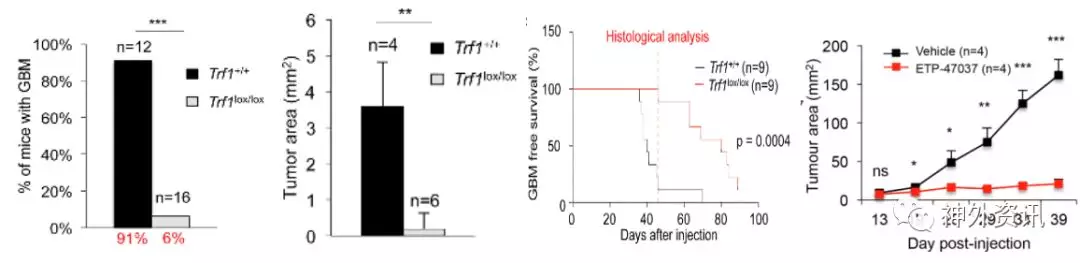
图2. GBM小鼠模型中的大脑特异性Trf1基因缺失抑制GBM发生和发展。
该研究表明,通过直接抑制端粒蛋白复合物TRF1破坏端粒加帽是治疗GBM的有希望的策略。TRF1的抑制有效地阻断GBM在鼠和人类中的作用,进一步证明了TRF1抑制在削弱神经胶质瘤干细胞生长方面的显著效果。
(罗慧颖编译,复旦大学附属华山医院寿佳俊博士审校,《神外资讯》主编、复旦大学附属华山医院陈衔城教授终审)




