今天为大家分享的是由上海交通大学医学院附属新华医院神经外科窦宁宁医师编译,海军军医大学附属长征医院神经外科代大伟医师审校的:脊髓髓内肿瘤手术策略与技巧手术策略与技巧,欢迎观看、阅读!
Brainstem hemangioblastoma-Fluorescence-Y560
Brainstem posterior medulla hemangioblastoma
肿瘤分类
脊髓髓内肿瘤是一种少见且手术难度较高的肿瘤,其发病率占所有原发性脊髓肿瘤的16%-58%,原发性中枢神经系统肿瘤的2%-8.5%。
同髓外肿瘤一样,髓内肿瘤也有三种最常见的病理类型,分别为室管膜瘤(30%-40%)、星形细胞瘤(30%-35%)和血管母细胞瘤(2%-15%),共占所有髓内肿瘤的90%以上。其它类型的肿瘤如海绵状血管瘤、错构瘤、转移瘤以及脂肪瘤相对罕见。
研究表明髓内肿瘤的发生与某些基因相关,其中神经纤维瘤病I型(NF1)、神经纤维瘤病II型(NF2)和希佩尔-林道综合征(VHL)是最常见的分别易致髓内星形细胞瘤、室管膜瘤和血管母细胞瘤的基因相关性疾病。
约20%的神经纤维瘤病I、II型患者会出现髓内肿瘤,同样20%-43%的髓内血管母细胞瘤患者经检查可确诊为VHL患者。
髓内肿瘤可伴有脊髓空洞(25%-58%),其中颈胸交界区发生率最高。脊髓空洞往往提示肿瘤预后良好,因为空洞的产生表示肿瘤非浸润性生长,而且空洞腔在减压后脊髓功能可迅速恢复。一半以上的空洞位于肿瘤上极,
40%的空洞位于肿瘤两极,仅有10%位于肿瘤下极。
关于髓外肿瘤的详细内容,请查阅椎管内髓外硬膜下肿瘤章节。
室管膜瘤
髓内室管膜瘤通常生长缓慢,为质地柔软、边界清楚、血供中等的灰红色的团块。室管膜瘤常好发于20-40岁,男性多于女性(男比女:2:1),儿童罕见,其中8%的髓内室管膜瘤患者可并发II型神经纤维瘤病。
髓内室管膜瘤主要发生在颈髓和胸髓,马尾部位少见,是髓内最常见合并脊髓空洞的肿瘤。
由于通常生长于脊髓中央,室管膜瘤往往较早出现髓性症状,主要表现为感觉障碍、共济失调、肌力减弱以及相应区域疼痛,尽管如此,但多数患者可站立行走。
肿瘤全切可使患者获得痊愈。然而,室管膜瘤在所有髓内肿瘤中手术并发症发生率最高。
星形细胞瘤
髓内星形细胞瘤通常浸润生长,边界不清,在20-40岁人群髓内肿瘤发病率中排第二位。高级别的星形细胞瘤多见于成人,而青少年多为低级别。1/4的成人低级别星形细胞瘤可恶性变。
星形细胞瘤主要发生于颈髓,20%患者伴有空洞。与髓内室管膜瘤一样,患者出现感觉障碍、共济失调以及运动障碍的概率大体一致,约1/3患者可出现疼痛。
与成人相对不同的是,肌力减退是儿童髓内星形细胞瘤患者入院时最主要的主诉,而腹痛、斜颈以及肌肉萎缩等不典型症状常使小儿髓内星形细胞瘤诊断困难重重。需要注意的是,4%的髓内肿瘤患儿出现会进行性脊柱侧弯,主要导致疼痛及其他神经功能障碍。
长节段如侵犯颈髓或胸髓全长的星形细胞瘤病变相对少见,病理类型为纤维型星形细胞瘤。
血管母细胞瘤
髓内血管母细胞瘤为体积小、边界清楚、血供丰富的团块状良性病变,多发生于31-40岁。血管母细胞瘤多散发,且多发于男性,一旦发现髓内血管母细胞瘤应警惕VHL可能。
血管母细胞瘤可发生于神经轴索上任一位置,最常见于颈髓后侧或后外侧。脊髓空洞发生率较上述两种肿瘤发生率低,但高达70%的肿瘤可囊变。
诊断
大多数髓内肿瘤患者症状表现为髓性症状缓慢进展,若病变侵犯腰骶部可出现神经根性症状。病情急性恶化罕见,但一旦发生,则预示瘤内出血或肿瘤恶性程度高。
评估
磁共振(MRI)平扫及增强扫描是诊断这类肿瘤的首要影像学检查方法,能够清晰地显示肿瘤和正常脊髓组织的界面,以及肿瘤相关的囊变、脊髓空洞和血肿。值得注意的是,髓内室管膜瘤、星形细胞瘤和血管母细胞瘤在磁共振影像上表现相似,故单纯依靠MRI有时很难鉴别。神经胶质瘤(室管膜瘤和星形细胞瘤)在磁共振上表现为T1相低或等信号,T2等或高信号,强化多不均匀。
血管母细胞瘤多表现为T1等高信号,T2高信号,均匀强化。
室管膜瘤多沿脊髓中线部位对称性膨胀式生长,延伸至多个脊髓节段,少见病例呈偏心生长并伴有髓外部分。而星形细胞瘤则一般表现为侵袭性生长。若无增强MRI,炎性病变和星形细胞瘤在影像学上很难区分。血管母细胞瘤通常为实性或有壁结节的囊性病变,可伴有明显的瘤周水肿。
瘤内出血在室管膜瘤中相对常见,尽管为非特征性表现,瘤内出血在室管膜瘤中相对常见,MRI上常见肿瘤两极或瘤内“含铁血黄素帽“。
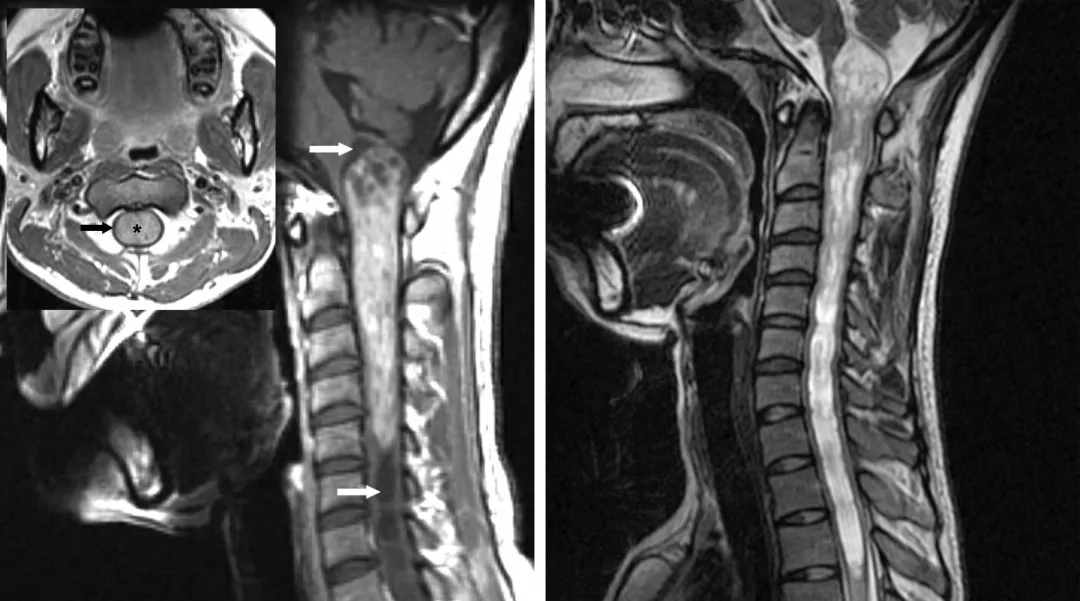
图1:所示颈髓室管膜瘤典型影像学表现:不均匀强化,肿瘤上下极脊髓空洞(白色箭头),呈对称性膨胀性生长,正常脊髓被挤压变薄(黑色箭头,左图).注意髓内空洞两端的T2相高信号(右图)
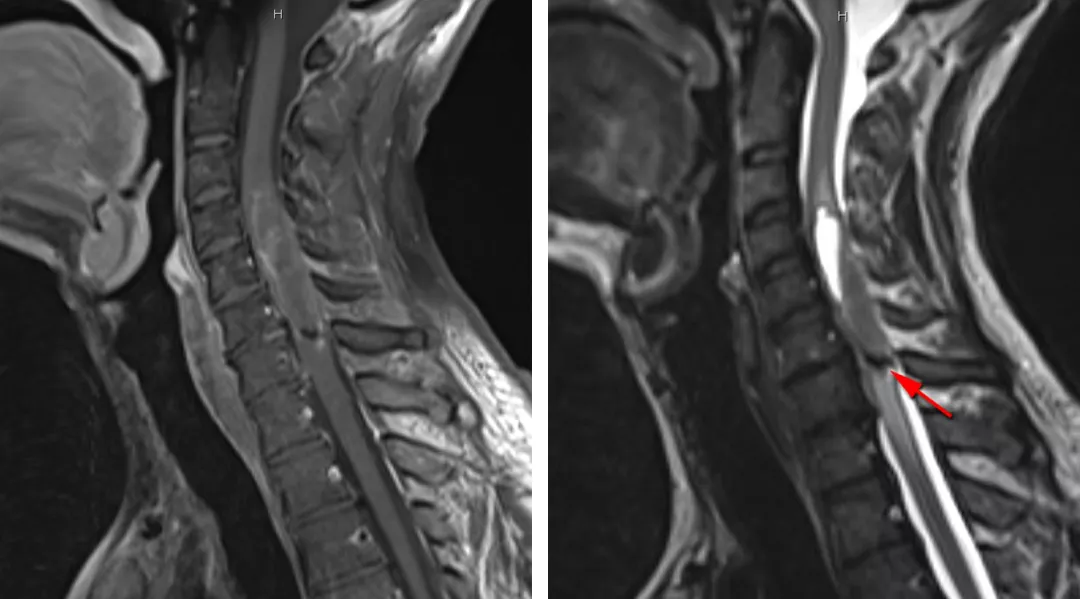
图2:颈段室管膜瘤伴有少量强化,肿瘤下极可见一小出血灶(箭头所示,右图)。
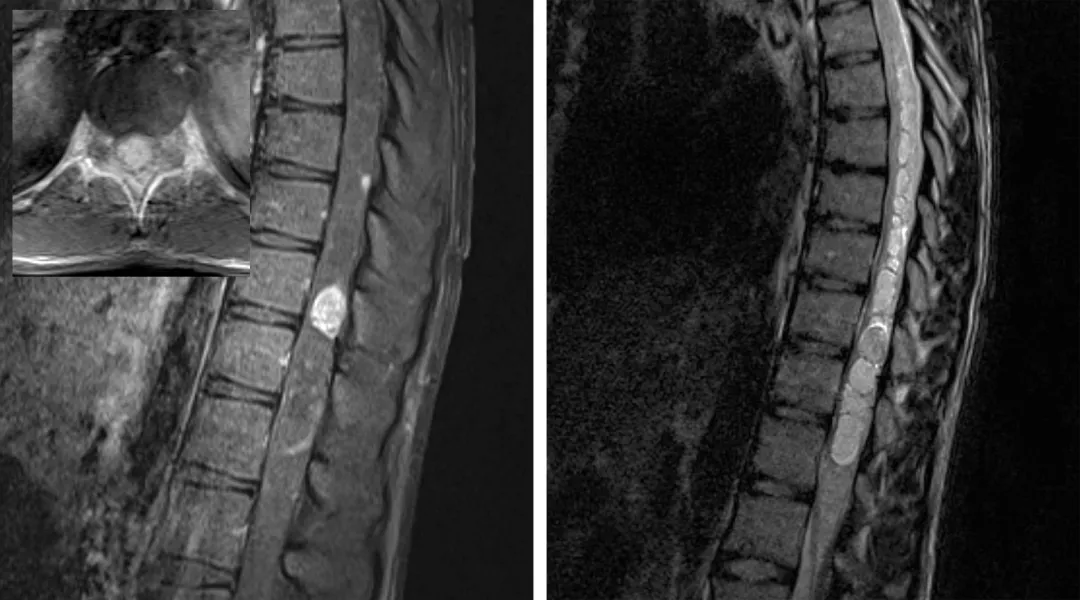
图3:图中所示为一名VHL患者胸髓血管母细胞瘤伴多发髓内病变。注意巨大肿瘤位于脊髓偏心位置且伴一大型囊肿。
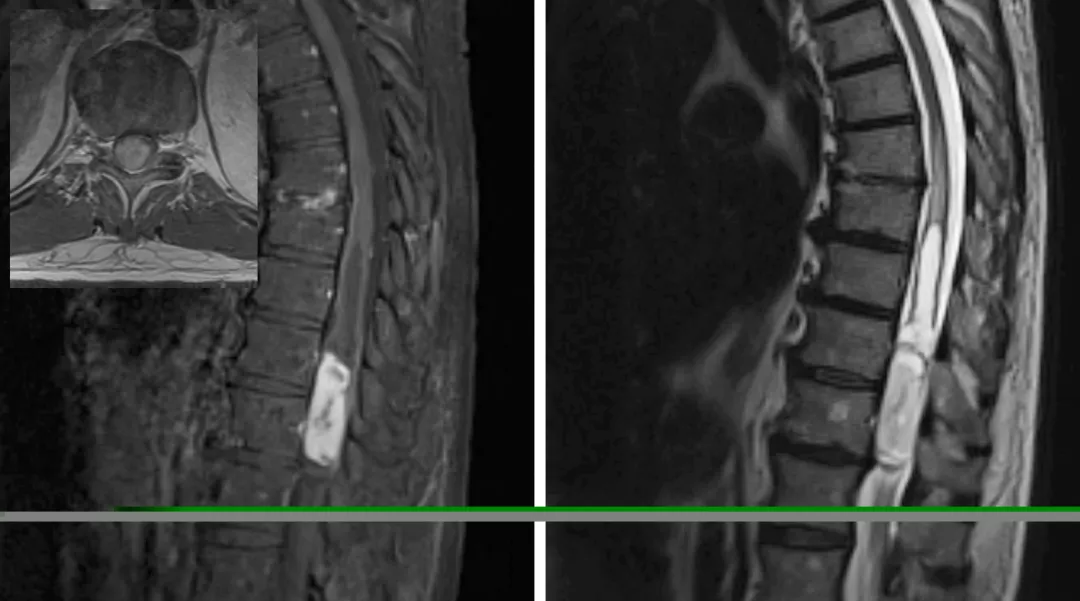
图4:图中所示为伴囊变的胸髓毛细胞型星形细胞瘤,此病理类型肿瘤主要位于脊髓背侧,呈偏心性生长。不同于更高级别的胶质瘤,毛细胞型星形细胞瘤多边界清楚,表现为压迫脊髓而非浸润性生长。
对于髓内肿瘤的患者而言,脊柱X线平片检查价值有限,但仍然在整体评估脊柱骨性结构、侧弯以及复发肿瘤的脊柱稳定性方面发挥重要作用,但很少能看到纤细的椎弓根。
对怀疑脑积水患者要进行颅脑CT或MRI检查,髓内肿瘤同时合并脑积水尽管少见,但也有文献报道。
手术指征
髓内肿瘤有相应临床症状是手术的主要适应症。与髓外肿瘤的治疗原则相似,目前对于无症状髓内肿瘤的患者是否进行手术仍有争议。笔者通常会建议对无症状的肿瘤采取保守的治疗策略,这些肿瘤周围至少有一圈正常的脊髓。
放疗对于未实现全切的室管膜瘤患者效果仍不确切。但目前研究发现对于高级别的胶质瘤,放疗具有一定作用。
术前检查
术前MRI应该包括T1、T2、增强扫描以及3D-CiSS(3D-稳态干扰序列),或者FIESTA(稳态快速成像序列),且影像学检查应至少包括两个平面。
脊髓数字血管造影(DSA)有助于明确血管母细胞瘤的供血动脉和引流静脉情况。笔者不建议采用血管栓塞治疗,因为栓塞可能会导致侧枝循环血供损害。
在进行影像学检查之后,医生还要根据临床症状和脊髓功能状态对患者进行评分和分类。主要用于髓外硬膜下肿瘤病变的评分系统包括Nurick评分和Klekamp – Samii神经评分系统,这些临床评分量表可以用来预测患者预后。
对于以上所提及的分类及评分系统的具体细节,请参考椎管内髓外硬膜下肿瘤章节。
术前的医患沟通非常重要。患者应被充分告知术后短期神经功能恶化的高风险,这一比例在出院时高达2/3。尽管多数患者神经功能减退为短期表现,但也有将近30%的患者仍遗留永久性神经功能障碍。
髓内肿瘤的切除
暴露术野
关于围手术期的患者管理、手术体位和手术入路的具体细节,请参考椎管内髓外硬膜下肿瘤章节。术中常规应用电生理监测主要的感觉及运动功能包括体感诱发电位和运动诱发电位监测。在颈胸段(C5-T1)和腰骶段(L2-S1)手术时要同时采用神经根刺激肌电图进行监测。
对于大多数髓内肿瘤,后正中入路足可安全地暴露术野范围。椎板间的黄韧带要处理完全,整块的椎板切除可用于长节段的肿瘤切除术中。可采用浸泡过凝血酶的明胶海绵对硬膜外出血进行压迫止血,彻底的硬膜外止血有助于为硬膜打开后的显微外科操作提供清晰干净的视野。
同髓外肿瘤一样,术中超声是一种有效的辅助手段,它有助于肿瘤的精确定位和确定脊髓操作前硬膜暴露程度是否足够。
髓内中央型肿瘤的手术策略
中央型肿瘤是指瘤体位于脊髓中央的肿瘤,一般即使切开硬膜后中央型肿瘤的瘤体也无法立即看到。有时肿瘤出血或囊性变可导致瘤体的脊髓表面染色,这一特点会有助于识别肿瘤位置。脊髓后方血管吻合支和中央无血管区都会提示脊髓后正中沟的位置。
笔者会选择在脊髓增粗最明显的背侧中央沟处进行切开蛛网膜及软膜。当脊髓由于肿瘤生长而旋转或中线难以识别时,可借助双侧背根入口区来进行定位。在脊髓后正中沟切开时术中脊髓后束的监测可有助于减少损伤。
然后笔者会进一步采用显微剪刀或蛛网膜刀进行后正中脊髓切开,在手术过程中尽量减少双极电凝后方脊髓血管,后方覆盖在瘤体的白质纤维以显微镊沿纵轴予以剥离。
初始的脊髓切开可仅切开1-2厘米,以识别肿瘤和正常脊髓界限是否清晰。如边界清楚可进一步扩大脊髓切口暴露肿瘤全长。
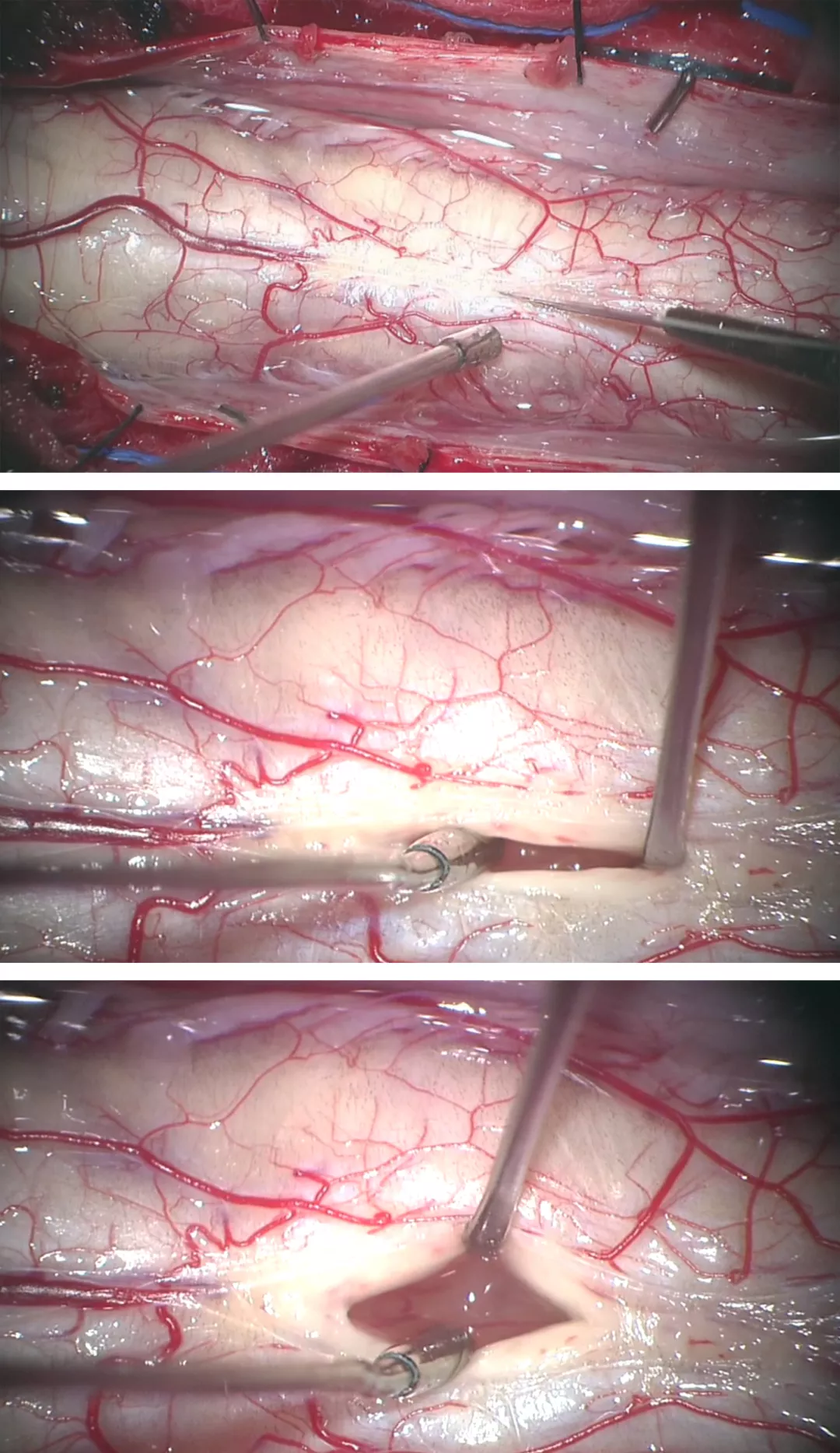
图5:图中所示为脊髓后正中沟切开脊髓切除颈髓巨大室管膜瘤的标准过程(图1显示术前图片)。仔细电凝后正中沟白质后采用蛛网膜刀切开,一把弯头吸引器或一对显微镊可用来移位或分离而不是切开后方的白质纤维(上端两幅图)。底图显示的是采用吸引器头端的特殊牵拉装置暴露肿瘤(底图)
对于体积小的髓内肿瘤可以采取整块切除,但一般体积大的肿瘤需要先进行瘤内减压或释放囊腔内容物来缩小肿瘤体积,然后再进行肿瘤切除,以免由于过度牵拉和操作损伤脊髓。
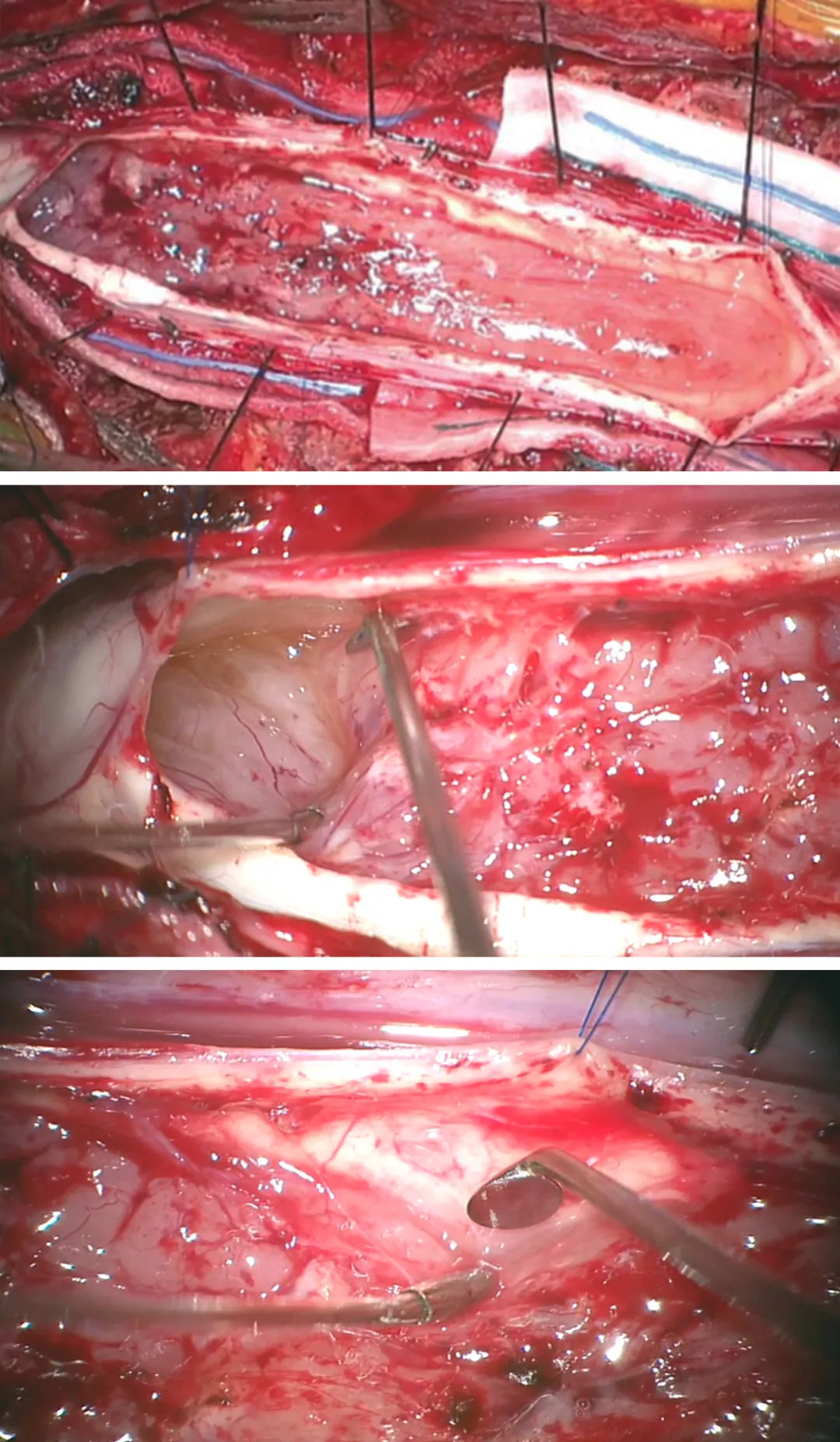
图6:采用6-0 缝线牵开软脊膜来暴露肿瘤来减少术中反复牵拉脊髓造成损伤(上图)。肿瘤上极的空洞使得瘤体与脊髓界限清晰而易于分离(中图)。底图显示采用有角度的显微剥离子将肿瘤从脊髓剥离下来(底图)。
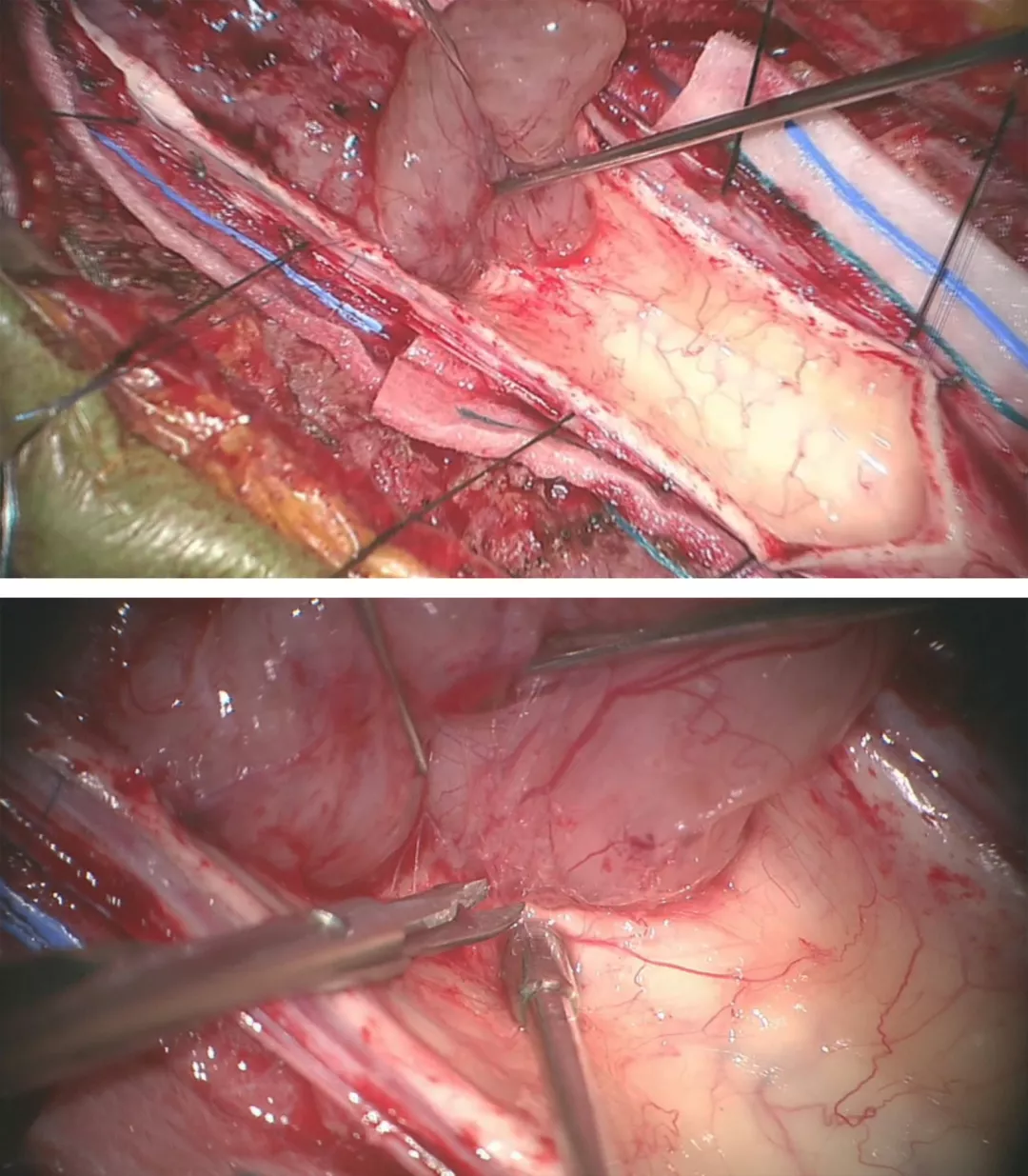
图7:采用娴熟的显微操作技术将瘤壁自菲薄的脊髓上剥离下来。由于肿瘤出血或空洞导致脊髓与肿瘤之间形成一个明显界面。大多数室管膜瘤和脊髓之间存在明显的肿瘤-脊髓界面。一般室管膜瘤的前方均有自脊髓前动脉发出的小动脉供血。在切除肿瘤时,这些肿瘤穿支血管要仔细分离、予以电凝后切断。盲目地牵拉会导致这些血管的撕裂,从而在止血过程中可能导致临近血管和脊髓的损伤。
笔者在切除髓内肿瘤过程中遵循一些原则。在切除肿瘤过程中尽量牵拉肿瘤壁而非脊髓来暴露界面和视野。视野干净有利于保持分离界面清晰。先采用超声刀进行肿瘤减压以便于牵拉肿瘤过程中不造成脊髓损伤。
笔者不建议强行剥离室管膜瘤的囊壁,因为目前研究表明这些囊壁不含肿瘤细胞,但这一操作却会很有可能导致脊髓损伤。
肿瘤是否全切是术者根据术中是否存在肿瘤-脊髓界面来决定,而非肿瘤病理性质。一些低级别星型细胞瘤界面清楚可以获得全切,而术中病理提示室管膜瘤的则提醒术者需要积极寻找肿瘤-脊髓界面以尽量获得肿瘤全切。
术中脊髓切开暴露不足可能会导致术者低估肿瘤全切的可能性,术中病理标本留取不合适也可能会使病理医生无法做出准确的判断。
室管膜瘤是典型的中央型肿瘤。位于脊髓中央位置的星形细胞瘤也同样适用中央型肿瘤切除的原则和策略。在切除侵袭性肿瘤(多为星形细胞瘤)时,需要先行瘤内减压,如术中确实未发现明显界面应该停止进一步切除以免损伤正常脊髓。
术中电生理监测诱发电位的任何异常改变都提示术者应暂停操作,放松牵拉力度,采用含罂粟碱的明胶海绵缓解血管痉挛。适当的升高血压有助于脊髓功能恢复。一般可逆的及细微的电位改变不会使笔者停止操作,但有意义的诱发电位的减少或消失会引起笔者放弃操作,甚至唤醒患者以进一步评估脊髓功能。
如何合理地解读诱发电位的变化以及适当正确地对其作出处理需要丰富的手术经验。
偏中央型肿瘤手术策略
偏中央型肿瘤是相对于中央型肿瘤而言,一般通过背根入口区或髓内肿瘤外生突破脊髓表面的部分进行肿瘤切除。采用轻柔地钝性和锐性分离相结合的方式对肿瘤壁进行分离。操作过程中尽量避免不必要的电凝。
星形细胞瘤一般侵袭性生长,但也可有相对安全的切除界面。采用超声刀或合适的取瘤镊瘤内切除减压是切除此类肿瘤的第一步。长节段的肿瘤(全颈髓或胸髓)可能需要二期手术。对于恶性的肿瘤,由于没有边界尽可能地行瘤内切除即可。
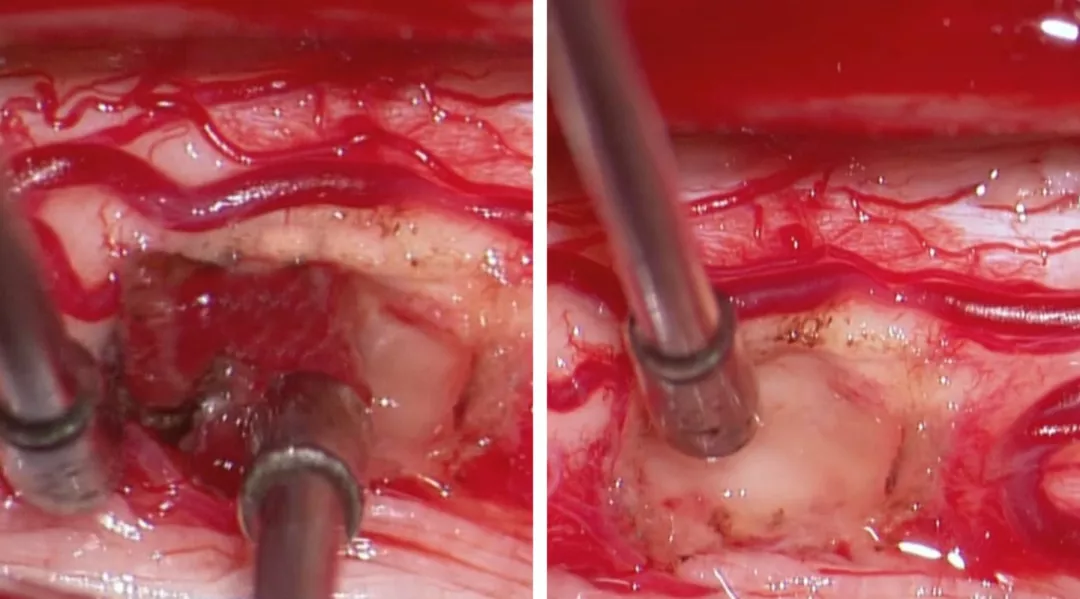
图8:血管母细胞瘤是高度富含血供的肿瘤,同时由于其组织来源为软膜血管周围间叶组织而非间质组织,因而其分离应该限于软膜而尽量避免脊髓组织损伤。鉴于其血供丰富且边界清楚,血管母细胞瘤的切除最好采用整块切除。血管母细胞瘤通常位于后外侧沟(背根入口区)。这一类似血管畸形的瘤体在分离时应仔细对瘤体进行去血供。在切除过程中,可采用小功率双极进行电凝以缩小瘤体体积从而使其界面更加清楚,易于分离。血管母细胞瘤的囊性部分或空洞可使分离更加容易。在瘤体深部与脊髓之间由于反复的小出血或压迫会造成肿瘤瘤体与脊髓也有一层界面。
切除髓内血管母细胞瘤主要包含以下几个要点:1)蛛网膜和神经根的分离、小功率双极电凝瘤体表面以及瘤体与脊髓界面的识别与分离;2)软脊膜及脊髓的切开及肿瘤的暴露,尤其是体积巨大的肿瘤;3)在处理体积较大的血管母细胞瘤时,采用6-0 prolene缝线适当牵拉软脊膜以暴露瘤体,电凝供血动脉,最后完成瘤体分离后再切断引流静脉,最终切除肿瘤。
对于VHL患者,则仅切除产生症状的肿瘤。
闭合切口
硬脊膜要水密缝合。在硬脊膜有缺损的情况下要采用硬膜成形术进行修补。
术后考虑
术后患者进入ICU病房过夜进行密切神经系统评估、疼痛评估及血压控制。术后需要进行即刻磁共振扫描。术后应逐渐减少激素的应用。
术后24小时内患者要平躺,其后可逐步增加活动量。
点睛之笔
• 脊髓髓内肿瘤中最常见的病理学类型是室管膜瘤,星形细胞瘤和血管母细胞瘤。
• 手术最主要的目的是脊髓功能保护与恢复,在保护脊髓功能的前提下,安全分离肿瘤-脊髓界面尽量全切肿瘤。
编译:窦宁宁
审校:代大伟
DOI: https://doi.org/10.18791/nsatlas.v9.ch03
中文版链接:
http://www. medtion.com/atlas/ 2178 .jspx
参考文献
Cohen-Gadol AA. Resection of large cervical intramedullary spinal cord ependymomas: techniques to maximize safety and extent of resection: 3-dimensional operative video. Neurosurgery. 2014;10 (Suppl 4):661.
Ebner FH, Schittenhelm J, Roser F, Scheel-Walter H, Tatagiba M, Schuhmann MU. Management of holocord pilocytic astrocytomas in children and adolescents: an update. Pediatr Neurosurg. 2012;48:133-140.
Gandhi R, Curtis CM, Cohen-Gadol AA. High-resolution direct microstimulation mapping of spinal cord motor pathways during resection of an intramedullary tumor. J Neurosurg Spine. 2015;22:205-210.
Klekamp J. Treatment of intramedullary tumors: analysis of surgical morbidity and long-term results. J Neurosurg Spine. 2013;19:12-26.
Klekamp J. Spinal ependymomas. Part 1: Intramedullary ependymomas. Neurosurg Focus. 2015;39:E6.
Klekamp J, Samii M. Surgery of Spinal Tumors. 1st Ed. Berlin Heridelberg, Springer, 2007.
Kucia EJ, Bambakidis NC, Chang SW, Spetzler RF. Surgical technique and outcomes in the treatment of spinal cord ependymomas, part 1: intramedullary ependymomas. Neurosurgery. 2011;68(1 Suppl Operative):57-63.
Samartzis D, Gillis CC, Shih P, O'Toole JE, Fessler RG. Intramedullary spinal cord tumors: part I-epidemiology, pathophysiology, and diagnosis. Global Spine J. 2015;5:425-435.
Samuel N, Tetreault L, Santaguida C, Nater A, Moayeri N, Massicotte EM, Fehlings MG. Clinical and pathological outcomes after resection of intramedullary spinal cord tumors: a singleinstitution case series. Neurosurg Focus. 2016;41:E8.




