
今天为大家分享的是《贝朗时间》第十二期,由浙江大学医学院附属儿童医院神经外科沈志鹏副主任医师带来的:儿童后颅窝室管膜瘤1例报道,欢迎阅读、分享!

沈志鹏
沈志鹏,浙江大学医学院附属儿童医院神经外科副主任医师。擅长小儿神经外科,包括小儿颅脑外伤,先天性畸形,脑积水,蛛网膜囊肿,神经管闭合不全,尤其专注于中枢神经系统肿瘤,脑血管畸形,癫痫外科等疾病的综合治疗。
担任中国研究型医院学会神经再生与修复委员会委员,浙江省医学会神经外科分会委员、小儿神经外科学组委员,浙江省医师协会小儿外科分会秘书,浙江省医师协会创伤外科分会委员,浙江省医学会物理与康复分会重症康复学组委员,浙江省抗癌协会神经外科专委会委员,浙江省抗癌协会小儿肿瘤专委会委员,浙江省抗癫痫协会会员。
病史简介
患儿,男,1Y1M,因“头围增大1月,步态不稳1天”入院。
1月余前患儿无明显诱因下被发现头围较同龄儿偏大,并有进行性增大情况,无伴呕吐,无抽搐,无四肢活动障碍等情况,家属未重视未予就诊。1天前患儿开始出现步态不稳,不愿下地行走,精神偏软等,就诊于浙江大学医学院附属儿童医院神经内科,查头颅磁共振提示:“后颅窝占位,伴梗阻性脑积水”。请神经外科会诊后建议行手术治疗,拟“后颅窝占位,梗阻性脑积水”收住入院。
患儿G2P2,足月顺产,既往史无殊,有1哥哥,体健。
入院查体:神志清,精神软,生命体征平稳,双侧瞳孔等大等圆,对光反射灵敏,前囟未闭,大小约3x3cm,张力高,颈抵抗可及,四肢肌张力可,肌力无法配合,双侧巴氏征阴性。
影像学检查
浙江大学医学院附属儿童医院门诊头颅磁共振提示:后颅窝占位,梗阻性脑积水。
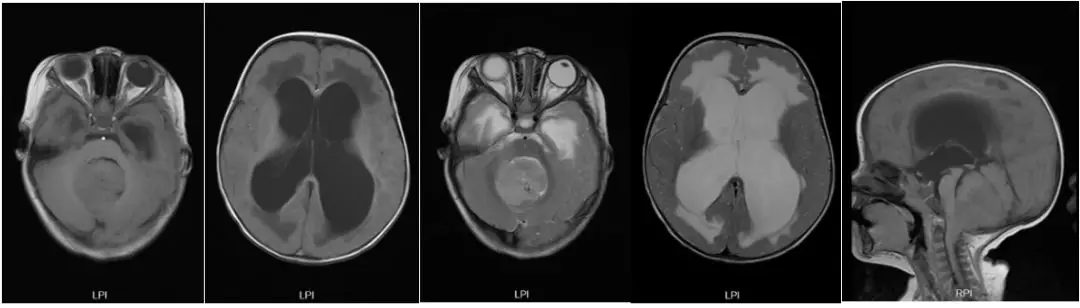
图1. 头颅MR平扫:a,b为T1加权像,c,d为T2加权像,e为矢状位T1。见后颅窝巨大实性均质肿块,伴幕上严重脑积水。
诊疗经过
入院诊断:后颅窝占位:室管膜瘤?随母细胞瘤?梗阻性脑积水。考虑合并严重脑积水,急诊先行脑室腹腔分流术,术中测压力高,大于25cmH2O,植入强生可调压脑室腹腔分流管,术后压力调节在120。
进一步检查:血化验结果:肿瘤标记物等未见明显异常。
头颅增强磁共振提示:第四脑室区肿瘤,伴幕上脑积水、间质性脑水肿,肿块包绕基底动脉,室管膜瘤首先考虑。
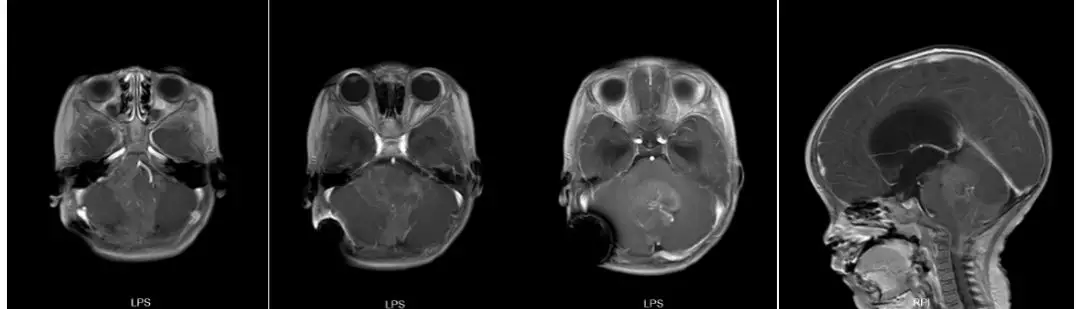
图2. 头颅MR增强:见后颅窝肿块轻度强化,四脑室出口生长进入脑干侧前方,包绕椎动脉、小脑后下动脉等分支,向下延伸进入椎管内。
手术治疗:行经枕后正中入路肿瘤切除术。术中见硬膜绷紧,脑压极高。“H”形切开硬脑膜,暴露小脑蚓部,见肿瘤从枕大池处突出,在显微镜下游离其周缘,并逐步分块切除肿瘤减压,见肿瘤突入四脑室内,沿右侧侧孔向脑干两侧延伸,包绕后组颅神经、小脑后下动脉及椎动脉,肿瘤质软且脆,色微红,鱼肉状,血供极其丰富。肿瘤与延髓右侧面粘连严重,予锐性分离。镜下切除视野内肿瘤组织。术后分流管压力调节至160。
手术采用后正中入路
术中暴露肿瘤,并予分块切除
术中暴露并保护椎动脉
术中游离肿瘤脑干面
术中探查双侧PICA

术毕回纳颅骨,使用蛇牌可吸收颅骨固定钉,适宜颅骨生长还未完成的小儿病患
术后1周复查增强MR:
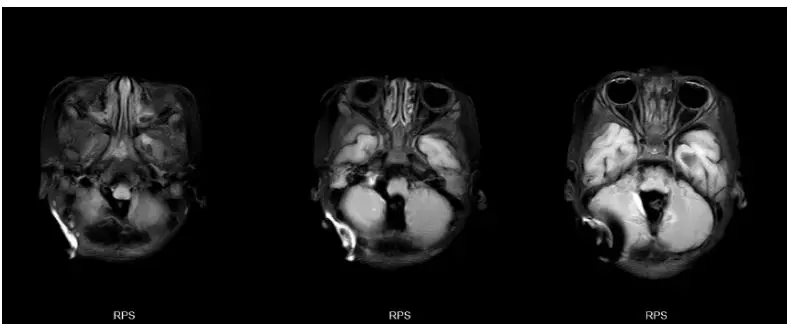
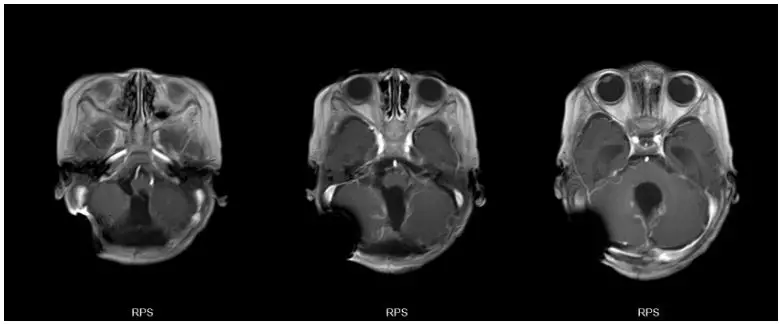
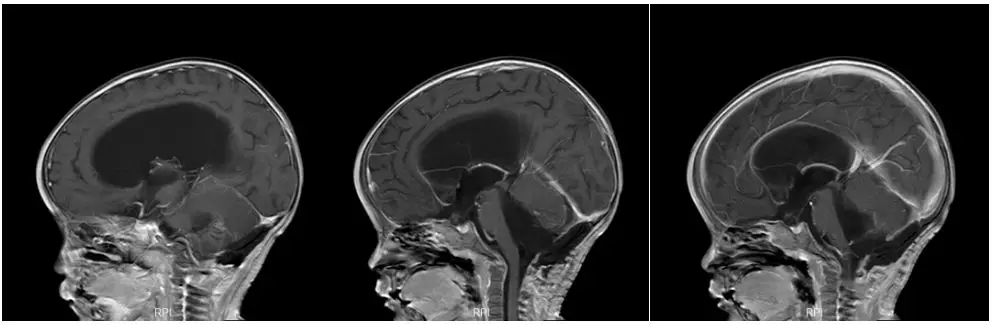
图4. 肿瘤切除术后,术区未见明显强化肿瘤残余,脑积水缓解。同时,由于使用蛇牌可吸收钉固定颅骨,成像无伪影,不影响术后检查。
病理报告:间变性室管膜瘤(WHOIII级)

图5. 镜下见肿瘤细胞排列成假菊形团样结构,核轻度异型,区域血管内皮细胞增生。
免疫组化:Syn-,CK-,EMA见点状+,GFAP+,Ki-67约50%+,H3K27M-,S-100+,NF-,Vim+
进一步评估全脊髓MR未见肿瘤转移情况。
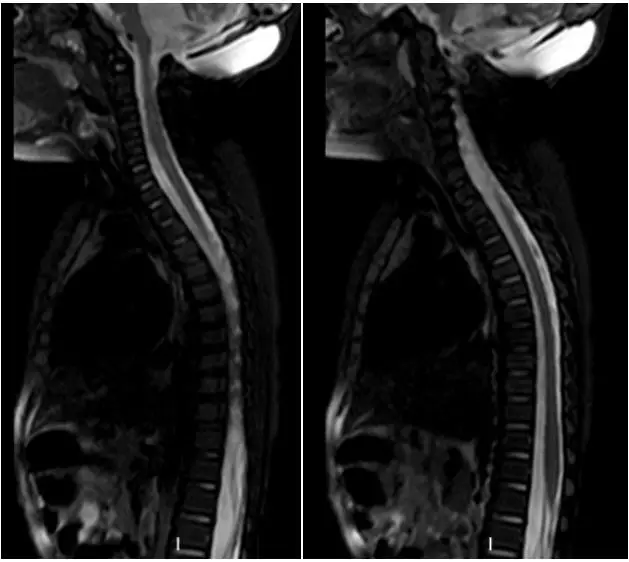
图6. 患儿全脊髓增强MR,未见明显异常信号。
术后随访及治疗
患儿目前恢复可,无明显神经功能后遗症残留,吞咽功能正常,无呛咳,无脑脊液漏等,脑室腹腔分流管压力200。术后因年龄关系未行全脑全脊髓放疗,予以术后辅助化疗。
化疗方案:长春新碱+顺铂+漠洛司汀。
目前仍随访复查中。
讨论
室管膜瘤(ependymoma)是一种起源于室管膜上皮细胞的神经上皮性肿瘤,好发于儿童和青年,是儿童常见的颅内肿瘤之一,约占儿童颅内肿瘤的6-10%。其中约25-51%的发生于3岁以下的儿童中,严重危害儿童的健康。[1]
根据WHO 2016年指引将室管膜瘤分成五大类[2]:
1. 室管膜下室管膜瘤(WHO I级)
2. 粘液乳头型室管膜瘤(WHO I级)
3. 室管膜瘤(WHO II级)
a) 乳头型
b) 透明细胞型
c) 伸长细胞型
4. 室管膜瘤,RELA融合阳性(WHO II-III级)
5. 间变性室管膜瘤(WHO III级)
其中最大的改变是引入了分子基因检测结果作为依据,但在室管膜瘤的分类中,仅室管膜瘤,RELA融合阳性是由基因定义较明确被接受,其他的仍然缺少识别这些亚组的简单分子标记和实验,仍以组织学分类为主。RELA融合是指编码NF-κB信号的重要效应物的RELA基因与C11orf95基因融合,突变位点发生于染色体 11q13.1位点,导致NF-κB通路的激活[3]。
另有研究[4]根据肿瘤组织不同DNA甲基化状态及相关基因学改变,将室管膜分成9个分子亚型。根据肿瘤的不同部位分幕上、幕下和脊髓各3个亚组。幕下/后颅窝的亚组有PF-SE,PF-EPN-A和PF-EPN-B,其中PF-SE仅在成人中出现,预后较好。PF-EPN-A亚组好发于婴幼儿,难以完全切除,并伴有较高的复发率。
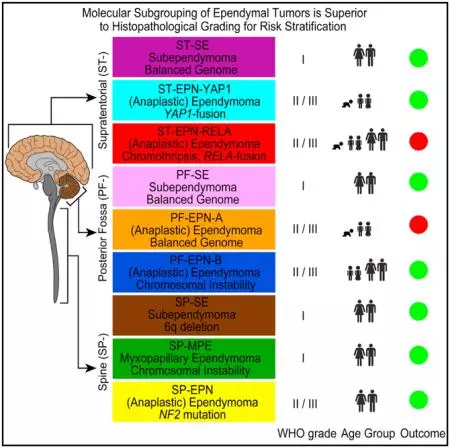
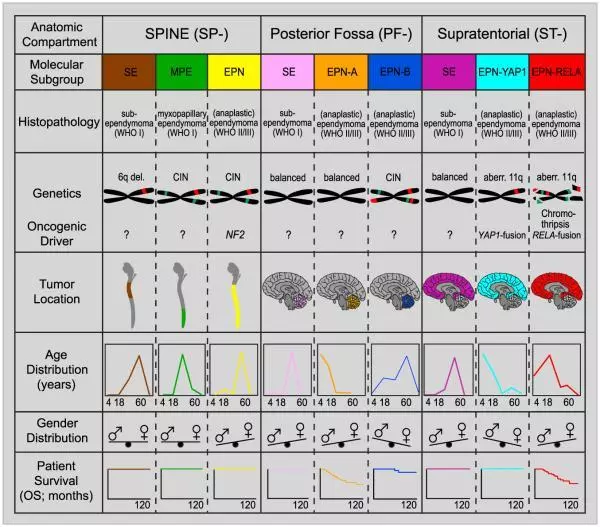
图7. Graphical summary of key molecular and clinical characteristics of ependymal tumor subgroups. Schematic representation of key genetic and epigenetic findings in the nine molecular subgroups of ependymal tumors as identified by methylation profiling. CIN, Chromosomal instability.
Reprinted from Cancer Cell , Volume 27, Kristian W. Pajtler, Hendrik Witt, Martin Sill, etc, Molecular Classification of Ependymal Tumors across All CNS Compartments, Histopathological Grades, and Age Groups, Pages 728–743, Copyright (2015), with permission from Elsevier.
临床症状根据肿瘤生长的部位而不同,约65-75%的儿童肿瘤发生于后颅窝,临床上通常表现为肿瘤阻塞四脑室水平引起的梗阻性脑积水,另外还有局部压迫引起的共济失调,颈部疼痛和颅神经麻痹。幕上室管膜瘤则通常引起头痛、癫痫发作以及局部的神经功能障碍。儿童脊髓的室管膜瘤少见,通常引起背部疼痛,下肢乏力或大小便功能失禁。
目前室管膜瘤的治疗标准为手术切除及术后的放疗。手术切除是室管膜瘤的首选治疗方法,其预后与手术切除程度密切相关。据相关报道,肿瘤全切患儿的生存率可达到66-80%,而次全切除的患儿的生存率仅有0-47%,所以手术全切显得尤为重要。但是根据肿瘤生长的部位、方式、大小以及术者经验等因素,目前全切率并不高,约在42-66%之间。如该病例中的患儿,其肿瘤巨大,生长方式除占据四脑室外,通过侧孔包绕脑干生长,与重要的神经血管(后组颅神经及椎动脉血管及其分支)粘连紧密,全切通显得较为困难,这要求手术者有较高的显微操作技术及术中耐心的分离与技巧。此外,对于小儿患者来说,术中的骨瓣回纳及颅骨固定步骤也很重要,建议选用安全的可吸收材质的颅骨固定产品,例如蛇牌可吸收颅骨固定钉,尽量保证把外科手术对小儿患者的影响降到最低。
术后的放疗通常是必须的,当时针对低龄儿童,小于3岁的目前放疗并不推荐。但最新的2017年欧洲神经肿瘤协会(EANO)发布的《室管膜肿瘤的诊断和治疗指南》[5]推荐,把术后推荐放疗的年龄降低到了12个月,主要的考虑就是除手术之外,有效的治疗手段证据级别较高的是放疗,而且应用调强适形放疗(IMRT)技术的局部照射对12月以上患儿影响非常小,是安全的。化疗在治疗室管膜瘤上的效果目前仍不明确,除了是不能接受放疗患儿的替代选择方案,同时也为第一次手术有残留的患儿控制肿瘤生长,提供了再次手术的机会。

2017年EANO《指南》儿童新发颅内WHOII-III级室管膜肿瘤治疗建议
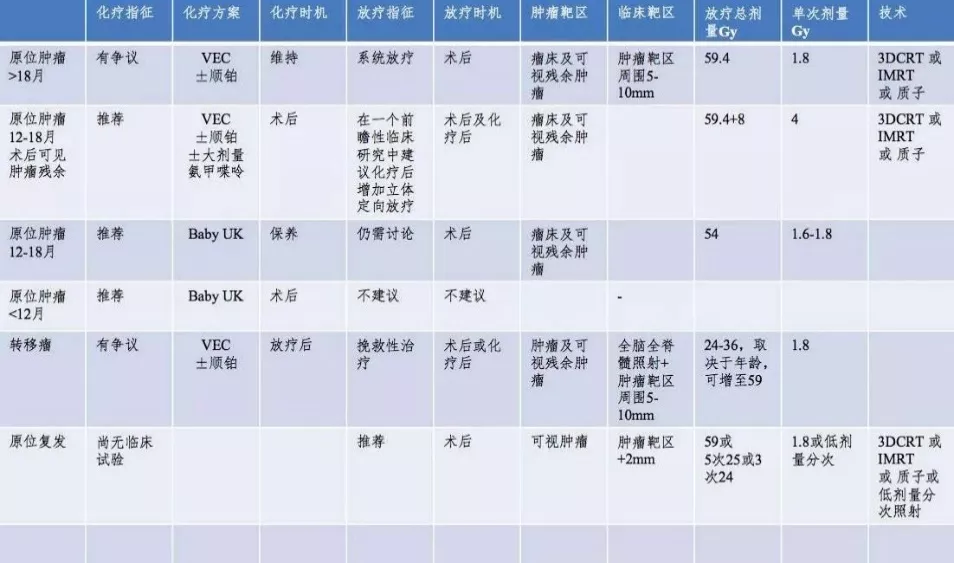
2017年EANO《指南》儿童WHOII-III级室管膜肿瘤非手术治疗建议
目前室管膜瘤的总体治疗效果仍不满意,随着分子生物学、基因染色体组学的不断研究深入,对室管膜的认识也逐渐加深,有更多的科学研究需要转化为临床应用。针对低龄儿童的治疗,术后放疗剂量以及时机的选择,是否进行化疗,选用什么方案化疗,其他的基因免疫治疗,如何提高患儿的预后,仍是我们需要努力的方向。
参考文献
1. Lin FY, Chintagumpala M. Advances in Management of Pediatric Ependymomas. Current oncology reports. 2015;17(10):47.
2. Louis DN, Perry A, Reifenberger G, von Deimling A, Figarella-Branger D, Cavenee WK, et al. The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary. Acta neuropathologica. 2016;131(6):803-20.
3. Parker M, Mohankumar KM, Punchihewa C, Weinlich R, Dalton JD, Li Y, et al. C11orf95-RELA fusions drive oncogenic NF-kappaB signalling in ependymoma. Nature. 2014;506(7489):451-5.
4. Pajtler KW, Witt H, Sill M, Jones DT, Hovestadt V, Kratochwil F, et al. Molecular Classification of Ependymal Tumors across All CNS Compartments, Histopathological Grades, and Age Groups. Cancer cell. 2015;27(5):728-43.
5. Ruda R, Reifenberger G, Frappaz D, Pfister SM, Laprie A, Santarius T, et al. EANO guidelines for the diagnosis and treatment of ependymal tumors. Neuro-oncology. 2018;20(4):445-56.
往期回顾



