【Ref: Darmanis S, et al. Cell Rep. 2017 Oct 31;21(5):1399-1410. doi: 10.1016/j.celrep.2017.10.030.】
胶质母细胞瘤(GBM)是成人最常见的原发性恶性脑肿瘤,由于肿瘤核心外的侵袭性细胞通常不受局部治疗的影响,其弥漫性生长而难以治愈。以往研究表明,GBM存在异质性。目前仍缺乏GBM单细胞水平的研究,缺乏肿瘤微环境中神经元、小胶质细胞、免疫细胞和血管细胞之间的相互作用的研究。美国斯坦福大学生物工程学和应用物理学的Spyros Darmanis等对4例IDH1阴性的原发性GBM进行单细胞RNA测序(RNA-seq),研究GBM细胞的侵袭性特征,其结果发表在2017年10月的《Cell Reports》上。
研究者从每例GBM患者的肿瘤核心和肿瘤外围两个不同的位置采集样本(图1A)。利用各种类型细胞的特异性标志物纯化各个细胞亚群,包括神经元、星形胶质细胞、髓系来源细胞和血管内皮细胞等,有助于捕获迁移到瘤周组织中的肿瘤细胞和比较肿瘤微环境中各种神经细胞和免疫细胞的转录组水平变化。分选后的细胞置入96孔板培养,并进行RNA测序(图1B)。
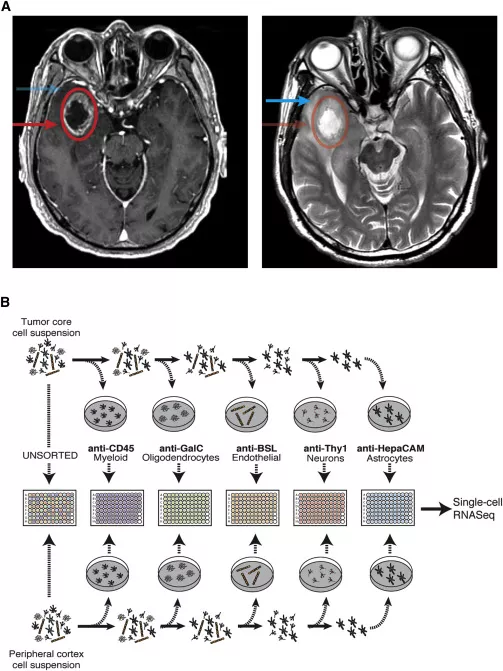
图1. A.右颞极GBM患者的MRI-T1增强(左侧)和T2(右侧)成像显示,肿瘤核心部位强化(红色圆圈,箭头),瘤周部位T2高信号(蓝色箭头);B.实验示意图。
作者对3589个质控过关的单细胞进行测序,通过t-distributed stochastic neighbor embedding(tSNE)法将每个细胞投射到二维图上,图上两点间的距离代表细胞间转录组水平的差异。采用k-means法将细胞进行聚类,分成12个亚群(图2A),相关的特异性基因得以表达(图2B)。通过这类方法有效地区分神经元、胶质细胞和血管内皮细胞。肿瘤细胞亚群中,94%来源于肿瘤核心区,伴有EGFR和SOX9过表达。各细胞亚群的体外培养呈现明显的异质性,展现不同的形态和增殖特性(图2C、D)。
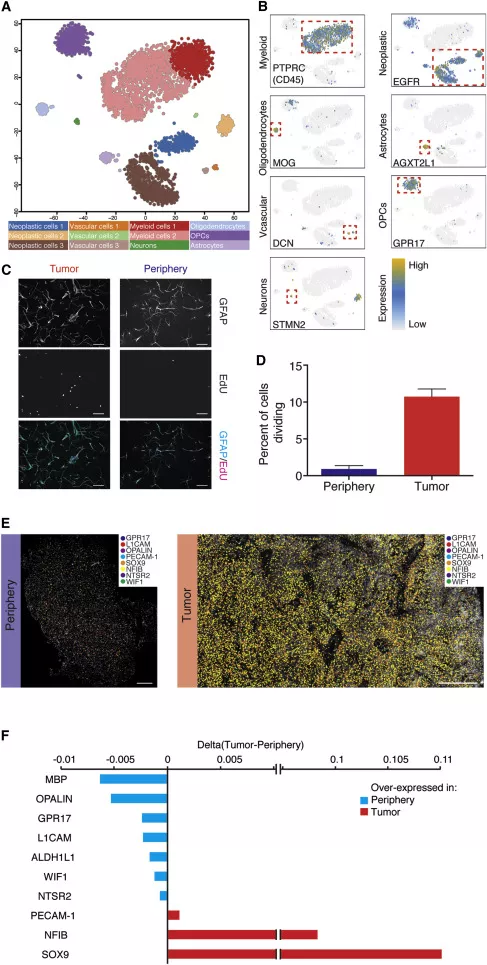
图2. 肿瘤细胞的一般特征示意图。A.3589个单细胞的二维图;各细胞亚群进行着色表示不同的细胞类别;B.覆盖在二维图上的各细胞类型特异性基因的表达;C.HepaCAM阳性细胞GFAP和EdU染色;D.EdU阳性细胞定量,计算来自肿瘤核心和瘤周的所有蓝色荧光(DAPI)核的百分比。
对肿瘤细胞亚群分析后发现,肿瘤细胞主要来源于肿瘤核心区,少部分来源于瘤周区(图3A)。作者认为肿瘤从核心区迁移到瘤周区的细胞即为侵袭性肿瘤细胞。为进一步显示侵袭性肿瘤细胞的分子特征,作者使用DESeq2算法得出了22种在侵袭性肿瘤细胞的高表达基因(图3B)。
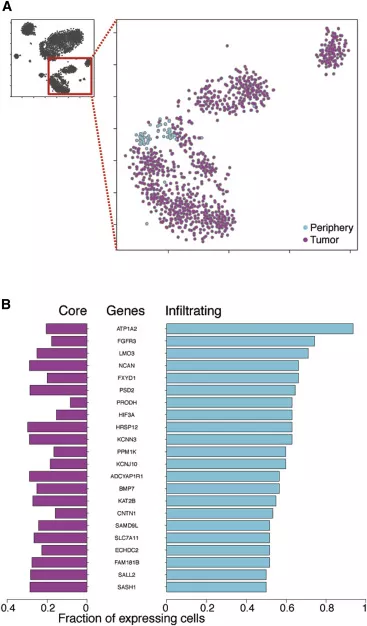
图3. 对侵袭性肿瘤细胞的分析比较。A.二维图示来自肿瘤核心与瘤周染色的肿瘤细胞;B.来自肿瘤核心与瘤周的肿瘤细胞之间的基因表达差异。
对肿瘤中浸润的免疫淋巴细胞进行分析发现,巨噬细胞或小胶质细胞可分布在瘤周也可在肿瘤核心,提示髓系来源的细胞亚群在肿瘤核心区内外的存在差异(图4A)。炎症相关标志物在瘤周表达更多,而血管形成相关因子在肿瘤核心区表达更多(图4B)。
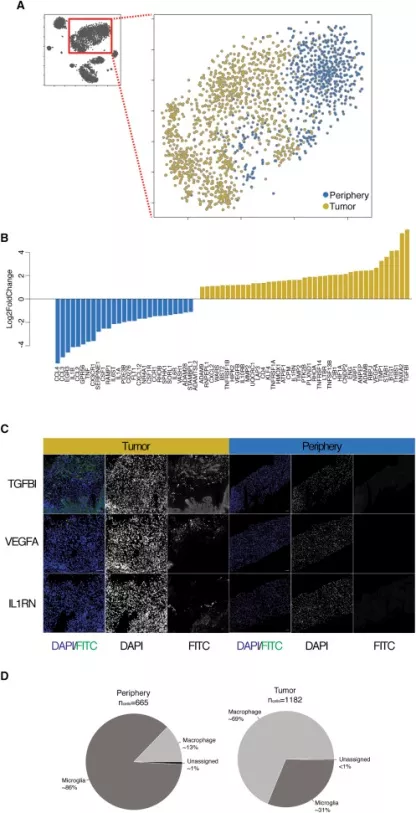
图4. 免疫细胞的分析比较。A.2D-tSNE显示肿瘤核心或瘤周的染色免疫细胞;B.参与ECM重塑的血管生成和免疫调节的基因列表中,来自肿瘤核心或瘤周的免疫细胞之间log2倍数变化条带图。
该研究揭示GBM单细胞的转录组表达情况,提供肿瘤发生、肿瘤侵袭以及肿瘤细胞与免疫系统之间相互作用的大量信息。上述数据保存在免费的网站(http://www.gbmseq.org/),供大家使用。
(墨尔本大学mackaay编译,复旦大学附属华山医院花玮博士审校,《神外资讯》主编、复旦大学附属华山医院陈衔城教授终审)



