
神外资讯【中华神外】专栏,每周二发布一篇精选文章,今天刊登的是,由南方医科大学南方医院神经外科潘军、张世超、彭俊祥、刘忆、樊俊、包贇、漆松涛在《中华神经外科杂志》2017年第十二期“小儿神经外科”上发表的《儿童鞍膈下颅咽管瘤的临床特点及手术治疗》,欢迎阅读。
目的
分析儿童鞍膈下颅咽管瘤的临床特点及手术治疗策略。
方法
回顾性纳入南方医科大学南方医院神经外科2000年12月至2015年1月收治的68例鞍膈下颅咽管瘤患儿,均行手术切除。根据手术方式不同分为经蝶窦组(19例)和经颅组(49例),其中经颅组根据手术入路不同分为侧方入路组(12例)和前纵裂入路组(37例)。所有患儿术后行门诊随访。分析鞍膈下颅咽管瘤的临床特点及影响手术方式、手术入路选择和术后复发的因素。
结果
鞍膈下颅咽管瘤是儿童颅咽管瘤的常见类型(41.7%,68/163),最常见的临床表现为生长发育迟缓和视力视野改变,分别占86.8%(59/68)和69.1%(47/68)。58.8%(40/68)的患儿术前即出现全垂体功能减退症。68例患儿的随访时间为18~270个月,平均(71.4±53.4)个月。头颅MRI增强扫描发现19.1%(13/68)的患儿肿瘤复发,71.4%(20/28)的患儿术后出现新发的垂体激素轴功能障碍。肿瘤体积>10 cm³、鞍上肿瘤横径/鞍内肿瘤最大横径>2、垂直于鞍膈平面的肿瘤最大径>4 cm和鞍上肿瘤囊腔存在复杂的生长方式为选择经颅手术的因素(均P<0.05)。鞍内肿瘤未循膜性边界切除、鞍内肿瘤最大横径>2.5cm是影响肿瘤复发的独立危险因素(均P<0.05)。
结论
鞍膈下颅咽管瘤患儿无论选择经蝶窦还是经颅手术,增加鞍内肿瘤的显露和切除均可以降低术后复发的风险。经颅手术时选择前纵裂入路更有助于增加肿瘤的鞍内显露。
颅咽管瘤是儿童最常见的鞍区肿瘤,肿瘤毗邻下丘脑、视交叉、垂体等重要结构,患儿术前即可出现多种临床症状。此外,儿童期起病的颅咽管瘤往往起源于鞍膈下,形态似字母“Q”,故简称为Q型颅咽管瘤。目前,手术入路选择方面仍存在争议,由于单中心病例数量有限,至今尚无针对儿童Q型颅咽管瘤临床特点及手术方式选择的文献报道。本研究采取不同的手术方式治疗Q型颅咽管瘤患儿效果良好,现回顾性分析如下。
资料与方法
1. 纳入标准和排除标准:
纳入标准
(1)第一作者或通信作者实施手术并全程参与治疗及随访;
(2)患儿发病年龄≤14岁;
(3)头颅MRI及术中发现符合鞍膈下颅咽管瘤的特征[1],复发病例则参考首次术前头颅MRI影像。
排除标准
(1)发病年龄>14岁;
(2)鞍上起源的颅咽管瘤;
(3)累及鼻咽部等广泛区域的幼稚型颅咽管瘤。
2. 临床资料:
南方医科大学南方医院神经外科2000年12月至2015年1月共收治163例颅咽管瘤患儿,本研究共纳入68例(41.7%,68/163)Q型颅咽管瘤患儿,其中男42例,女26例;发病年龄为1~14岁,平均(8.1±4.9)岁;其中0~5岁22例,5~10岁30例,>10岁16例。68例患儿中,54例为初次手术,其余14例为外院或本院手术后复发,复发患儿第1次术前头颅MRI扫描符合Q型颅咽管瘤特征。临床表现:生长发育迟缓或发育期第二性征不明显59例(86.8%),视交叉综合征(视敏度下降、视野改变)47例(69.1%),单眼或双眼失明或仅剩光感20例(29.4%),肿瘤占位效应相关症状(头痛、呕吐)47例(69.1%),多饮、多尿为主诉21例(30.9%),癫痫等神经功能障碍8例(11.8%),情志改变为代表的精神症状8例(11.8%),体质量异常(肥胖或消瘦)或生物节律紊乱为代表的下丘脑功能紊乱4例(5.9%)。
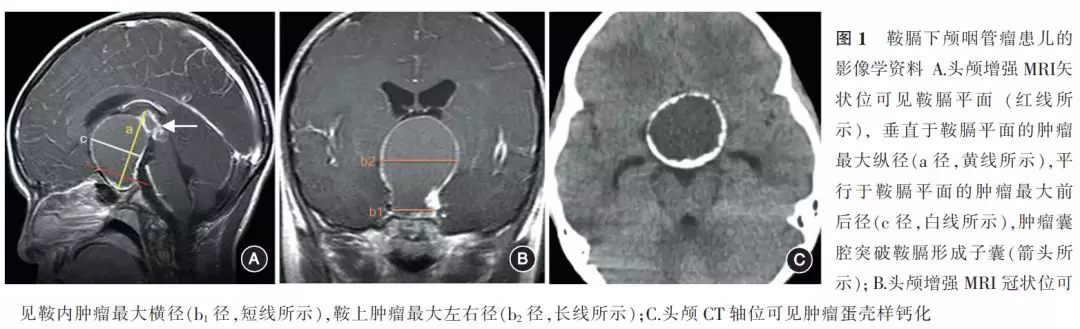
3. 影像学资料:术前所有患儿行头颅MRI扫描并测量肿瘤大小,分别测量MRI正中矢状位肿瘤垂直于鞍膈平面的最大纵径(a)、鞍内肿瘤最大横径(b1)、平行于鞍膈平面的鞍上最大横径(b2)及平行于鞍膈平面最大前后径(c);肿瘤体积的计算公式为:V=a×b2×c×π/6。为了反映肿瘤鞍上累及程度,测量鞍上最大横径和鞍内肿瘤最大横径的比值(b2/b1)。
Q型颅咽管瘤患儿的典型头颅MRI影像学特点为蝶鞍扩大,从鞍内向鞍上均匀扩展类圆形肿瘤,实质部分一般位于鞍内,囊性成分向鞍上扩张(图1A,B)。CT扫描可见蝶鞍均有不同程度的扩大,鞍内伴有不规则碎屑样钙化,鞍上囊壁合并有不连续的蛋壳样钙化(图1C)。根据头颅MRI影像显示肿瘤累及的解剖部位,本组68例患儿可分为蝶窦(和筛窦)-鞍内-鞍上-鞍膈下4例(5.9%),鞍内-鞍上-鞍膈下43例(63.2%),鞍内-鞍上-穿鞍膈17例(25.0%),鞍内-鞍上穿垂体柄4例(5.9%)。垂直于鞍膈的最大纵径、平行于鞍膈的最大前后、左右径分别为(4.0±1.3)cm、(3.3±1.1)cm和(3.3±1.2)cm,肿瘤的体积平均为(29.6±21.4)cm³。肿瘤钙化及实质部分占肿瘤总体积平均为(29.1±16.8)%,囊液占肿瘤总体积平均为(77.1±19.6)%。b2/b1值平均为(0.7~4.2)±0.5,比值>2的24例(35.3%)。 22例(32.3%,22/68)肿瘤生长方式复杂,主要表现为肿瘤突破鞍膈孔沿垂体柄向第三脑室壁生长或肿瘤突破鞍膈后在鞍上形成子囊,包绕鞍上重要结构。
4. 内分泌评价方法:
垂体功能评价方式参照文献[2]。根据中国儿童、青少年超重、肥胖筛查体质量指数(body mass index,BMI)分类标准将患儿BMI指数分为正常、超重和肥胖[3]。68例患儿术前均行垂体功能评价,大部分至少存在1种下丘脑-垂体激素轴异常,其中下丘脑-垂体-生长激素轴低下54例(79.4%),下丘脑-垂体-皮质激素轴低下49例(72.1%),下丘脑-垂体-甲状腺素轴低下45例(66.2%);术前全垂体功能减退症40例(58.8%)。处于青春期的患儿均存在不同程度第二性征发育迟缓。术前BMI值平均为17.9±3.1,有28例(41.2%)超重患儿。
5. 治疗方法:
2009年12月之前收治的33例患儿主要选择经额颞颅底入路(额颞、额外侧、眉弓锁孔等)12例,经前纵裂额底入路13例,经蝶窦入路8例。2010年后对手术方式进行了改进,35例患儿选择经前纵裂额底入路24例,神经内镜下扩大经蝶窦入路11例。
改进措施主要包括:
(1)磨除鞍结节、蝶骨平台骨质增加鞍内肿瘤显露;
(2)通过神经内镜辅助减少鞍内肿瘤残留,对于经蝶窦入路的患儿主要通过扩大经蝶窦入路增加鞍底骨质显露范围,提高鞍内肿瘤的全切除率;
(3)沿垂体囊膜进行肿瘤分离。根据手术方式将68例患儿分为经蝶窦手术组(19例)和经颅手术组(49例);根据手术入路将49例经颅手术组患儿分为侧方入路组(12例)和前纵裂入路组(37例)。
6. 随访方法:存活患者术后1~3个月、6个月、12个月及此后每年均行头颅MRI增强扫描;术后1~3个月同时行内分泌及眼科学检查。以全切除后再次出现肿瘤影像,或未全切除患者的残余肿瘤随访期内增大定义为肿瘤复发。
7. 统计学方法:采用SPSS 24.0软件进行统计学分析。符合正态分布的计量资料采用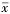 ±s表示;计数资料采用例数和百分比表示,组间比较采用x²检验。单因素分析方法分析影响Q型颅咽管瘤手术入路的选择及术后复发的因素,对其有统计学意义的因素进一步采用多因素Cox回归分析。以P<0.05为差异有统计学意义。
±s表示;计数资料采用例数和百分比表示,组间比较采用x²检验。单因素分析方法分析影响Q型颅咽管瘤手术入路的选择及术后复发的因素,对其有统计学意义的因素进一步采用多因素Cox回归分析。以P<0.05为差异有统计学意义。
结果
1. 手术结果:68例患儿鞍上肿瘤囊壁均全切除。根据影像学资料,鞍内肿瘤全切除率为94.1%(64/68)。根据手术录像,鞍内部分完全沿膜性边界完整分离27例,其余患儿为鞍内清除肿瘤,可能存在瘤壁残留。经蝶窦入路术后出现脑脊液漏5例(26.3%,5/19),颅内感染2例(10.5%,2/19)。97.1%(66/68)的患儿围手术期出现尿崩、电解质紊乱等并发症,经对症治疗逐渐好转。无围手术期死亡病例。
2. 影响手术方式、手术入路选择的单因素分析:单因素分析显示肿瘤体积>10 cm³,矢状位垂直于鞍膈平面的最大纵径(a径)>4 cm,鞍上最大横径和鞍内肿瘤最大横径的比值(b2/b1)>2,鞍内肿瘤最大横径(b1径)>2.5cm,鞍上肿瘤囊腔存在复杂的生长方式及存在砾石样钙化的肿瘤更倾向于选择经颅手术(表1)。采用侧方入路与前纵裂入路的经颅手术患儿间在肿瘤体积、平行于鞍膈平面的鞍上最大横径(b2径)>3cm、矢状位肿瘤垂直于鞍膈平面的最大纵径(a径)>4 cm方面的差异均有统计学意义(均P<0.05,表2)。
表1. 影响68例鞍膈下颅咽管瘤患儿手术方式
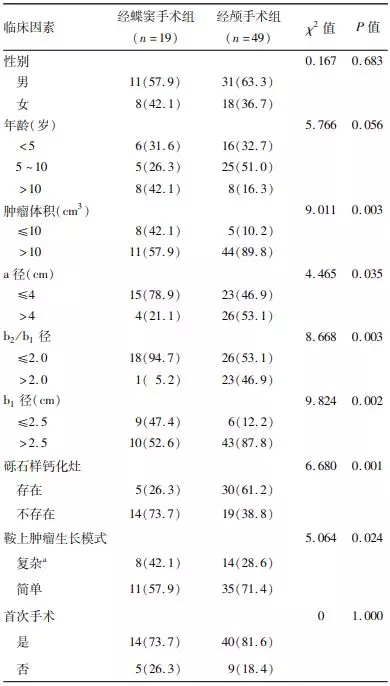
注:a径为MRI正中矢状位肿瘤垂直于鞍膈平面的最大纵径,b1为鞍内肿瘤最大横径,b2为平行于鞍膈平面的鞍上最大横径;a为肿瘤突破鞍膈形成子囊或沿鞍隔孔或垂体柄生长累及第三脑室
表2. 影响经颅手术组49例鞍膈下颅咽管瘤患儿
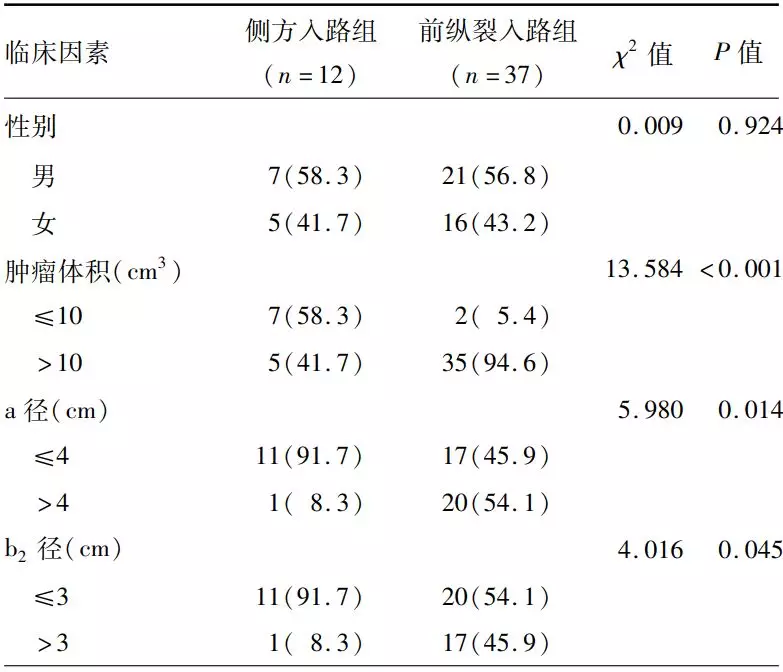
注:a径为MRI正中矢状位肿瘤垂直于鞍膈平面的最大纵径;b2径为平行于鞍膈平面的鞍上最大横径
3. 随访结果:68例患儿的随访时间为18~270个月,平均(71.4±53.4)个月。(1)头颅MRI增强扫描结果:19.1%(13/68)的患儿随访期间复发。
(2)内分泌检查结果:71.4%(20/28)的患儿出现新发的垂体激素轴功能障碍。
(3)眼科学检查结果:术后至少出现单侧视力好转或与术前一致42例(62%),一过性视力恶化18例(26.5%),永久性视力恶化5例(7.4%),其余3例不配合检查。
4. 影响肿瘤复发的单因素和多因素分析:单因素分析显示肿瘤复发与未沿膜性结构切除鞍内肿瘤,矢状位垂直于鞍膈平面的最大纵径(a径)>4cm和平行于鞍膈平面的鞍内最大横径(b1径)>2.5 cm有关(表3)。多因素Cox回归分析显示鞍内肿瘤的处理方式以及平行于鞍膈平面的鞍内最大横径(b1径)>2.5 cm是肿瘤复发的独立危险因素(表4)。
表3. 影响68例鞍膈下颅咽管瘤患儿术后
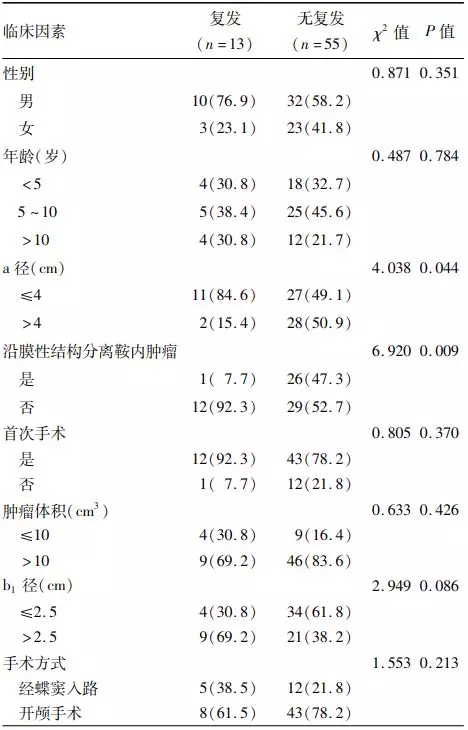
注:a径为MRI正中矢状位肿瘤垂直于鞍膈平面的最大纵径;b1为鞍内肿瘤最大横径
表4. 影响68例鞍膈下颅咽管瘤患儿术后
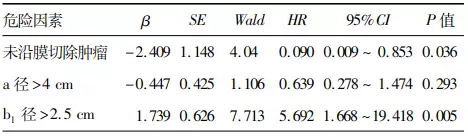
注:a径为MRI正中矢状位肿瘤垂直于鞍膈平面的最大纵径;b1径为鞍内肿瘤最大横径
讨论
Q型颅咽管瘤是儿童颅咽管瘤中常见的类型,文献中采用“sub-or infradiaphragmatic”(鞍膈下或鞍膈内)或“sellar craniopharyngioma”(蝶鞍区颅咽管瘤) 等术语来描述[2]。目前,对Q型颅咽管瘤的研究多为小样本病例报道。在Van Effenterre和Boch[4]描述的122例颅咽管瘤患者(包括成人和儿童)中,37%被描述为“鞍膈内起源”。而在Lee等[5]报道的66例颅咽管瘤患儿中,Q型颅咽管瘤占了40.9%。本研究总结分析了68例Q型颅咽管瘤患儿的临床及影像学特点,是目前针对儿童Q型颅咽管瘤的大宗病例报道之一[6-20]。
从肿瘤起源及生长方式看,Q型颅咽管瘤是经蝶窦手术的最佳适应证[6-24]。Fahlbusch等[11]报道的168例颅咽管瘤患者中,其中31例经蝶窦手术,绝大多数肿瘤直径<3cm,仅1例直径>4cm。Frank等[12]报道神经内镜辅助下经蝶窦切除颅咽管瘤,肿瘤的平均直径为2.9 cm。Abe和Lüdecke[17]报道11例经蝶窦切除的颅咽管瘤平均直径为1.7 cm。随着神经内镜及相关器械的改进,经蝶窦入路治疗大型颅咽管瘤的适应证正在逐步扩大[8,17-20]。本组27.9%的患儿采用经蝶窦入路,与经颅手术比较,术后肿瘤复发率无明显差别,说明选择合理的适应证,经蝶窦入路可达到良好的疗效。需要注意的是,经蝶窦切除颅咽管瘤与垂体腺瘤完全不同,本研究显示鞍内颅咽管瘤仅行囊内清除时复发率较高。因此,儿童Q型颅咽管瘤行经蝶窦手术时,需磨除更大范围的鞍底骨质。特别在处理鞍内两侧囊壁时常伴随海绵窦出血,术后难以避免肿瘤囊壁的残留,这部分患儿需随访更长时间监测其复发。总之,随着神经内镜及其相关器械的发展,经蝶窦入路将更广泛地应用于Q型颅咽管瘤患儿的治疗。
与其他文献报道类似[6-10,22],本研究中经蝶窦手术组的患儿术后视力改善情况优于经颅手术组,而脑脊液漏的发生率高于经颅手术组。但需要注意的是,两组患儿在肿瘤体积、肿瘤最大纵径方面差异均有统计学意义,而且多数复发病例选择经颅手术,这些因素均可导致经颅手术患者视力好转甚至恢复的可能性变小,因此要谨慎解读视力转归的结果。本研究统计学分析显示,肿瘤鞍上体积巨大、鞍上囊腔复杂的生长方式、鞍内肿瘤横径>2.5 cm,鞍上肿瘤横径显著大于鞍内肿瘤横径(比值>2)及肿瘤存在砾石样大钙化灶是选择经颅手术的影响因素。另外部分经颅手术后复发的病例,由于鞍上肿瘤可能与视交叉、第三脑室底及前循环血管发生紧密粘连,经蝶窦入路切除复发肿瘤的安全性还有待于进一步评估。
本研究表明,当选择经颅手术时,经前纵裂中线入路优于经侧方翼点入路或经额外侧入路,主要优势体现在对鞍内肿瘤的处理上。由于额叶底面上抬范围有限,经侧方入路处理鞍内肿瘤时可能存在盲点,而纵裂间隙则可为鞍内肿瘤的处理提供更佳视角,且前方入路也可为骨质磨除鞍结节蝶骨平台提供更好的操作视角和空间。因此,无论选择侧方路径还是中线路径,均应该避免使用轴内路径。部分位置极高,且突入鞍上第三脑室壁周围的肿瘤可能需要经终板等间隙放置棉片,并将肿瘤包膜推入轴外进行切除,切忌经轴内路径(终板间隙)直接分离切除肿瘤。
在以肿瘤全切除为目的的治疗理念下,本研究的重要发现是儿童Q型颅咽管瘤的复发均首先发生于鞍内,部分患儿复发可能来源于鞍底颅咽管的残迹,提示鞍内肿瘤的全切除是减少复发的最重要的措施[25-26]。基于此,本研究中自2010年开始对手术技术进行改进,统计学结果显示未沿包膜完整分离鞍内肿瘤以及平行于鞍膈平面的鞍内最大横径(b1径)>2.5 cm是儿童Q型颅咽管瘤复发的独立危险因素,其中鞍内部分肿瘤横径越大对术者的手术技巧要求也更高。因此,提高肿瘤鞍内部分的处理技术是防止肿瘤复发的重要手段。
参考文献
[1]潘军, 漆松涛, 龙浩, 等. 儿童蝶鞍区及第三脑室底颅咽管瘤的临床和手术特点[J].中华神经外科杂志,2009,25(5):405-407. DOI: 10.3760/cma.j.issn.10012346.2009.05.011.
[2]Qi S, Pan J, Lu Y, et al. The impact of the site of origin and rate of tumour growth on clinical outcome in children with craniopharyngiomas[J]. Clin Endocrinol (Oxf), 2012,76(1):103-110. DOI: 10.1111/j.1365-2265.2011.04172.x.
[3]中国肥胖问题工作组. 中国学龄儿童青少年超重、肥胖筛查体重指数值分类标准[J].中华流行病学杂志,2004,25(2):97-102. DOI: 10.3760/j.issn:0254-6450.2004.02.003.
[4]Van Effenterre R, Boch AL. Craniopharyngioma in adults and children: a study of 122 surgical cases[J]. J Neurosurg, 2002,97(1):3-11. DOI: 10.3171/jns.2002.97.1.0003.
[5]Lee YY, Wong TT, Fang YT, et al. Comparison of hypo-thalamopituitary axis dysfunction of intrasellar and third ventricular craniopharyngiomas in children[J]. Brain Dev, 2008,30(3):189-194. DOI: 10.1016/j.braindev.2007.07.011.
[6]Frazier JL, Chaichana K, Jallo GI, et al. Combined endoscopic and microscopic management of pediatric pituitary region tumors through one nostril: technical note with case illustrations[J]. Childs Nerv Syst, 2008,24(12):1469-1478. DOI: 10.1007/s00381.008.0710.9.
[7]Locatelli D, Levi D, Rampa F, et al. Endoscopic approach for the treatment of relapses in cystic craniopharyngiomas[J]. Childs Nerv Syst, 2004,20(11/12):863-867. DOI: 10.1007/s00381.004.0944.0.
[8]de Divitiis E, Cappabianca P, Cavallo LM, et al. Extended endoscopic transsphenoidal approach for extrasellar craniopharyngiomas[J]. Neurosurgery, 2007,61(5 Suppl 2):219-227; discussion 228. DOI: 10.1227/01.neu.0000303220.55393.73.
[9]Kitano M, Taneda M. Extended transsphenoidal surgery for suprasellar craniopharyngiomas: infrachiasmatic radical resection combined with or without a suprachiasmatic trans-lamina terminalis approach[J]. Surg Neurol, 2009,71(3):290-298, discussion 298. DOI: 10.1016/j.surneu.2007.11.014.
[10]Chakrabarti I, Amar AP, Couldwell W, et al. Long-term neurological, visual, and endocrine outcomes following transnasal resection of craniopharyngioma[J]. J Neurosurg, 2005,102(4):650-657. DOI: 10.3171/jns.2005.102.4.0650.
[11]Fahlbusch R, Honegger J, Paulus W, et al. Surgical treatment of craniopharyngiomas: experience with 168 patients[J]. J Neurosurg, 1999,90(2):237-250. DOI: 10.3171/jns.1999.90.2.0237.
[12]Frank G, Pasquini E, Doglietto F, et al. The endoscopic extended transsphenoidal approach for craniopharyngiomas[J]. Neurosurgery, 2006,59(1 Suppl 1):ONS75-83; discussion ONS75-83. DOI: 10.1227/01.NEU.0000219897.98238.A3.
[13]Gardner PA, Prevedello DM, Kassam AB, et al. The evolution of the endonasal approach for craniopharyngiomas[J]. J Neurosurg, 2008,108(5):1043-1047. DOI: 10.3171/JNS/2008/108/5/1043.
[14]Dusick JR, Esposito F, Kelly DF, et al. The extended direct endonasal transsphenoidal approach for nonadenomatous suprasellar tumors[J]. J Neurosurg, 2005,102(5):832-841. DOI: 10.3171/jns.2005.102.5.0832.
[15]Cavallo LM, Prevedello D, Esposito F, et al. The role of the endoscope in the transsphenoidal management of cystic lesions of the sellar region[J]. Neurosurg Rev,2008,31(1):55-64; discussion 64. DOI: 10.1007/s10143.007.0098.0.
[16]Maira G, Anile C, Albanese A, et al. The role of transs-phenoidal surgery in the treatment of craniopharyngiomas[J]. J Neurosurg, 2004,100(3):445-451. DOI: 10.3171/jns.2004.100.3.0445.
[17]Abe T, Lüdecke DK. Transnasal surgery for infradiaphragmatic craniopharyngiomas in pediatric patients[J]. Neurosurgery, 1999,44(5):957-964; discussion 964-966.
[18]Couldwell WT, Weiss MH, Rabb C, et al. Variations on the standard transsphenoidal approach to the sellar region, with emphasis on the extended approaches and parasellar approaches: surgical experience in 105 cases[J]. Neurosurgery, 2004,55(3):539-547; discussion 547-550.
[19]Dusick JR, Fatemi N, Mattozo C, et al. Pituitary function after endonasal surgery for nonadenomatous parasellar tumors: Rathke's cleft cysts, craniopharyngiomas, and meningiomas[J]. Surg Neurol, 2008,70(5):482-490; discussion 490-491. DOI: 10.1016/j.surneu.2008.03.027.
[20]Norris JS, Pavaresh M, Afshar F. Primary transsphenoidal microsurgery in the treatment of craniopharyngiomas[J]. Br J Neurosurg, 1998,12(4):305-312.
[21]de Vries L, Lazar L, Phillip M. Craniopharyngioma: presen-tation and endocrine sequelae in 36 children[J]. J Pediatr Endocrinol Metab, 2003,16(5):703-710.
[22]Thomsett MJ, Conte FA, Kaplan SL, et al. Endocrine and neurologic outcome in childhood craniopharyngioma: Review of effect of treatment in 42 patients[J]. J Pediatr, 1980,97(5):728-735.
[23]Honegger J, Buchfelder M, Fahlbusch R. Surgical treatment of craniopharyngiomas: endocrinological results[J]. J Neurosurg, 1999,90(2):251-257. DOI: 10.3171/jns.1999.90.2.0251.
[24]Karavitaki N, Cudlip S, Adams CB, et al. Craniopharyngiomas[J]. Endocr Rev, 2006,27(4):371-397. DOI: 10.1210/er.2006-0002.
[25]Laufer I, Anand VK, Schwartz TH. Endoscopic, endonasal extended transsphenoidal, transplanum transtuberculum approach for resection of suprasellar lesions[J]. J Neurosurg, 2007,106(3):400-406. DOI: 10.3171/jns.2007.106.3.400.
[26]Kassam AB, Gardner PA, Snyderman CH, et al. Expanded endonasal approach, a fully endoscopic transnasal approach for the resection of midline suprasellar craniopharyngiomas: a new classification based on the infundibulum[J]. J Neurosurg, 2008,108(4):715-728. DOI: 10.3171/JNS/2008/108/4/0715.
【中华神外】往期回顾
2017年第六期“功能神经外科”丨PET-MRI影像融合技术在药物难治性癫痫术前评估中的价值
2017年第六期“临床论著”丨血管超声在颈动脉内膜切除术前风险评估中的价值
2017年第五期“名医讲堂” |精准医学时代带给脑干胶质瘤治疗的新模式









