今天为大家分享的是由湘南学院附属医院神经外科冯梦龙医师编译,《神外资讯》常务编辑、海军军医大学附属长征医院神经外科徐涛医师审校的:松果体区肿瘤手术入路策略与技巧,欢迎观看、阅读!
Resection of Pineal Region Tumors- Pearls and Pitfalls
Supracerebellar Approach- Expanding the Operative Corridor
松果体区肿瘤手术入路的探索考验了早期神经外科先辈们的决心,直到20世纪初才出现相关的报道。Sir Victor Horsley、Brunner和Schloffer是松果体区手术入路的初探者,但均以失败或收获甚小而告终;直到1913年,Oppenheim和Krause成功切除了一例松果体区肿瘤。1921年,Walter Dandy在对小狗进行安全性验证试验后报道了3例经胼胝体入路切除松果体区肿瘤的病例。
1926年,Krause报道了这种成功的手术入路——幕下小脑上入路,并利用该入路完成了3例松果体区肿瘤的手术,其手术死亡率为0;这项成功激起了不少人对进入松果体区更有效的手术入路的探索兴趣,但却鲜有成功。所以,对于此类疾病,越来越多的医师选择保守治疗,直到手术显微镜时代的到来才逐渐改变了这种格局。
1971年,Stein沿用了Krause的幕下小脑上入路,在显微镜下完成了6例松果体区占位病变的切除,致残率低且手术死亡率为0。这项成功又激励着神经外科医师重新探索其他进入松果体区的手术入路,包括幕上入路等。
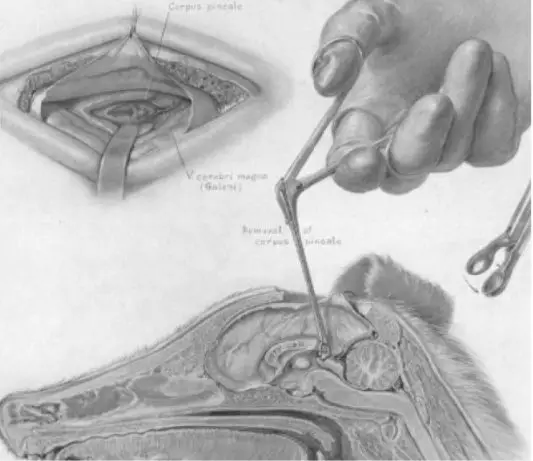
图1. 约100年前,Walter Dandy报道了经胼胝体入路安全切除狗的松果体。
诊断
松果体区肿瘤患者最常见的临床表现为梗阻性脑积水引起的颅内压增高症状,包括头痛、视力障碍、认知障碍和步态异常。若为急性脑积水,反应迟钝或意识丧失症状更明显,并且需急诊脑脊液分流或引流。
此外,患者可出现脑干或小脑受压表现,包括Parinaud综合征(中脑顶盖综合征),即双眼上视不能、眼睑收缩、集合性眼球震颤以及瞳孔光反射消失但调节反射存在;脑积水影响下丘脑而导致的内分泌功能障碍则罕见;有时,生殖细胞瘤侵犯第三脑室底部可引起尿崩症。
评估
如果患者表现为急性神志改变,CT提示脑室扩大,则需急诊脑室外引流。了解更多关于松果体区肿瘤诊断与评估的知识,请阅读Selection of Operative Corridor章节。
其他影像学辅助检查包括MRI平扫和增强,以评估肿瘤的增强特点、占位效应程度以及深部静脉引流系统与肿瘤的位置关系,这些都是手术计划的重要考虑因素。
大部分松果体区肿瘤均与附近的静脉系统关系密切,大脑大静脉(Galen静脉)及其属支常呈“鸟嘴形”匍匐于肿瘤背侧的包膜;而起源于中间帆的脑膜瘤、胼胝体压部的表皮样囊肿以及顶盖区/丘脑肿瘤则多位于静脉结构的尾侧和腹侧。所以,识别这些解剖差异至关重要,它们影响着手术计划。
此外,肿瘤大小、血供以及与周围结构的关系,尤其是第三脑室、向两侧/幕上生长及脑干侵犯,均可影响手术入路和方法。尽管我们可能从术前影像判断肿瘤起源,但其对周围结构的实际侵犯程度只能在术中知晓。
如果肿瘤周围血管解剖仍不清晰,CTA或MRA甚至DSA(少见)检查有助于显示相关解剖结构。此外,术前栓塞也是有帮助的,但起源于中间帆和其他部位的松果体区脑膜瘤通常无法栓塞,因为其主要血供来自脉络膜后内侧动脉(medial posterior choroidal artery,MPChA),介入方法无法到达。
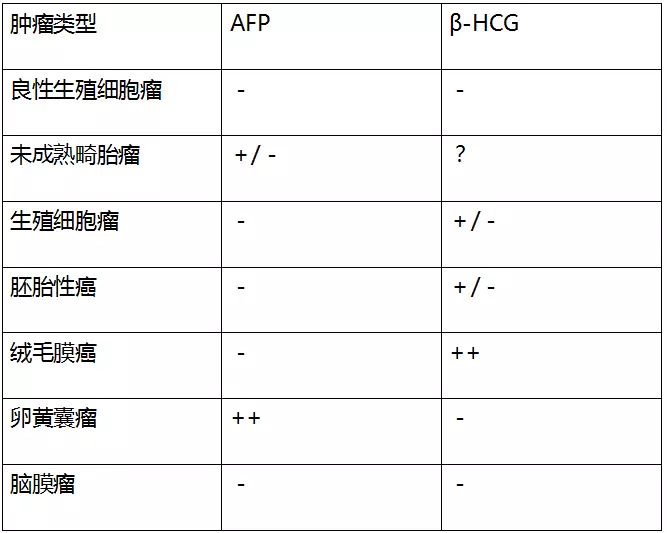
实验室检查包括脑脊液β-HCG、PLAP(胎盘碱性磷酸酶)和AFP水平,有助于鉴别各种生殖细胞肿瘤。当AFP升高时,应怀疑卵黄囊瘤和未成熟畸胎瘤;β-HCG升高提示绒毛膜癌,但胚胎性癌和生殖细胞瘤也可出现β-HCG升高(相对少见)。值得注意的是,当无AFP或β-HCG升高时亦不能完全排除生殖细胞瘤或胚胎性癌;在肿瘤全切前需获得术中冰冻切片病理结果以指导下一步手术。此外,有些混合性生殖细胞瘤可表达多种肿瘤标志物(见表1)。PLAP可用于免疫组化检测,但与脑脊液PLAP的临床意义不一样。
表1. 松果体区肿瘤生物标志物
脑脊液细胞学通常难以检测,但是若发现肿瘤细胞,则可指导治疗方案的制定而不需要进一步活检或病理切片检查。
松果体区病变
松果体区可发生多种良性和恶性肿瘤,主要分为四大类:生殖细胞肿瘤、松果体实质肿瘤、胶质瘤和其他肿瘤,如脑膜瘤、血管母细胞瘤、脉络丛乳头状瘤、化学感受器瘤、淋巴瘤和转移瘤。
血管畸形在松果体区较为少见,但也有发生,包括动静脉畸形、海绵状血管畸形以及大脑大静脉畸形。
松果体囊肿是松果体区最常见的占位,MRI表现为环形强化,直径可达2 cm,是松果体的正常变异,为松果体实质细胞包裹的囊性的良性病变。通常是无症状、非进展性的,除非引起导水管梗阻,否则一般无需治疗。笔者认为该类病变在不导致脑积水或其他继发性病变的情况下一般很少引起头痛等非特异性症状。
三脑室后部和松果体区的脑膜瘤较为罕见,这些肿瘤通常被认为起源于三脑室顶和松果体区的中间帆上的蛛网膜帽状细胞。尽管脑膜瘤可生长于三脑室内的任何部位,但一般将它们分为三脑室前部和后部脑膜瘤。

图2. 各种类型的松果体区病变。上排所示为一例松果体囊肿,注意其只有薄层环形强化;下排所示为一例顶盖区毛细胞型星形细胞瘤;而其他病变,如生殖细胞瘤、松果体母细胞瘤和胶质瘤卒中请阅读Selection of Operative Corridor章节。
本章节主要讲解松果体区和三脑室后部侵犯至松果体区的肿瘤。
手术指征
由于松果体区肿瘤患者的首发症状多为梗阻性脑积水引起,所以其治疗通常需先行脑脊液引流或分流。
对于非生殖细胞肿瘤,终极治疗手段为手术切除,应尽可能全切。但是,仅根据影像学和实验室检查往往难以在术前确定诊断。所以,组织病理学检查可帮助我们判断肿瘤是否需要全切,而对于那些不需要全切的肿瘤则可以避免积极手术带来的风险。笔者将会在Selection of Operative Corridor章节进一步讨论松果体区肿瘤的治疗决策。
目前对于松果体区肿瘤的评估与治疗没有正式统一的指南。有些医师青睐于先行立体定向穿刺活检,根据病理诊断再决定行手术治疗或放化疗。这种方法虽可避免一些不必要的开颅手术,但当活检表明肿瘤必须手术治疗时,则使患者遭受二次手术。
此外,松果体区肿瘤的穿刺活检较脑内其他部位的出血风险更高,因为附近血管丰富、穿刺需通过不止一层软脑膜、缺少周围组织的支撑以及松果体区肿瘤本身易出血。
有些医生则喜欢直接开颅手术,若术中病理证实为无需全切的肿瘤时则尽量减少侵入性操作而不追求全切。更重要的是,开颅活检可获得更多的病理标本,这点至关重要,因为生殖细胞肿瘤存在混合型的可能。
对于症状性脑积水,内镜下三脑室底造瘘优于脑室腹腔分流,尤其对于预期寿命较长的年轻患者。三脑室底造瘘可避免脑室腹腔分流引起的肿瘤细胞腹腔种植转移。然而,对于轻度或无症状的脑积水可不做特殊处理,因为肿瘤切除后脑积水一般自动解除。
三脑室底造瘘时可同时行内镜下活检,这样,一次手术可处理脑积水和获得病理学诊断。以下是笔者对于松果体区肿瘤的处理流程:
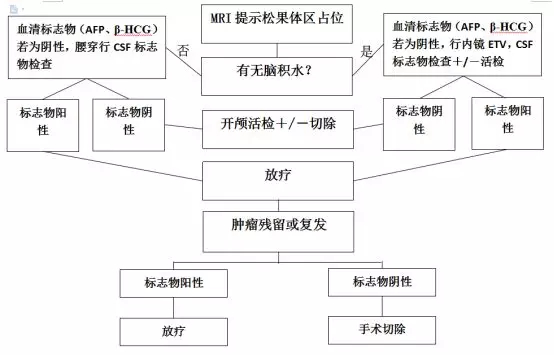
图3. 松果体区占位病变处理流程图。
良性占位病变和非生殖细胞肿瘤全切后一般效果显著。而对于黏连紧密的肿瘤可在保证安全的前提下次全切,以保护深部的静脉结构和脑干的软脑膜。
术前存在脑积水可行脑室外引流或三脑室底造瘘术。
后颅窝手术时,对于重度肥胖的患者,因颈部较短,手术体位选择坐位可能更好。这种体位有助于通气和颅内静脉回流,而这些优势在肥胖患者取侧俯卧位时均无法体现。当然,取坐位时应该在术前做好充分的准备以避免和处理术中发生静脉空气栓塞。笔者在松果体区的手术中不常规使用神经生理监测。
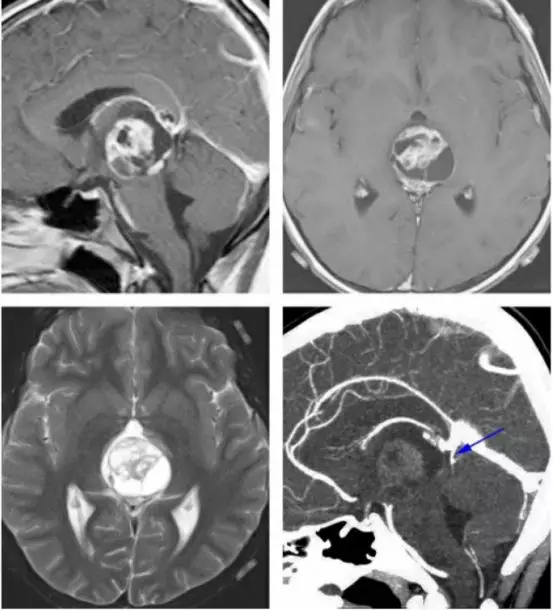
图4. 对于有些患者,术前仔细评估深部静脉系统是有好处的。如图所示为一例未成熟畸胎瘤患者,术前CT血管成像提示大脑大静脉及其属支位于肿瘤后方(蓝色箭头)。这种静脉结构使得我们不能采用显露更好的小脑上入路,而枕部经天幕入路更为合适。
手术解剖
松果体位于脑部中央,位置深,好在松果体区肿瘤和邻近的解剖结构之间通常能建立一个相对清楚的手术边界。
这些邻近解剖结构为后连合、胼胝体和缰连合。大脑内静脉与基底静脉汇合成大脑大静脉,最终汇入直窦。松果体区肿瘤一般由脉络膜后内侧动脉和脉络膜后外侧动脉(lateral posterior choroidal artery,LPChA)的分支供血,而这些供血动脉与胼周动脉、大脑后动脉、小脑上动脉以及四叠体动脉有多重吻合。
有多种手术入路可进入松果体区,其中主要的入路可分为幕上和幕下入路两类。这些入路将在Selection of Operative Corridor章节进行讨论。
幕下入路包括幕下小脑上中线入路和幕下小脑上旁正中入路。幕上入路则包括枕部经天幕入路、经半球间-胼胝体入路和皮层造瘘-经脑室入路。
幕上入路一般限于以下3种情况:肿瘤体积较大且主要向幕上生长、肿瘤向侧方生长侵犯侧脑室三角区、大脑深部静脉阻挡使幕下入路受限制。除非以上几种情况,否则笔者几乎均采用幕下入路,因为这种入路损伤更小。
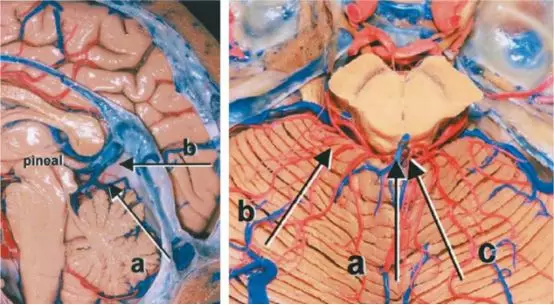
图5. 本图总结了松果体区的几种典型的手术入路。左图a所示为幕下小脑上入路,b所示为枕部经天幕入路;右图a所示为最常用的幕下小脑上中线入路,而笔者更青睐于b所示的旁正中入路,c所示为枕部经天幕入路(图片来自AL Rhoton,Jr)。
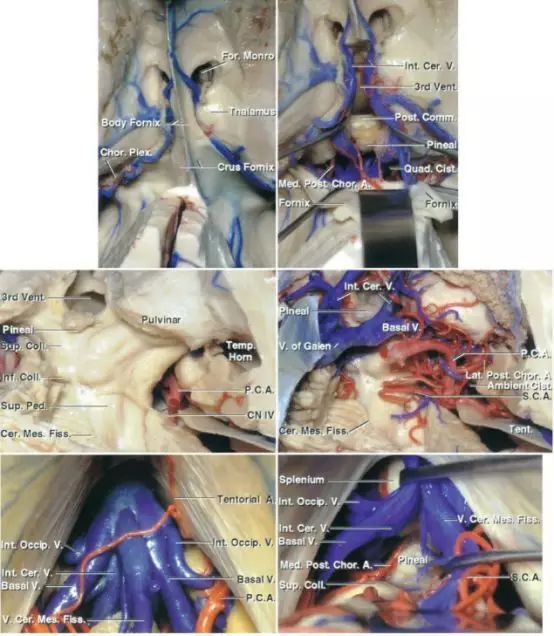
图6. 图示为幕下小脑上中线入路和枕部经天幕入路进入松果体区和三脑室后部的比较。第1排为侧脑室解剖与松果体区的关系(上面观),注意穹隆体部的位置和静脉解剖(右图穹隆被向后牵拉);第2排为枕部经天幕入路显露血管解剖和滑车神经的位置;第3排为幕下小脑上中线入路显露的静脉结构,包括枕内静脉、基底静脉、大脑内静脉和小脑中脑裂静脉(图片来自AL Rhoton,Jr)。

图7. 图示为松果体区周围结构的解剖关系。小脑上中线入路手术视野局限于小脑山顶附近,相比之下旁正中入路可到达小脑幕面外侧的下坡。滑车神经通常作为手术操作范围的下界。第3排所示为重要的动脉和静脉(图片来自AL Rhoton,Jr)。
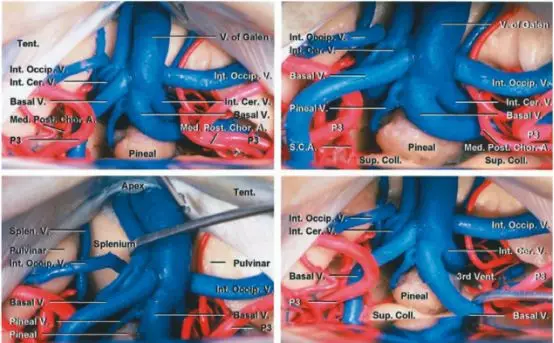
图8. 图示为幕下小脑上中线入路的手术视野,可见汇入大脑大静脉的相关静脉复合体,包括枕内静脉、基底静脉、大脑内静脉和小脑中脑裂静脉。(下排左图)推开大脑大静脉可见胼胝体压部,丘脑枕为手术野的外侧缘。松果体区病变通常位于这些深部静脉的前方或背侧,但也并非总是如此(图片来自AL Rhoton,Jr)。
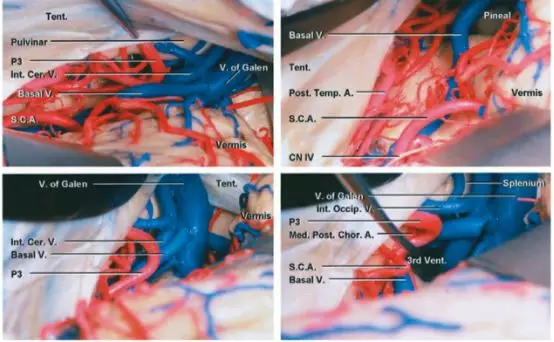
图9. 左侧幕下小脑上旁正中入路显露松果体区(图片来自AL Rhoton,Jr)。该入路能更方便地到达正中的松果体区,将在Paramedian Supracerebellar Craniotomy章节详述。
幕下小脑上入路切除松果体区肿瘤
松果体区位置深在,周围血管丰富,给手术带来了挑战。在Selectionof Operative Corridor章节将会进一步讨论该区域的一些手术入路。
开颅手术
下面讨论幕下小脑上中线入路的部分手术步骤,因为该入路使用最普遍,大部分神经外科医师更为熟悉。欲了解更详细的手术步骤,请阅读midline supracerebellar craniotomy章节。但请注意,笔者对于松果体区占位,不论肿瘤大小,均常规采用小脑上旁正中入路。
幕下小脑上中线入路硬膜下操作步骤
在将小脑向下松动的过程中,需牺牲一根或两根向中线部位引流的桥静脉,可能会导致小脑静脉淤血,从而影响暴露,应当尽量减少(桥静脉的牺牲)。
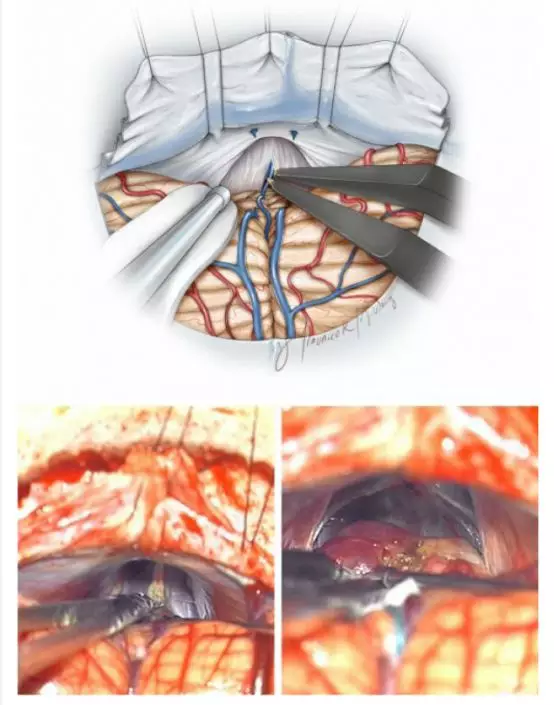
图10. 汇入上蚓静脉的小脑前中央静脉可安全离断(顶部素描图);这条静脉从小脑蚓部的前方走行,最终汇入大脑大静脉(译者注:通过上蚓静脉汇入或直接汇入大脑大静脉)。其他更靠前的间脑静脉则应保留。小脑前中央静脉有一层薄薄的蛛网膜包裹(下排术中图片,左);随着小脑上方蛛网膜带的松解,小脑缓慢下移,暴露松果体区和肿瘤(下排术中图片,右)。

图11. 在分离小脑上方的过程中,沿着天幕正中进入松果体区,前方正对大脑大静脉和胼胝体压部。此时,笔者会重新调整显微镜视角,将手术视野移向下方或背侧,从而避免在间脑的静脉汇合处周围盲目地分离。
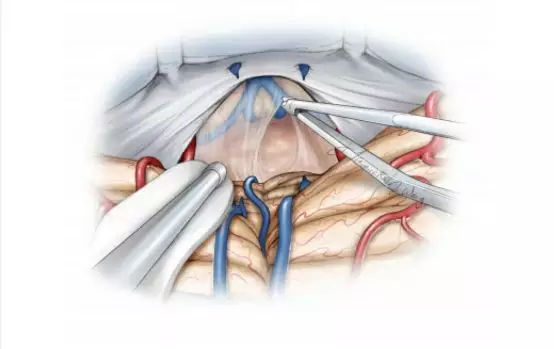
图12. 手术视角进一步下移。通过手持吸引器动态牵拉,推开小脑山顶,完全暴露肿瘤,这样能将固定牵拉造成的周围组织损伤最小化。松解覆盖肿瘤后方包膜的蛛网膜,此时,深部静脉通常并不出现,因为他们在背侧和外侧。如果没有对深部静脉进行术前评估,需注意大脑大静脉可能偶尔在肿瘤包膜后方或包膜内,术者应当对这些静脉保持警惕。

图13. 接下来就遵循肿瘤显微切除的基本原则,即囊内减压、阻断供血,然后进行包膜外切除。可对肿瘤包膜电凝止血,取几块体积较大的组织送病检,因为该部位的肿瘤种类多,再加上没有可靠的术前诊断方法,在肿瘤全切之前,需要病理科医师准确的分析术中病理,而冰冻切片结果在我们尝试积极切除肿瘤之前是至关重要的。
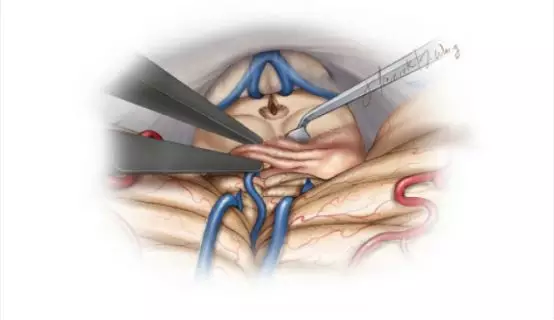
图14. 对肿瘤适当减压后,开始分离包膜,首先从顶盖区向侧方分离,再从小脑山顶前方向下分离,最后从大脑大静脉及其属支向上方分离。如果可能的话,丘脑枕的软脑膜应尽量保留。若静脉被肿瘤包裹,则需采取相对保守的方式,即残留少量肿瘤以避免静脉损伤。肿瘤切除后,三脑室清晰可见(图片由Tew,van Loveren,Keller重绘)。
在其他良性的可切除的肿瘤手术时,如果顶盖区的软脑膜损伤不可避免的话,笔者会以顶盖区的轻微损伤作为代价继续全切肿瘤,这样会导致患者发生暂时性的Perinaud综合征,一般会在术后1个月内缓解。
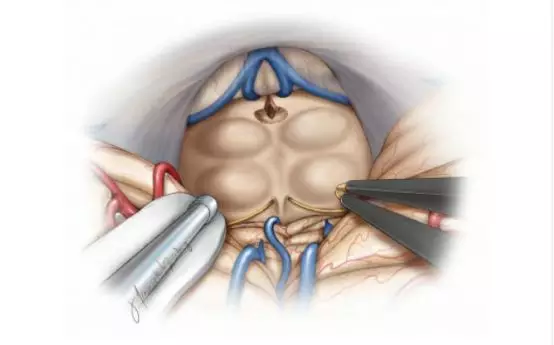
图15. 病变切除后,显示被压迫的正常组织。滑车神经及包绕它的蛛网膜与肿瘤下极的包膜粘连紧密,这层蛛网膜需小心地处理以使肿瘤与神经松开(图片由Tew,van Loveren,Keller重绘)。
单侧旁正中小脑上入路
对于绝大部分松果体区肿瘤,笔者青睐于幕下小脑上(左侧)旁正中入路,这条入路通过沿着小脑幕面的下坡从侧方到达松果体区,提供了宽阔的手术通道,相对正中入路沿着小脑山顶进入,该入路能够触及位置更靠下方的肿瘤。
相对中线入路,该入路到达松果体区需离断的桥静脉更少,而且,从小脑幕面侧方的下坡进入可减少对小脑的强制性和固定牵拉。基于斜线的手术通道,使得对肿瘤对侧部分的显露充分许多,对于大型松果体区肿瘤的全切也更为轻松。但有时肿瘤与周围神经血管结构纤维性粘连,使切除程度受限。
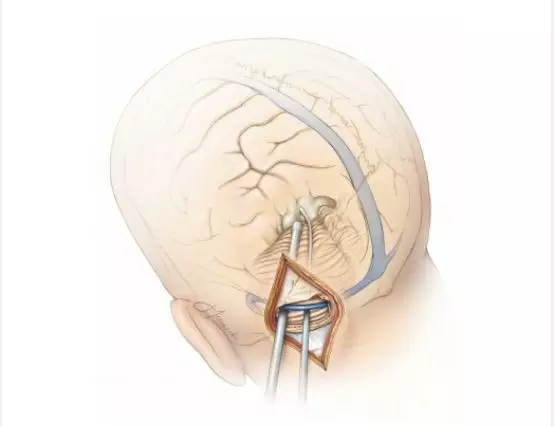
图16. 图示为幕下小脑上(左侧)旁正中入路进入松果体区的手术通道。为了联合幕上入路,天幕可能被切开。但是这种间接的手术通道可能会使术者迷失方向。
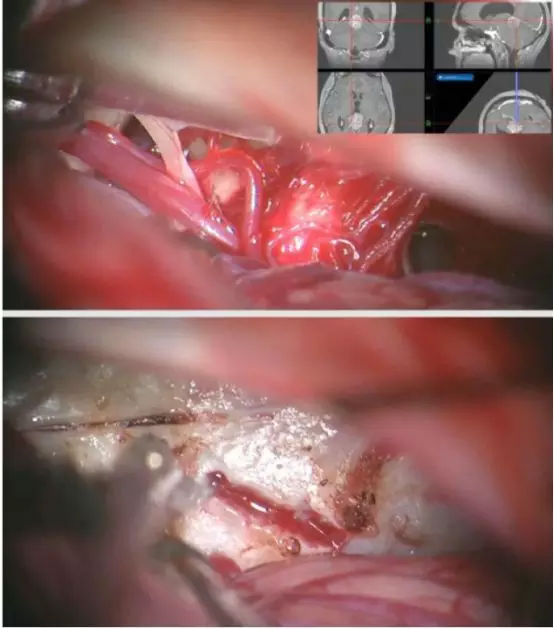
图17. 图示为幕下小脑上(左侧)旁正中入路切除一例松果体母细胞瘤。注意上图左侧的滑车神经,小脑上动脉的分支被推开。下图所示旁正中入路显露肿瘤后极的包膜。
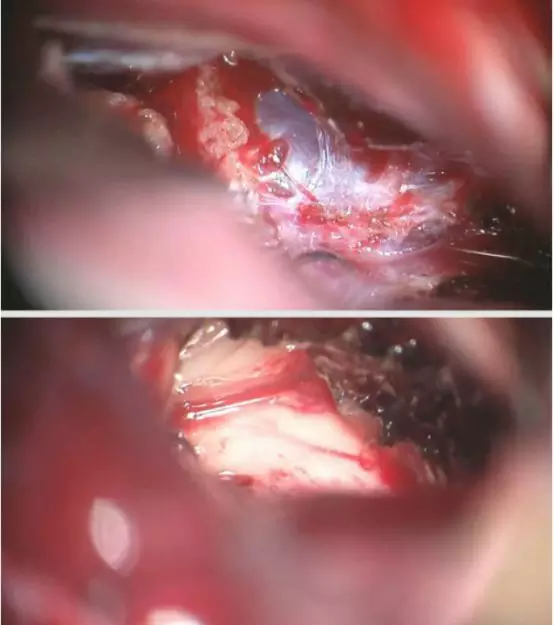
图18. 大脑大静脉被肿瘤包裹,静脉周围残留少许肿瘤(上图)。肿瘤切除后显露三脑室壁。在旁正中入路中需注意三脑室的定位。
其他注意事项
再怎么强调细心保护深部静脉的重要性也不为过。大脑大静脉可能位于肿瘤的尾部或后方,因此,在小脑上入路中暴露肿瘤时损伤它的风险很大。
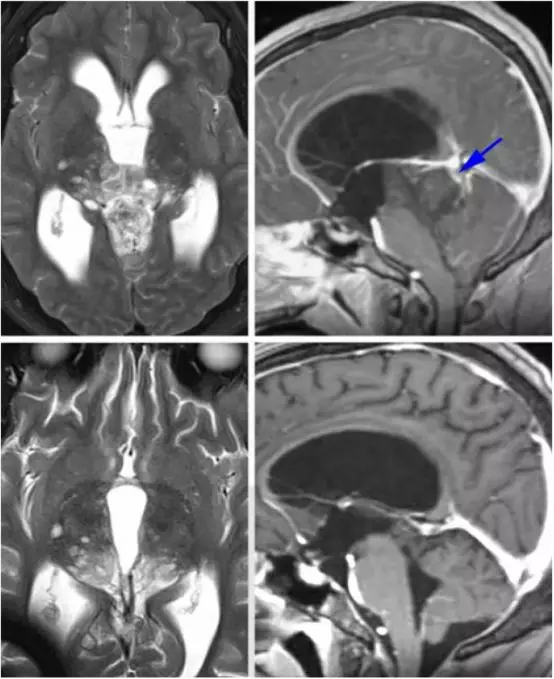
图19. 这是一例顶盖区的低级别星形细胞瘤(上图),术前影像提示大脑大静脉在肿瘤后方(上图,右,蓝色箭头所指)。尽管笔者术中在处理肿瘤时保持对寻找该静脉的高度警惕,但仍然差点损伤它,因为它嵌入了肿瘤中。术后影像(下图)提示肿瘤次全切,这点如术前计划的一样,肿瘤在丘脑内的部分残留。该病例也再次强调了仔细分析术前影像的重要性。
关颅
肿瘤切除后,彻底止血,三脑室内的血块必须清除。松解掀开的硬膜,如果可以的话,予原位缝合。必要时,取一块硬脑膜替代物缝合或覆盖在缺损处。建议硬膜水密缝合。
术后注意事项
术后患者在重症监护室观察24-48小时,需仔细且勤快地进行神经系统查体。由于涉及脑干的操作,患者暂时性的昏迷并不罕见。
部分患者术后出现眼球运动障碍,尤其是上视和会聚不能,尽管这些症状通常是一过性的,在数天或数周内消失。这些并发症更常见于在术前症状进行性加重、术前接受过放疗和侵袭性肿瘤的患者。
术后前几天常规使用激素,然后逐渐减量。如果患者做了脑室外引流而不是永久性的分流,那么可在术后引流48-72小时;如果直到引流管夹闭仍存在梗阻性脑积水,那么该患者很可能需要行永久性的脑脊液分流,手术方式选择内镜下三脑室底造瘘更为适宜。
后颅窝手术可导致化学性脑膜炎,可能出现难治性进行性加重的头痛、严重的恶心、呕吐、头晕和颈项强直。化学性脑膜炎通常为自限性的,必要时可使用激素治疗。
术后72小时内行MRI增强扫描以评估肿瘤切除程度。对于确诊为恶性生殖细胞肿瘤或室管膜瘤的患者,需行脊髓MRI以检查是否存在脊髓种植转移。有些医师选择将脊髓MRI检查延后,因为术后残留物质和血块可能会引起类似脊髓转移的影像表现。
对于恶性生殖细胞肿瘤或松果体细胞瘤的患者,术后需进行放疗,总剂量为5500cGy,每天180cGy,脑室系统给予4000cGy,瘤床给予1500cGy。生殖细胞瘤是对放疗最敏感的恶性肿瘤,90%的患者均能得到肿瘤控制。如果肿瘤全切同时病理证实为良性松果体母细胞瘤或室管膜瘤,则无需放疗。目前,对于恶性松果体区肿瘤,不推荐预防性脊髓放疗。如果MRI证实存在脊髓种植转移,则推荐剂量为3500cGy的脊髓放疗。
对于恶性的非生殖细胞瘤的生殖细胞肿瘤,化疗被认为是有帮助的。通常可选择睾丸癌的化疗方案,如Einhorn方案,即顺铂+长春花碱+博来霉素+环磷酰胺或依托泊苷。为了减少长春花碱和博来霉素的肺毒性,依托泊苷联合顺铂或卡铂可提高反应率。
点睛之笔
松果体区肿瘤术前应当仔细评估手术指征,可以非手术治疗的肿瘤则不考虑手术。
幕下小脑上旁正中入路仅需暴露一侧的横窦,而无需暴露窦汇区,减少了术中窦损伤的风险,同时也可减少小脑上方桥静脉的牺牲。
(编译:冯亮;审校:徐涛)
*Redrawn with permission from Tew JM, van Loveren HR, Keller JT. Atlas of Operative Microneurosurgery, WB Saunders, 2001. © Mayfield Clinic
DOI: https://doi.org/10.18791/nsatlas.v5.ch07.2
中文版链接:https://www.medtion.com/atlas/2303.jspx
参考文献
Al-Mefty O. Operative Atlas of Meningiomas. Philadelphia: Lippincott-Raven, 1998.
Bruce JN. Pineal tumors, in Winn HR, Berger MS, Dacey RG (eds): Youmans Neurological Surgery, 6th ed. Philadelphia: Saunders; 2011:1359.
Dandy WE. An operation for the removal of pineal tumors. Surg Gynecol Obstet. 1921; 33:113.
Ellis J, Moise G, Bruce J. Meningiomas of the third ventricle and pineal region, in Demonte F, McDermott M, Al-Mefty O (eds): Al-Mefty’s Meningiomas, 2nd ed. New York: Thieme; 2011:323
Krause F. Operative frielegung der vierhugel, nebst beobachtungen uber hirndruck und dekompression. Zentrabl Chir. 1926;53:2812.
Oppenheim H, Krause F. Operative erfolge bei geschwulsten der sehhugelund vierbugelgegend. Berl Klin Wochenshr. 1913; 50:2316
Parker J, Waziri A. Preoperative evaluation of pineal tumors. Neurosurg Clin N Am 2011; 22:353-358.
Rhoton AL Jr. The tentorial incisura. Neurosurgery 2000; 47(Suppl 3):93-129.
Shinoda J, Yamada H, Sakai N, Ando T, Hirata T, MiwaY. Placental alkaline phosphatase as a tumor marker for primary intracranial germinoma. J Neurosurg. 1988;68:710-720.
Stein BM. The infratentorial supracerebellar approach to pineal lesions. J Neurosurg. 1971;35:197-202.




