今天为大家分享的是由王小峰医师编译,《神外资讯》常务编辑、海军军医大学附属长征医院神经外科徐涛医师审校的:额叶癫痫手术策略及技巧,欢迎观看、阅读。
北美地区癫痫疾病的估计患病率为5-10例/1000人,其中约1/3的癫痫患者无法通过药物有效控制发作或无法耐受药物副作用。大量的证据表明,与同龄健康人群相比,无法控制的癫痫发作会使患者认知功能受损、综合生活质量降低及死亡率增加。
药物干预是治疗癫痫的第一步。尽管目前已有多种抗癫痫药物,但对于多达三分之一的患者仍然无法做到完全控制。对于药物治疗效果不佳的患者,应评估是否适合手术。约5%-10%的患者无法控制癫痫发作,相当于在美国有100000名潜在的手术患者,且每年以约5000-10000例的速度增加;但实际上仅有一小部分患者经过完整的术前评估后,最终接受癫痫手术治疗。
对于药物难治性癫痫患者来说, 每一次加药或加量时的有效概率并不会得到相应增加。第一次尝试使用抗癫痫药(AED)的成功率是70%,如果第一次尝试失败,加药后的成功率会下降到40%。另外,应用三种或多种药物治疗的患者有效率差异十分微弱,几乎不太可能有效控制癫痫发作,且往往会产生AEDs的诸多副作用。
在过去的几十年中,由于影像学和脑电图(EEG)技术(特别是侵入性颅内电极监测)的进步,在传统颞叶手术以外的癫痫术式发展迅猛。
此外,大量研究详细描述了适合手术治疗的癫痫病症,其长期预后已得到肯定。本章概述了颞叶以外的癫痫,更具体说是额叶癫痫(FLE)的具体诊断、术前评估及笔者所采用手术路径、策略技巧及预后。
额叶癫痫的诊断和评估
病史和查体
全面的术前评估包括详细询问病史和体格检查,癫痫发作的具体症状表现、病史、家族史,以及关于抗癫痫药物的应用细节等都应包括在内。因为患者可能无法完整回忆发作经过,往往需要询问在场目睹发作过程的家属或朋友。完成一套完整的神经系统查体,同时再与病史相结合,可能有助于识别和定位癫痫的部位。
额叶癫痫的一般特征包括:明显的运动症状,迅速继发全面性发作,局部肌阵挛(伴或不伴进展性),显著的不对称性强直姿态,复杂或奇异的自主性运动,爆发性发作起始和突然性停止且不伴发作后思维混乱,成簇的频繁/短暂发作,以及所有类型都可能出现的癫痫持续状态。
目前已有一些临床公认的额叶癫痫发作类型,包括辅助运动区发作、扣带回发作、前额极区发作、眶额区发作、背外侧部发作、岛盖发作、以及运动皮质发作。
尽管上述分类对于定位有意义,但由于异常放电快速传播,不同起源的癫痫发作类型通常会表现为非典型性和重叠性的临床表现。因此,如果没有脑电图或影像相关证据,就很难确定癫痫发作的具体部位。此外,即使临床表现符合额叶发作的临床特征,也可能是由大脑的其他区域放电迅速迁延至额叶引起的。
尽管很难将一些突发症状限定为额叶癫痫发作的标志,但仍有一些趋势可以帮助定位(发病区域)。全身性的强直阵挛性抽搐通常与涉及额叶背外侧部癫痫相关;如果癫痫发作呈不对称强直发作表现,那么可牵涉到辅助运动区或内侧额叶区;存在失神发作成分则牵涉扣带回和内侧额叶;运动性和阵发性癫痫发作通常起于环Rolandic岛盖区;而所有额叶癫痫的发作类型中都可能出现突发动作中止。
发作间期脑电图表现
额叶癫痫可在脑电图上呈现复杂而广泛的痫性异常放电波。发作间期脑电图在确定发作的解剖起始区时十分有用,但在额叶癫痫的应用比颞叶癫痫局限。
约70%的额叶癫痫患者有间期放电,但大多数都呈普遍性、多灶性或局灶化不明确。此外,大部分额叶皮质都无法进入常规的脑电图记录中;还有一部分皮质在颅外电极上无法监测,如眶、半球间及扣带回皮层。
许多额叶癫痫的患者可能表现出区域性和多脑叶分布的发作性波形,这可能是由于在额颞叶之间通过钩束和扣带链接形成功能网络及通路。因此,单侧额叶癫痫发作的患者可能表现出双侧额叶或全面性电波活动。尽管额叶癫痫的EEG定位很多不足之处,但与现代影像成像技术及视频脑电图相结合时,对药物性难治性癫痫患者的初步评估往往很有帮助。
视频脑电图
为评估是否可行手术,患者需连接癫痫监测装置,包括持续头皮EEG和视频监控。临床发作表现与发作间期、发作期之间的相关性有助于定位癫痫病灶。
一些刺激措施可用于诱发癫痫性电活动,如减少药物、剥夺睡眠和过度换气等。如果头皮EEG不能确定致痫灶,可利用侵入性脑电监测(颅内监测)协助定位。
磁共振成像
磁共振成像(MRI)已被确定为寻找可行手术切除的致痫灶(病灶性癫痫)的最佳诊断方法。
约30%的癫痫患者存在解剖结构上的致痫灶,可通过脑电图记录来局部定位。一些相对新的MRI技术,如快速流体衰减反转恢复成像序列(FLAIR)和高分辨率空间重建及体积脉冲序列,可以识别适合外科切除的小/细微病变,如肿瘤、动脉硬化/巨脑沟回畸形、某些感染、胶质细胞增生、弥漫性萎缩进展、灰质异位、错构瘤和皮质发育不良等,而传统的核磁共振成像技术很容易会忽略皮质发育不良的细微病灶。
多达80%-90%的具有局灶性致痫灶的额叶癫痫患者,手术预后良好。 Mosewich等发现,71%的病灶性FLE患者和41%的非病灶性FLE患者从良好的手术效果中获益,这一事实实际上提出了一个重大的手术策略问题和挑战,因为约有40%-50%的FLE患者为非病灶性癫痫。
正电子放射断层成像
正电子放射断层成像(PET)利用与代谢活动相关的放射性同位素记录身体各部位代谢活动,进而分析其功能。针对FLE,PET试图明确发作间期额叶中的低代谢区域。PET成像过程中的EEG监测,能确定一侧半球低代谢并非继发于对侧癫痫活跃灶引起过度代谢。
由于神经胶质组织中氟脱氧葡萄糖(FDG)吸收减少,发作间期使用PET寻找胶质组织比MRI敏感性更高。然而,神经胶质组织并不局限于致痫灶。在PET上发现的低代谢的患者中,只有不到一半表现出与异常脑电图病灶一致。癫痫患者PET上的低代谢常分布广泛且定位不佳。总的来说,对于FLE患者,PET成像并不能比MRI提供出更多的有用临床信息。
单光子发射计算机断层成像
癫痫发作时,脑组织代谢需求增加,脑血流量随之增加。单光子发射计算机断层成像(SPECT)应用锝-99m六甲基丙烯胺肟或比西酸锝(99mTc)检测局部脑灌注。
这些化合物在注射后几秒钟内可被神经细胞吸收,并在细胞内停留数小时。因此,发作后立即注射放射性示踪剂,可助于定位癫痫发作起始区。若能将癫痫患者行发作间期与发作期的脑灌注进行比较,SPECT检查的敏感性会大大提高。另外,如果再结合高分辨率MRI,有助于识别致痫灶。在MRI和/或EEG不能定位病灶时,常选用SPECT检查。
侵入性脑电监测(颅内监测)
在许多额叶癫痫患者中,头皮EEG、MRI、PET和SPECT可能无法确定致痫灶,或者提供的数据相矛盾。对于这样的病例,若对于致痫灶的位置有明确的指向性假设,应采取进一步的侵入性操作,如应用硬膜外、硬膜下或者脑实质内电极片或电极条进行长程EEG监测(颅内监测),详见《颅内监测》章节。
非侵入性检查常可将癫痫灶定位于一侧半球。应用侵入性监测时应谨慎,因为此操作存在1%的严重并发症风险,例如脑膜炎、骨瓣坏死、硬膜下血肿、脑内血肿甚至脑疝。
硬膜下电极条监测可通过颅骨钻孔放置,这种方法比应用硬膜下电极监测网创伤小,后者需要开颅放入。在电极监测网置入之前,应用电极条监测可为定致痫灶侧别提供帮助。电极监测网放置于大面积皮层表面,并且包括两半球间隙,以便对额叶皮层进行全面评估,并为确定皮质定位图创造条件。
功能核磁共振成像
功能核磁共振成像(fMRI)通过测量由血氧水平变化引起的MRI信号变化来测定神经细胞活性,主要用于功能区的定位,如运动区和语言区。另外,fMRI可以结合EEG分析来识别刺激区和发作区。作为一种较新的影像成像方式,只有少数研究将fMRI与手术结果相关联,并主要集中于颞叶癫痫外科领域。有必要行进一步研究以阐明fMRI在额叶癫痫外科中的作用。
手术指征
对难治性癫痫的患者,可考虑进行综合癫痫手术评估。手术指征主要包括:
(1)能准确诊断发作类型及癫痫综合征;
(2)已合理联合使用至少两种AEDs,但仍不能良好控制发作;
(3)无癫痫手术禁忌的内科合并症。
控制癫痫发作必然能大大改善患者的生活质量。以下内容可在术前预测癫痫术后效果良好,包括:
(1)MRI清楚的显示病变范围且为局限性病灶;
(2)EEG能精确定位者;
(3)有额叶癫痫的特异性症状者;
(4)临床表现、EEG和MRI结果之间无相互矛盾;
(5)病灶不涉及功能区的、且操作简单;
(6)不存在其他致痫病变(如硬膜病变)。
术前准备
围手术期准备和麻醉药物可导致抗癫痫血药浓度水平下降,这将导致病人在术后有癫痫发作的风险。因此在围手术期建议使用超治疗量的抗癫痫药物,因为术后癫痫发作可使患者恢复变得更为复杂。
笔者不应用术中皮层脑电图来引导皮层或海马的切除范围。如果对致痫灶存在疑问,颅内监测能够更有效地引导术者。
手术解剖
额叶的解剖相对简单,并且为大多数外科医师所熟悉。

图1. 显示的是冠状缝与其下方的额叶解剖关系。冠状缝以前的矢状窦旁静脉相对不重要。脑叶切除的范围不能达冠状缝后,因为冠缝后3cm处为皮质运动区(感谢AL Rhoton, Jr教授授权使用)。

图2. 当切开半球内侧或半球间脑叶时,应保护好胼缘及胼周动脉。软脑膜下切除可保护这些重要组织及血管。
额叶切除术
下面将展示的是标准额叶切除术的手术操作细节:

图3. 上图虚线为脑叶切开的斜形界线。此线起于冠状缝,止于前颅窝底。切除路径应始终保持在胼胝体前。

图4. 此为示意图,展示了额叶切除的后界与侧脑室额角、蝶骨翼的解剖关系。横断面包含冠状缝(顶)和蝶骨翼外侧,此平面止于前床突。值得注意的是,额叶切除的外侧缘应与蝶骨翼外侧位于同一线上(底)。

图5. 固定头架,颈部略屈曲以利于颅内静脉回流。标记出双侧冠状切口(Soutar切口)的3/4长度和骨瓣切开的范围,骨瓣内侧缘位于上矢状窦,这一入路在切除额叶时可进入前纵裂探及大脑前动脉,骨瓣的后缘是冠状缝,仅在骨窗后缘钻单孔就足够。需要注意的是骨瓣的前缘不要求平前颅底,且避免打开额窦。

图6. 展示单骨孔及骨瓣切开的位置。笔者通常最后切开静脉窦上的颅骨,但因为本组病人无颅内压迫性病变,上矢状窦的前部能轻松地从颅骨内侧面分离开,窦不易被铣刀座损伤。骨瓣的外侧应扩展至颞上线,颞肌只需部分牵开。

图7. 弧形切开硬膜,并以硬膜窦为基底翻折。在大脑镰上部悬吊两针,如此可将上矢状窦向内侧轻轻拉开,以利于更好的解剖分离纵裂。注意标出的皮质表面切开虚线。这时,如果手术目的仅为放置颅内监测电极,将电极监测条或监测网置入后即可关颅。

图8. 显示的是切开后部皮质,并进入白质。将双极镊用作剪刀来切开白质束。前组矢状窦旁引流静脉已被切断。
额叶切除术可以采取两步法:首先,切开额叶外侧皮质,然后绕胼胝体和扣带回前部切除内侧额叶。保留眶后部皮质以避免出现行为障碍。如有需要可使用术中影像引导操作。
在额叶的切除过程中,笔者时刻牢记上述的解剖标志,将白质斜切平面朝向蝶骨翼扩展。如情况允许,应避免打开侧脑室额角,电凝切开额叶内侧软脑膜,在达扣带之前可继续软脑膜下切除,这样会减少损伤大脑前动脉分支的风险。

图9. 显示了软脑膜下切除脑组织的技术。这一重要手术技术常常应用在癫痫外科,可保护软脑膜及过路动脉。将软脑膜切开至扣带回水平(上图),用双极镊夹碎脑回,然后用吸引器在软膜下吸走脑组织碎块。应用这一方法来完成额叶内侧切除。
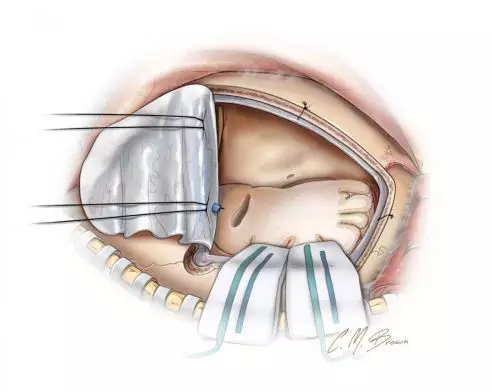
图10. 显示的是最终切除结果。如果不慎进入侧脑室额角,应认真冲洗干净。
术后注意事项
患者应在重症监护病房观察过夜。术后短期内的发作并不影响癫痫发作的远期缓解率,在此方面患者本人及家属可安心。单次的癫痫全面性发作无需过分处理,如发生二次癫痫发作,可适当调整AEDs剂量。
点睛之笔
在切除额叶时,冠状缝和蝶骨翼是非常有用的解剖标志。
软脑膜下切除可避免损伤胼周、胼缘动脉。
(编译:王小峰;审校:徐涛)
Contributor: Stephen Mendenhall, MD
DOI: https://doi.org/10.18791/nsatlas.v7.ch03.1
中文版链接:https://www.medtion.com/atlas/2320.jspx
参考文献
Bancaud J, Talairach J. Frontal lobe seizures and epilepsies, in Chauvel P, Delgado-Escueta AV, Halgren E, Bancaud J (eds): Advances in Neurology Frontal Lobe Seizures and Epilepsies, New York: Raven, 1992, 3-58.
Boon PA, Williamson PD, Fried I, et al. Intracranial, intraaxial, space-occupying lesions in patients with intractable partial seizures: an anatomoclinical, neuropsychological, and surgical correlation. Epilepsia. 1991;32:467-476.
Camfield PR, Camfield CS. Antiepileptic drug therapy: when is epilepsy truly intractable? Epilepsia. 1996;37 Suppl 1:S60-65.
Cockerell OC, Johnson AL, Sander JW, Hart YM, Shorvon SD. Remission of epilepsy: results from the National General Practice Study of Epilepsy. Lancet 1995;346:140-144.
Dasheiff RM, McNamara D, Dickinson L. Efficacy of second line antiepileptic drugs in the treatment of patients with medically refractive complex partial seizures. Epilepsia. 1986;27:124-127.
Engle J Jr, Shewmon DA. Overview: who should be considered a surgical candidate, in Engle J Jr (ed): Surgical Treatment of the Epilepsies, 2nd ed, New York: Raven, 1993, 23-34.
Heinz R, Ferris N, Lee EK, et al. MR and positron emission tomography in the diagnosis of surgically correctable temporal lobe epilepsy. AJNR Am J Neuroradiol. 1994;15:1341-1348.
Helmstaedter C, Kurthen M, Lux S, Reuber M, Elger CE. Chronic epilepsy and cognition: a longitudinal study in temporal lobe epilepsy. Ann Neurol. 2003;54:425-432.
Hermanns G, Noachtar S, Tuxhorn I, Holthausen H, Ebner A, Wolf P. Systematic testing of medical intractability for carbamazepine, phenytoin, and phenobarbital or primidone in monotherapy for patients considered for epilepsy surgery. Epilepsia. 1996;37:675-679.
Kwan P, Brodie MJ. Early identification of refractory epilepsy. N Engl J Med. 2000;342:314-319.
Ludwig B, Marsan CA, Van Buren J. Cerebral seizures of probable orbitofrontal origin. Epilepsia. 1975;16:141-158.
Ludwig BI, Marsan CA, Van Buren J. Depth and direct cortical recording in seizure disorders of extratemporal origin. Neurology. 1976;26:1085-1099.
Mirsattari SM, Ives JR, Leung LS, Menon RS. EEG monitoring during functional MRI in animal models. Epilepsia. 2007;48 Suppl 4:37-46.
Mohanraj R, Brodie MJ. Diagnosing refractory epilepsy: response to sequential treatment schedules. Eur J Neurol. 2006;13:277-282.
Mosewich RK, So EL, O'Brien TJ, et al. Factors predictive of the outcome of frontal lobe epilepsy surgery. Epilepsia. 2000;41:843-849.
Ojemann LM, Dodrill CB. Natural history of drug resistant seizures: clinical aspects. Epilepsy Res Suppl. 1992;5:13-17.
Proposal for revised classification of epilepsies and epileptic syndromes. Commission on Classification and Terminology of the International League Against Epilepsy. Epilepsia. 1989;30:389-399.
Quesney LF CM, Rasmussen T, Olivier A, Palmini A. Presurgical EEG investigation in frontal lobe epilepsy. Amsterdam: Elsevier, 1992.
Quesney LF, Olivier A. Pre-operative EEG evaluation in frontal lobe epilepsy. Acta Neurol Scand Suppl. 1988;117:61-72.
Schmidt D, Richter K. Alternative single anticonvulsant drug therapy for refractory epilepsy. Ann Neurol. 1986;19:85-87.
So EL. Integration of EEG, MRI, and SPECT in localizing the seizure focus for epilepsy surgery. Epilepsia. 2000;41 Suppl 3:S48-54.
Spanaki MV, Spencer SS, Corsi M, MacMullan J, Seibyl J, Zubal IG. Sensitivity and specificity of quantitative difference SPECT analysis in seizure localization. J Nucl Med. 1999;40:730-6.
Spencer SS. The relative contributions of MRI, SPECT, and PET imaging in epilepsy. Epilepsia. 1994;35 Suppl 6:S72-89.
Surgery for epilepsy: summary of a consensus statement. CMAJ. 1991;144:145-146.
Walczak TS, Leppik IE, D'Amelio M, et al. Incidence and risk factors in sudden unexpected death in epilepsy: a prospective cohort study. Neurology. 2001;56:519-525.
Westerhuis W, Zijlmans M, Fischer K, van Andel J, Leijten FS. Coping style and quality of life in patients with epilepsy: a cross-sectional study. J Neurol. 2011;258:37-43.
Wetjen NM, Cohen-Gadol AA, Maher CO, Marsh WR, Meyer FB, Cascino GD. Frontal lobe epilepsy: diagnosis and surgical treatment. Neurosurg Rev. 2002;25:119-138; discussion 139-140.
Wiebe S, Bellhouse DR, Fallahay C, Eliasziw M. Burden of epilepsy: the Ontario Health Survey. Can J Neurol Sci. 1999;26:263-270.
Wiebe S, Blume WT, Girvin JP, Eliasziw M, Effectiveness, Efficiency of Surgery for Temporal Lobe Epilepsy Study Group. A randomized, controlled trial of surgery for temporal-lobe epilepsy. N Engl J Med. 2001;345:311-318.
Williamson PD, Spencer DD, Spencer SS, Novelly RA, Mattson RH. Complex partial status epilepticus: a depth-electrode study. Ann Neurol. 1985;18:647-654.
相关链接




