【Ref: Zhou W, et al. Cell Stem Cell. 2017 Nov 2;21(5):591-603.e4. doi: 10.1016/j.stem.2017.10.002.】
胶质母细胞瘤(GBM)是高度恶性的脑肿瘤,目前治疗的效果差。血脑屏障(blood-brainbarrier,BBB)对维持大脑正常功能十分重要,而血瘤屏障(brain-tumor barrier,BTB)能阻碍化疗药物进入肿瘤。有研究表明胶质瘤干细胞(GSCs)源性周细胞在维持肿瘤血管的屏障中起重要作用。美国克利夫兰医学中心Lerner研究所干细胞生物学和再生医学部的Wenchao Zhou等研究发现依鲁替尼(ibrutinib)可以通过作用于骨髓和X连锁非受体酪氨酸激酶(BMX),特异性破坏肿瘤血管外的GSC源性周细胞,从而促使化疗药物,如足叶乙甙(etoposide)进入肿瘤细胞,但不影响BBB;因此,可延长荷瘤小鼠的生存期。文章发表在2017年11月的《Cell Stem Cell》上。
该研究发现周细胞覆盖率低(LPC)的GBM患者化疗后总体生存期以及肿瘤无进展生存期显著高于周细胞覆盖率高(HPC)的GBM患者,提示周细胞覆盖与GBM患者的化疗效果相关。
作者建立DesPro-HsvTK转染的GSC脑GBM小鼠模型,通过给予更昔洛韦(GCV)调控靶基因,破坏GSC源性周细胞。结果发现,小分子物质对BTB的透过率显著提高,并且证实只有GSC源性周细胞的紧密连接受到破坏,才能提高化疗药物对BTB的通透性。然后,作者给予荷瘤小鼠GCV,在破坏部分GSC源性周细胞后,再应用化疗药物足叶乙甙。结果发现,足叶乙甙在肿瘤组织内浓度显著提高,小鼠移植瘤体积明显减小。同时免疫荧光染色提示GSC源性周细胞凋亡率显著上升。上述结果揭示靶向破坏GSC源性周细胞可以提高化疗药物对BTB的透过率,加强抗肿瘤的效果(图1)。
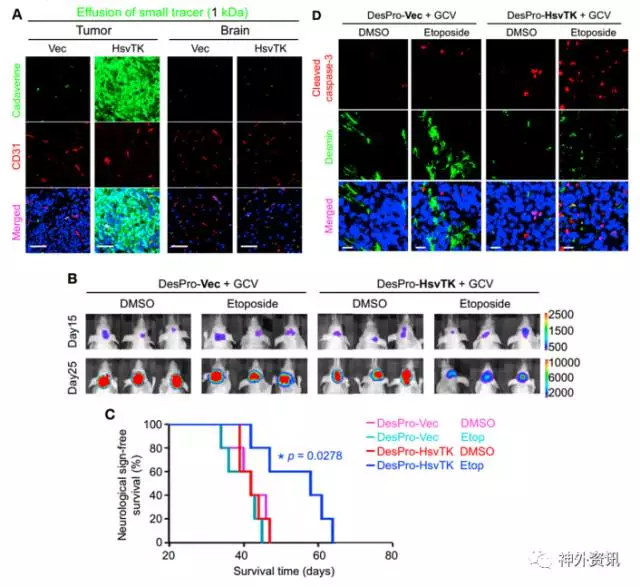
图1. A.免疫荧光分析BTB、BBB对Cadaverine的通透性;B.载瘤小鼠在GCV和Etoposide处理后颅内肿瘤生长的活体成像;C.荷瘤小鼠处理后生存分析;D.免疫荧光分析GCV和Etoposide处理后GSC源性周细胞凋亡。
作者进一步研究破坏GSC源性周细胞的药物靶点,发现BMX在GSCs和GSC源性周细胞内特异性高表达。在荷瘤小鼠上应用BMX/BTK抑制剂ibrutinib,GSC源性周细胞的紧密连接受到破坏,BTB通透性显著增高,细胞凋亡率上升。对荷瘤小鼠联合ibrutinib和etoposide用药,发现限制移植瘤生长,提高小鼠无神经功能障碍生存期的效果更显著(图2)。
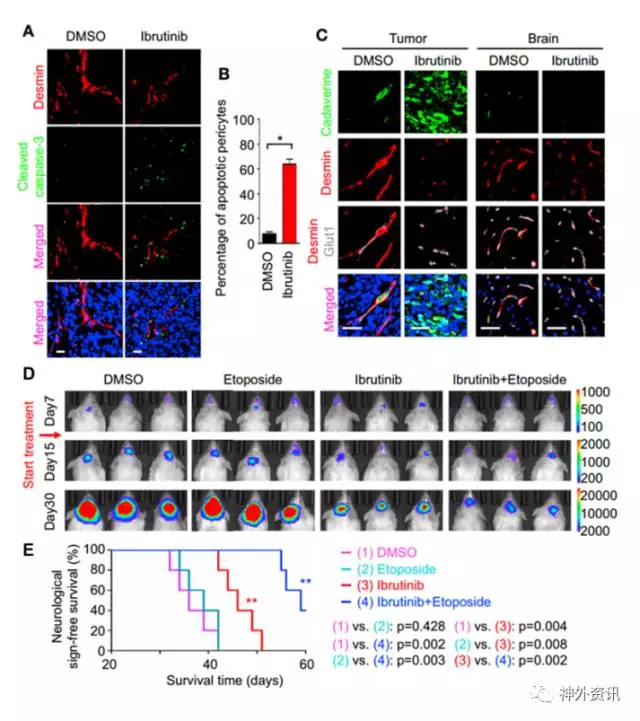
图2. A、B.免疫荧光及定量分析在ibrutinib处理后GSC源性周细胞的凋亡;C.免疫荧光分析在ibrutinib处理后BTB、BBB对Cadaverine的通透性;D.GBM小鼠在ibrutinib和Etoposide处理后颅内肿瘤生长活体成像;E.在ibrutinib和Etoposide处理后GBM小鼠生存分析。
综上所述,该研究揭示GSC源性周细胞在GBM化疗抵抗中的作用。同时,提出一种新的抗肿瘤治疗策略:通过靶向破坏GSC源性周细胞,提高BTB的通透性,可以增强化疗药物的抗肿瘤疗效。此外,该研究还提示BMX抑制剂ibrutinib在抗肿瘤治疗中的价值。
(中南大学湘雅医院潘邹编译,复旦大学附属华山医院花玮博士审校,《神外资讯》主编、复旦大学附属华山医院陈衔城教授终审)
相关链接



