今天为大家分享的是由上海交通大学医学院附属新华医院郑璇医师翻译,《神外资讯》常务编辑、海军军医大学附属长征医院神经外科徐涛医师审校的:岛叶肿瘤的手术策略与技巧(Insular Tumors),欢迎观看、阅读。
Insular Cavernous malformation-Principles
Dominant Insular glioma
Brain Mapping for Resection of Insular Gliomas- Lessons Learned
岛叶在调节内脏感觉运动、控制心血管交感活性、传入躯体感觉中均起重要作用。它也参与了痛觉的传递、运动规划、自主性吞咽、味觉、听觉、前庭功能、情绪、认知能力和语言能力。更多关于岛叶功能的信息请参考维基百科(Wikipedia)。
与其他部位的胶质瘤相比,岛叶胶质瘤在临床表现与生物学行为上比较特殊。这些肿瘤常起源于古皮层(allocortex)或中皮层(mesocortex)附近的白质。在它们生长的初级阶段,常累及新皮层(neocortices)、中央核及脑室。
因为岛叶解剖结构复杂,并覆盖有高级语言皮层、白质束及重要的血管结构,故岛叶部位的手术难度极大。随着显微外科、唤醒麻醉下皮层(及皮层下)定位、全身麻醉技术的进展,安全实施岛叶手术成为了可能。
诊断
旁边缘系统区域(paralimbic region)素来是胶质瘤的好发部位,岛叶就包括其中。25%的低级别胶质瘤与10%的高级别胶质瘤发生在此区域。岛叶胶质瘤的临床表现与它们的级别相关。
低级别胶质瘤即使长到很大体积也可能只引起轻微临床症状。最常见的临床表现是新发癫痫。岛叶癫痫的不同症状反映了其复杂的功能解剖。它可能类似于颞叶癫痫或起源于额叶的夜间过度运动性发作(nocturnal hypermotor epilepsy)。但以单纯部分发作最为常见,并伴随呼吸、内脏感觉、口消化道症状,可有面部感觉异常、喉头肌肉痉挛狭窄、味幻觉、发作后面瘫伴多涎、听幻觉及感觉性失语等等。
由于岛叶胶质瘤早期缺乏临床症状,因此发现时肿瘤往往已经长到较大体积,而患者常没有明显神经功能缺陷或仅有非特异性症状,如头痛乏力、轻度语言障碍及行为改变。
高级别胶质瘤则常导致周围血管源性脑水肿及组织浸润,造成局部及所处半球的占位效应,伴随感觉、运动及语言障碍。在大多数情况下,神经生理学评估可发现患者的认知能力减退,这常与局部脑水肿或癫痫灶相关。
评估
MRI的T2及FLAIR序列对肿瘤浸润边界的勾画最为清楚。肿瘤可局限在岛叶,也可到达外侧裂周围、岛盖部,及其他旁边缘系统区域,即眶额部及颞极区。肿瘤的浸润程度影响其可切除性。
功能性磁共振成像(fMRI)与脑磁图(MEG)可以帮助确定语言、听觉、感觉及运动的功能区。弥散张量成像(DTI)与纤维束成像(tractography)可描记岛叶附近的重要传导束。皮层及皮层下解剖及功能区的3D成像则为手术方案提供了极大参考价值。上述技术辅以术中皮层及皮层下电刺激所得数据,即可规划合理的手术路径,在保护大脑功能的情况下最大限度切除肿瘤。
组织学上高级别的肿瘤在影像学上常有结节状强化。对于增强区域需引起高度重视,笔者常常在术中对这些区域行病理活检,以此保证肿瘤分级的可靠性。
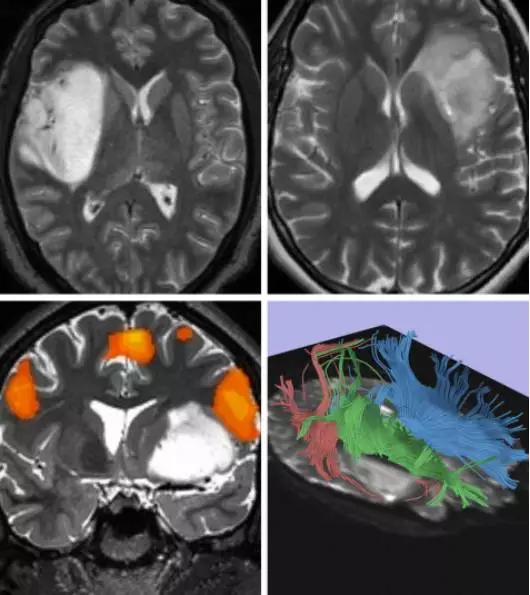
图1. 第一行图像展示了两种不同类型的低级别岛叶胶质瘤,它们的边界具有不同的浸润程度。对于浸润生长的岛叶肿瘤,完全切除风险大且极具挑战。功能性磁共振成像(fMRI)与弥散张量成像(DTI)的纤维跟踪技术可以估计功能性皮质及白质束的侵犯程度(下图)。左下图高亮显示的是位于肿瘤上部的运动语言区。对于体积较大的肿瘤,术中定位及fMRI数据可以指引术者通过安全的路径到达并暴露肿瘤。
手术指征
过去,岛叶肿瘤主要采用保守治疗,仅当肿瘤的明显占位效应及水肿造成患者神经功能缺陷时才考虑手术。然而,显微外科以及定位技术的发展提高了手术的安全性,于是适应症得以扩展,术前无明确神经功能障碍的患者也可以考虑手术。
如今对低级别胶质瘤自然病程理解日益加深,尽管肿瘤初期的亚临床浸润并不活跃,但持续增生及发生恶性变的风险很高,因此手术指证也随之扩展。
虽然缺乏I类证据,但近期一些研究认为手术是提高总生存期、无进展生存期,降低恶性变的主要因素之一。最大限度切除肿瘤的同时保证神经功能受损最小是岛叶胶质瘤手术的目标。
另外,前人在切除术中积累的经验已经证实岛叶区域具有高度的功能可塑性。只要保证在术中皮层及皮层下刺激定位的引导下,基本的语言及运动区域不受损伤,这种可塑性可以使大多数患者在岛叶肿瘤切除术之后一段时间内代偿、恢复功能。
肿瘤切除不仅能提高患者的生存期,降低恶性变概率,也被证实可以提高岛叶肿瘤常见并发的难治癫痫患者的生存质量。
笔者对岛叶胶质瘤的处理方案是:对于低级别肿瘤,运用显微外科、定位技术通过外科学方法切除。而对于高级别肿瘤,笔者则偏向保守方案。笔者相信即使运用目前最新的技术手段切除岛叶胶质母细胞瘤(尤其是位于内侧的肿瘤)依然有巨大风险。除非患者年轻、该岛叶高级别肿瘤严重影响患者功能、并位于非优势半球岛叶外侧区域,否则对于该类手术需慎重考虑。
术前注意事项
不论在术中皮层定位时选用唤醒麻醉(患者“清醒”)还是全麻(患者“睡眠”状态),在术前首先需确定患者的优势半球位于哪一侧。对于左利手患者可以通过fMRI确认他们言语的优势半球。当肿瘤广泛累及额叶时,单纯经外侧裂入路常常切除中等或大型体积的肿瘤,此时切除部分额下回可增加操作空间,得以切除肿瘤的上极和前极。术前应使用fMRI技术帮助定位语言区。
无论岛叶肿瘤是否位于优势半球,笔者都倾向于唤醒麻醉下实施手术。没有麻醉药物的影响,得以更精确更高效的定位功能皮层及白质纤维束。不仅于此,唤醒麻醉下,笔者可以相对而言更频繁地进行测试定位,这种即时的反馈可靠性高,特别有利于处理与内囊紧密相关的肿瘤的深部后内侧边界。
根据笔者的经验,患者即时、持续的反馈可以使笔者在避免不必要的神经损伤及患者不适的同时,进行更积极的手术切除。手术需要适当加速,因为大多数患者在四小时的清醒手术后就会丧失耐心。也正因为此手术技术复杂、耗时长,大多数神经外科医生选择麻醉状态(不唤醒)进行定位。
如果有定位需求,非优势半球的肿瘤可以在全麻下不唤醒行皮层定位,确保患者最大的舒适度和显微手术的安全性。这同样也适用于过分紧张焦虑的患者。如果为了暴露体积较大肿瘤必须切除部分额叶,使用定位技术可以保护下行运动传导通路及皮层面部功能区。
内侧豆纹动脉限定了切除范围能达到的最内侧边界。一些神外医生建议术前行血管造影精准定位这些重要的血管穿支。笔者个人并不采取此方法,因为术中探查往往已经暴露了这些细小血管,可以充分保护。
手术解剖
岛叶是大脑皮质的一部分,被额盖、顶盖、颞盖所覆盖。岛叶的三维结构呈一尖端向前下方的金字塔型,尖端称为岛顶(insular apex),其最表浅,距皮层表面9-16mm。
岛顶位于前侧裂点(anterior Sylvian point)深部,额下回三角部(pars triangularis)的下方。前侧裂点是侧裂池中最常用的标记,外侧裂分离由此开始。岛叶皮质周围有一浅沟环绕,称为环岛沟(peri-insular sulci),可分为前环岛沟、上环岛沟及下环岛沟。上环岛沟与前环岛沟是重要的手术标志。在手术早期暴露它们可保证充分的手术范围,即暴露了大部分岛叶外侧肿瘤的上下界。
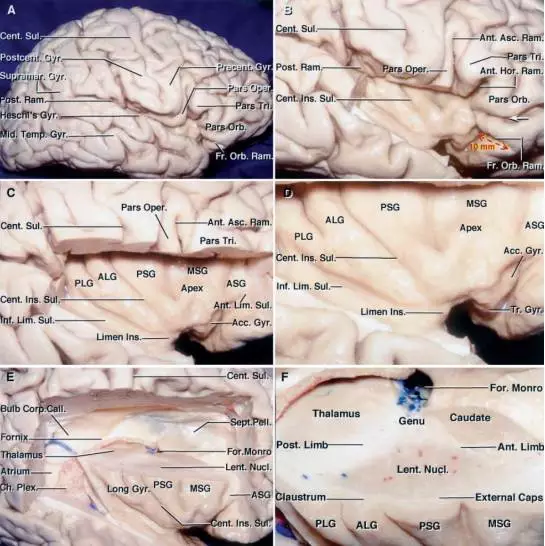
图2. 三角部尖处向上的自然回缩,形成了外侧裂池最为宽阔的部位(A)。切除额盖、颞盖后如图(B)。岛中央沟走行几乎与中央沟平行。移除剩余的额顶盖部(C)。岛叶部分放大后,可见前界沟(anterior limiting sulcus)向上向前延伸,组成岛叶的前界(D)。沿上下界沟横切移除额顶盖、颞盖及大脑半球脑核(central core)浅面的结构后,暴露岛叶与其深部结构的关系。(E)大脑半球脑核(包含尾状核、豆状核、丘脑、内囊)位于岛叶的深部。该标本上外侧区域放大后如图(F)所示,其展示了深部白质的解剖结构。Limen Ins = Limen insula,岛阈。(图像由AL Rhoton,Jr 授权)
岛叶皮质的脑沟回解剖已在图 2中阐明。岛叶有两处重要解剖标志,一为岛叶干(insular stem),其为岛叶的前基底部,位于近外侧裂的深部。二为岛阈,位于岛叶干中。
在岛叶内侧深部有一些重要结构,如最外囊(extreme capsule)、屏状核(claustrum)、外囊(external capsule)、纹状体(striatum)。运动皮层纤维在内囊后肢汇集,并立即深入上环岛沟后段。钩束(uncinate fasciculus)沿上环岛沟前部的内侧走行。
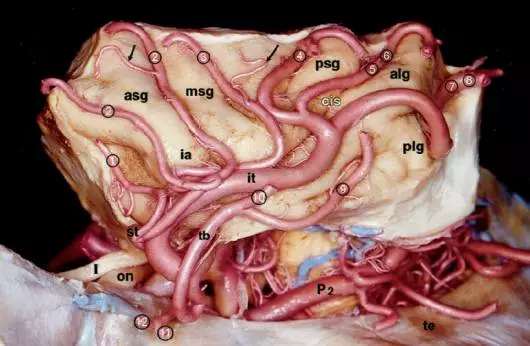
图3. 岛叶主要接受M2段的分支血供。岛盖动脉或长穿支动脉(箭头)供应岛叶及岛盖的血供。缩写:alg = 前岛长回(anterior long insular gyrus);asg = 前岛短回(anterior short insular gyrus);cis = 岛中央沟(central insular sulcus);ia = 岛顶(insular apex);it = M2下干(inferior trunk of M2);msg = 中岛短回(middle short insular gyrus);P2 = 大脑后动脉环池段(ambient segment of the posterior cerebral artery);plg = 后岛长回(posterior long insular gyrus);psg = 后岛短回(posterior short insular gyrus)。I = 嗅神经(olfactory nerve);on = 视神经(optic nerve);1 = 眶额动脉外侧支(lateral orbitofrontal artery);2 = 额前动脉(prefrontal artery);3 = 中央前沟动脉(precentral artery);4 = 中央动脉(central artery);5 = 顶前动脉(anterior parietal artery);6 = 顶后动脉(posterior parietal artery);7 = 内眦动脉(angular artery);8 = 颞枕动脉(temporooccipital artery);9 = 颞后动脉(posterior temporal artery);10 = 颞中动脉(middle temporal artery);11 = 颞前动脉(anterior temporal artery);12 = 颞极动脉(temporal polar artery)。
(摘自Türe U, Yaşargil MG, Al-Mefty O, Yaşargil DC. Arteries of the insula. J Neurosurg. 2000:92: 676–687)
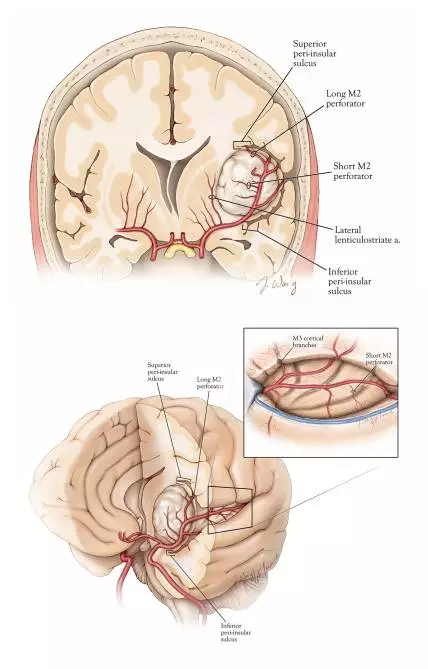
图4. 岛叶肿瘤范围及术中血管关系。注意外侧豆纹动脉起自M1段,并代表肿瘤切除术的内侧界。M2的短穿支为肿瘤提供血运。M2长穿支有可能穿越肿瘤,但大多数情况为放射冠供血(特别是那些向中央沟走行的),所以术中需被保护(上图)。上下环岛沟为切除术提供了解剖学的上下边界(下图)。暴露环岛沟保证了充分打开外侧裂,确保了残余肿瘤没有隐藏在术者视野的盲点。
岛叶表面大脑中动脉(MCA)的走行为手术带来了挑战。岛叶大部分血运由MCA的M2及M3段发出的短穿支血管供应。这些短穿支常位于肿瘤的浅表,为肿瘤供血,在软膜下切除时可以安全地电凝切断,有效阻断肿瘤血液供应。M2段也分出长穿支动脉,位于岛叶后部,向上走行供应放射冠。需要保护这些分支以避免缺血性损伤造成的轻偏瘫。谨慎分离血管并保留“过路型血管”(en passage vessels)非常重要。
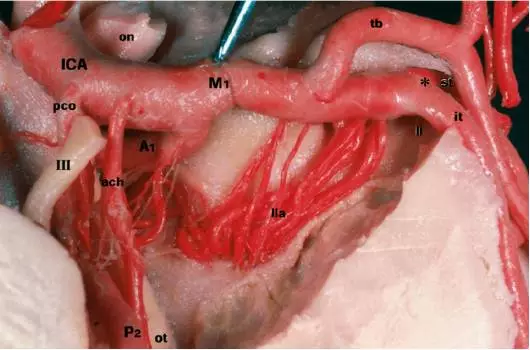
图5. 前穿质部位(anterior perforated substance)左MCA的下面观。注意外侧豆纹动脉如何从M1段分叉进入M2(星号处)。缩写:I = 嗅神经(olfactory nerve);III = 动眼神经(oculomotor nerve);A1 = 大脑前动脉交通前段(precommunicating segment of the anterior cerebral artery (ACA));ach = 脉络膜前动脉(anterior choroidal artery);ICA = 颈内动脉(internal carotid artery);it = M2段下干(inferior trunk of M2 segment);li = 岛阈(limen insula);M1 = MCA蝶段(sphenoidal segment of the MCA);on = 视神经(optic nerve);ot = 视束(optic tract);P2 = 大脑后动脉环池段(ambient segment of posterior cerebral artery (PCA));pco = 后交通动脉(posterior communicating artery);st = M2段上干(superior trunk of M2 segment);tb = MCA颞支(temporal branch of the MCA)。MCA. From Türe U, Yaşargil MG, Al-Mefty O, Yaşargil DC. Arteries of the insula. J Neurosurg. 2000; 92: 676–687.
外侧豆纹动脉(LLAs)起自M1段,走行于前穿质下,后出现于岛阈。LLAs的数量个体差异大,从1根到15根不等,这些动脉供应基底节和内囊。但若存在大体积肿瘤,这些动脉可能与M2-M3短穿支一起为肿瘤供血。术中早期辨认LLAs是预防内侧结构缺血性损伤的关键。分离M1段近端处可以找到大多数外侧豆纹动脉。
岛叶肿瘤的显微外科切除
如上所述,笔者对于所有岛叶肿瘤都倾向于选择清醒开颅术。此板块将较详细地介绍具体的手术步骤。
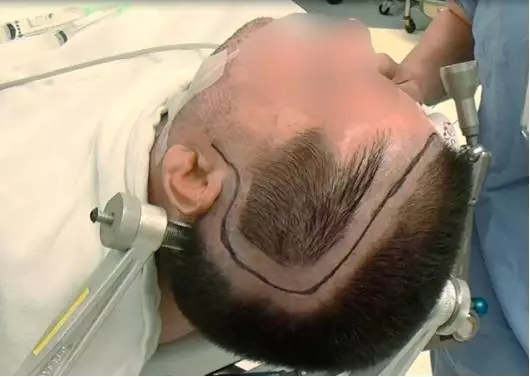
图6. 图示患者术中体位摆放,患者唤醒麻醉状态及部分区域局麻下行左侧大体积岛叶肿瘤切除术。头夹单钉置于乳突区,以使左侧颞后区域充分暴露。颅骨切开的范围以可以暴露并定位相关功能区皮层为准。
患者仰卧位,病灶同侧肩膀垫圆枕,头部向对侧旋转约30°。笔者会使患者头稍上仰,方便暴露额顶盖下岛叶上部结构。该头位摆放也同样有利于外侧裂的分离,岛盖由于重力作用下沉,为到达岛叶后部提供了更方便的通路。如果患者头部转动幅度过大,会造成患者不适,并且颞盖可阻挡手术角度,不利于肿瘤后界的暴露。
从根本而言,头部旋转角度及患者其他身体部位的摆放主要由患者的舒适度决定。在放置头架前,笔者使用0.5%含肾上腺素的利多卡因与0.25%布比卡因1:1配置,阻滞眶上、滑车上、枕神经,切口线,颞肌根部及单钉置入处。
头皮局部麻醉可以额外减轻患者痛苦。术中,笔者常规使用立体定向技术。一旦肿瘤切除开始,术中大脑出现偏移,立体定位的可靠性会下降,这在切除术区外侧结构处更为明显。更详细的术前准备请参考《胶质瘤的语言功能区定位》与《胶质瘤手术感觉运动功能区定位》章节。
笔者采取“外伤骨瓣”("trauma flap")或问号型切口。此类切口可及外侧裂全长,如需要可以行语言及感觉运动皮层定位。颅骨切开的后界可参考神经导航数据。皮瓣处理完毕后,有必要再对颞肌行浸润麻醉。
硬膜内的手术操作
分离外侧裂
开颅及分离外侧裂时需予患者适量镇静药物。当外侧裂已充分分离,上下环岛沟暴露,肿瘤外侧部经外侧裂入路移除后,方可唤醒患者。
运用“自内向外”(“inside-to-outside”)技术分离外侧裂。首先分离侧裂池远端的最宽处,并逐渐深入外侧裂直至明确岛叶表面的MCA支远端。接着,离断表面的外侧裂蛛网膜。
图7. 外侧裂前点(anterior Sylvian point)恰位于三角部顶点的下方,其为侧裂池最宽大的部分,可以选做分离外侧裂的起点。笔者一般自远处深部打开外侧裂后,分辨出MCA的远支作为继续分离外侧裂的标志。也就是所谓的“自内而外”(“inside to outside”)、自深向浅、自后向前分离。笔者会避免大家常用的“自外而内”的分离技术,因为由于额颞盖的粘连以及缺乏标志物引导,该分离方法实施较为困难。颞区侧裂浅静脉(superior Sylvian vein)需保护。更多外侧裂分离的细节已在《外侧裂分离技术》一章探讨。
沿M1段远端完成外侧裂分离后,可推移颞盖及额盖从而暴露岛叶。颞盖与岛叶之间存在MCA分支使颞盖比额盖更易活动。偶尔遇到的外侧裂桥静脉可以电凝并离断。近端外侧裂分离应显露M1段远端和LLAs,以此减少术中对岛盖的牵拉。
由于岛盖后部连接紧密,外侧裂远处的分离往往受到一定限制。此区域的盲目操作可能导致颞上回损伤。用吸引器及双极电凝轻移额颞盖可暴露岛叶皮质与环岛沟。肿瘤常常侵犯岛叶皮层并与岛盖部形成粘连,分离时可能导致肿瘤表面出血,术中可牺牲M2短小表浅的穿支方便止血,使显微手术顺利进行。必须避免对出血点盲目的过度电凝。
仅分离外侧裂为切除中等体积到大体积的岛叶肿瘤提供的手术通道相对较窄。另外,M3分支往往连接额颞盖与岛叶上部,进一步限制额叶的移动,使该部分肿瘤难以显露和切除。这些限制是造成岛叶肿瘤次全切除的常见原因。
由于这些肿瘤经常不同程度侵犯颞叶或额叶,所以往往需要额外在额颞盖皮质做切口或切除部分皮质,使其有足够的空间最大限度切除肿瘤。当行额下回及颞上回皮质切口时,有必要对患者面部功能区域(若为非优势半球肿瘤)、Broca区及Wernicke区定位(若为优势半球肿瘤)定位,确保切口部位的安全。这些操作增加了工作空间及角度,有利于在减少手术盲点的同时充分暴露肿瘤。
在开始切除肿瘤前,确保上下环岛沟充分暴露。
岛叶肿瘤切除
图8. M2的岛叶皮质穿支需被完全电凝、锐性分离,避免牵拉时损伤上级血管(左图)。上级血管的撕扯伤可导致血管痉挛甚至闭塞,使远部MCA支配区域发生缺血性损伤(右图)。如果术中发现MCA血管壁有轻微损伤,可用凝血酶棉片覆盖破损处,稍加压即可止血。止血后棉片可弃去。罂粟碱浸泡的明胶海绵可缓解操作时M2-M3段血管的痉挛。注意不可盲目电凝止血。
在唤醒患者前,需先行将岛叶外侧部分肿瘤切除。因此,M2短穿支可电凝离断,牵开M2暴露被肿瘤侵犯的岛叶皮质。在不过度牵拉岛盖的情况下最大程度暴露岛叶皮层是非常重要的。如果肿瘤累及前颞叶区,可行前颞叶局部切除术,以此获得自下而上切除肿瘤的入路。
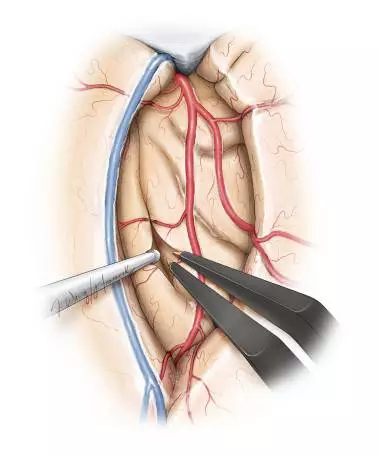
图9. 一旦穿支动脉已电凝离断,可在M2分支间的岛叶皮质做数个软膜切口,从而为软膜下切除肿瘤提供窗口与通道。M2分支的不合理牵拉会损伤这些动脉,影响肿瘤切除范围。
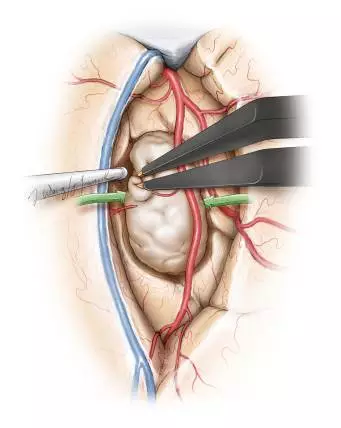
图10. 囊内减小肿瘤体积(intracapsular debulking)应为手术切除的第一步。肿瘤的上下界可按坏岛沟的位置进行估计。肿瘤中心可用双极电凝及吸引器清除。笔者在实施减瘤术时相对保守,病人唤醒并实施皮层下定位与神经功能检测后才着手处理肿瘤边界处。
为了防止MCA损伤,笔者避免使用超声吸引刀,而使用双极电凝和普通吸引器处理肿瘤。笔者习惯于将MCA的分支与外侧豆纹动脉保留在视线范围内,防止它们在操作中无意间损伤。
外侧豆纹动脉是可靠的解剖学标志,用来界定可安全暴露、切除的最内界。它们通常靠内侧走行。尽管上下环岛沟勾勒出了手术区域的上下界,但这些标志常常会受肿瘤生长而发生偏移,故需神经导航进一步指导术者。位于肿瘤后上方走行的M2-M3长穿支血管必须严格保护。
肿瘤外侧部切除后,可唤醒患者,行皮层下定位指导肿瘤上部及后部的切除。
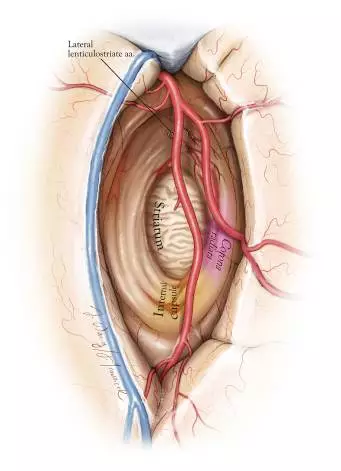
图11. 该图示经外侧裂入路行局限于岛叶的肿瘤切除术的切除范围。外侧豆纹动脉(LLAs)组成了该空间的前界和内界。在切除中,LLAs与纹状体(注意它特征性的肉豆蔻样外观)是内界的2个解剖标志。放射冠及内囊后肢位于此空间的后上方的边界处。此处肿瘤的进一步切除需依靠皮层下定位数据及患者直接反馈(术中测试),避免损伤这些白质束。
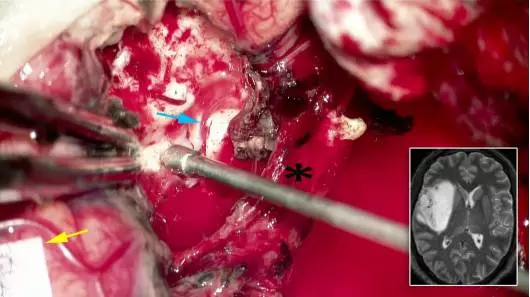
图12. 对于此岛叶肿瘤(右下小图)先行右颞叶切除术,小心牵开MCA分支(*)。笔者仔细寻找外侧豆纹动脉(LLAs)(蓝色箭头处),因为此处极轻微的电凝都可能导致这些血管的不可逆受损。具有特征性肉豆蔻外观的纹状体在这些穿支血管的背景下清晰可见。根据患者面部区域(黄色箭头所示)的皮层定位,切除额下回前部,以此暴露肿瘤前部。
在皮层下定位技术的帮助下,继续行肿瘤切除术。需要保护LLAs动脉穿支所在区域,而吸引器很容易损伤这些穿支动脉。此内侧区域的任何出血都可使用浸有凝血酶的明胶海绵适当加压止血。
如何判断肿瘤切除的合理深度是个非常有挑战性的问题,远端LLAs为此提供了一个重要的标志。由于内侧结构受脑偏移的影响最小,故此时神经导航也提供了额外帮助。高度放大、亮度充沛的显微手术视野下,术者依靠其丰富手术经验,观察组织的连续性、颜色、质地的变化,从这些细节中寻找区分肿瘤边界与正常白质的线索。
在内囊后肢处处理肿瘤后界也是该手术最有挑战性的部分之一,在这最后阶段依旧需要耐心运用皮层下定位技术辅助。一旦神经功能出现轻微、可逆的受损,应立即停止操作。
除了上述讨论的解剖标志物、肿瘤的质地与连续性的变化,还可以参考以下参数指导肿瘤切除:
1、神经导航“估计”术者是否已经到达“正常”脑组织。当然,需要考虑可误导术者的脑偏移情况(切除平面往往在导航所示的更外侧)。
2、皮层或皮层下刺激判断该处为功能皮层区或纤维束。
3、术中测试时发现患者出现轻微的神经功能损伤。
术者也需考虑手术时长。一般而言,大多数病人可以配合完成大约3~4小时的清醒状态下手术过程。笔者不使用术中磁共振技术,因为它会使患者清醒阶段的手术时间延长。
其他考虑
对于较大体积肿瘤需要扩大外侧裂入路。
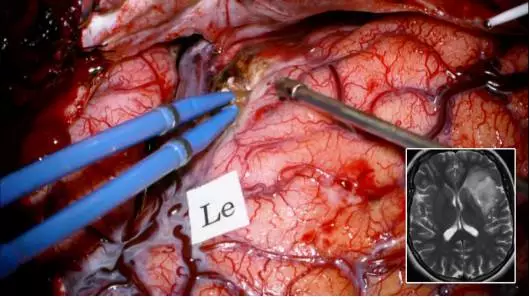
图13. 经外侧裂入路切除该左侧岛叶肿瘤后,在额下回对运动语言区进行标记(Le),定位时未显示重要结构的额盖处可适当做部分皮质切除,以此暴露肿瘤的前极和上极。
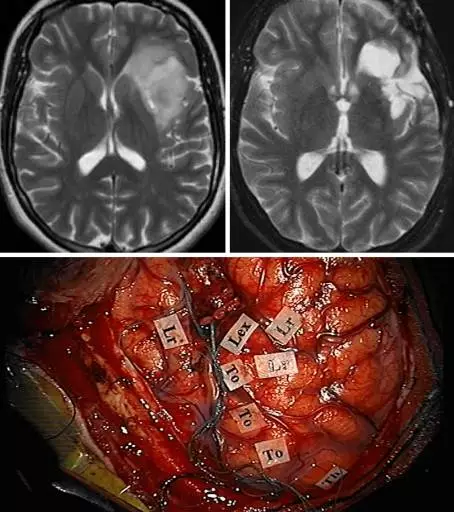
图14. 该弥漫性岛叶肿瘤位于优势半球,术中使用了经外侧裂联合经皮质入路。左上、右上示术前、术后的影像学表现,与切除范围相符。下方照片展示了行额下回、颞上回部分皮质切除,从而暴露额盖下的肿瘤边界前所行的功能区定位。
关颅
止血后,患者镇静状态下可关闭硬脑膜,此时不必追求水密缝合。大体积肿瘤切除后,可沿切口边缘及在骨瓣中央处进行悬吊,这是为了避免术后可能发生的硬膜外液体积聚。
术后处理
预防性使用抗癫痫药物在岛叶胶质瘤术中及术后十分重要,由于手术操作可使功能皮层区兴奋,故抗癫痫药物的使用剂量可略高于治疗量。术前需测量药物浓度,并在术中及术后遵守严格的给药方案。术后需行MRI,若影像学示肿瘤残余明显(通常位于额颞盖下部,或临近内囊),可考虑再次手术。大脑任何部位的缺血都可影响术后预后情况。
术后24~48小时部分患者可出现神经功能受限的症状,特别在优势半球手术中,常出现语言功能缺陷。这种迟发的功能受损症状往往只是暂时的,其原理尚不明确,但可能与术后脑水肿及癫痫部分发作有关。EEG可示痫样放电,需合理选取抗惊厥药物剂量或相应地添加新药。
大多数出现术后迟发性神经功能障碍的患者会在2~4周内恢复,可安慰患者不必过度担忧。术后可立即使用类固醇,但一旦患者临床状态好转,便需逐步减药。
点睛之笔
经外侧裂入路需要丰富的显微外科经验。岛叶肿瘤常常侵及白质,被额颞盖遮盖。因此,对于大体积岛叶肿瘤,可先行经外侧裂入路切除部分肿瘤,随后经额颞盖扩大手术入路继续切除剩余部分。
损伤豆纹动脉或大脑中动脉导致的缺血性损伤是手术并发症的重要原因之一。为了避免并发症的发生,术者必须对该区域解剖有充分了解并具备精湛的显微外科技术。止血、轻柔对待血管组织是关键。术中需保护为放射冠供血的M2长穿支动脉,在肿瘤出血过多时避免不经意地电凝。
导致并发症的另一原因是下行运动纤维受损。因此,术中需仔细辨别肿瘤前界的远端外侧豆纹动脉(LLAs),并在肿瘤后界对内囊行皮层下定位。过度切除可导致明显的并发症。
经外侧裂入路的另一常见并发症是过度牵拉岛盖,损伤Broca区、上环岛沟附近的弓状束水平纤维、及下环岛沟附近的钩束纤维。为了预防此类损伤,笔者不鼓励使用固定的牵开器,而是采用动态牵拉技术。笔者使用吸引器及双极电凝镊来推移岛盖,并不断改变受力点。
术中,如果由于语言区未暴露或无法定位,因此未获得阳性定位结果,术者可能不得不依靠阴性定位结果(“negative stimulation mapping”)进行手术。
一部分岛叶肿瘤可向外侧裂突出。这表明额颞盖可能与岛叶皮层有明显粘连,这也意味着术中分离困难,很可能对血管和功能皮层造成损伤。
DOI: https://doi.org/10.18791/nsatlas.v4.ch02.9
中文版链接:https://www.medtion.com/atlas/2258.jspx
(编译:郑璇;审校:徐涛)
参考文献
Duffau H, Capelle L. Preferential brain locations of low-grade gliomas. Cancer. 2004; 100:2622–2626.
Duffau H, Taillandier L, Gatignol P, Capelle L. The insular lobe and brain plasticity: Lessons from tumor surgery. Clin Neurol Neurosurg. 2006; 108: 543–548.
Hentschel SJ, Lang FF. Surgical resection of intrinsic insular tumors. Neurosurgery. 2005; 57:176–183, discussion 176–183.
Lang FF, Olansen NE, DeMonte F, Gokaslan ZL, Holland EC, Kalhorn C, et al. Surgical resection of intrinsic insular tumors: complication avoidance. J Neurosurg. 2001; 95: 638–650.
Ribas GC, Ribas EC, Rodrigues CJ. The anterior Sylvian point and the suprasylvian operculum. Neurosurg Focus. 2005; 18: E2.
Ryvlin P, Minotti L, Demarquay G, Hirsch E, Arzimanoglou A, Hoffman D, et al. Nocturnal hypermotor seizures, suggesting frontal lobe epilepsy, can originate in the insula. Epilepsia. 2006; 47: 755–765.
Shelley BP, Trimble MR. The insular lobe of Reil—its anatamico- functional, behavioural and neuropsychiatric attributes in humans—a review. World J Biol Psychiatry. 2004; 5: 176–200.
Tanriover N, Rhoton AL, Kawashima M, Ulm AJ, Yasuda A. Microsurgical anatomy of the insula and the Sylvian fissure. J Neurosurg. 2004; 100: 891–922.
Türe U, Yaşargil DC, Al-Mefty O, Yaşargil MG. Topographic anatomy of the insular region. J Neurosurg. 1999; 90: 720–733.
Türe U, Yaşargil MG, Al-Mefty O, Yaşargil DC. Arteries of the insula. J Neurosurg. 2000; 92:676–687.
Varnavas GG, Grand W. The insular cortex: morphological and vascular anatomic characteristics. Neurosurgery. 1999; 44:127–136. Discussion 136–138.
Yasargil GM, Krisht AF, Türe U, Al-Mefty O, Yasargil DCH. Microsurgery of insular gliomas: Part III: pathophysiology and clinical presentation. Contemp Neurosurg. 2002; 24:1–5.
Yasargil MG. Microneurosurgery. Yasargil MG (ed), George Thieme Verlag: 1984
Yaşargil MG, Ammon von K, Cavazos E, Doczi T, Reeves JD, Roth P. Tumours of the limbic and paralimbic systems. Acta Neurochir. 1992; 118: 40–52.
Zentner J, Meyer B, Stangl A, Schramm J. Intrinsic tumors of the insula: a prospective surgical study of 30 patients. J




