启事
“浙二神外周刊”不定期接收外院投稿,审核后发表。欢迎各专业同道联系我们,分享精彩病例、研究热点或前沿资讯。投稿请联系:shishi74@163.com
病史简介
患者,男性,48岁,主诉“突发头痛10天,再发加重伴意识障碍4天”入院。
患者于2017.05.13突发头痛,伴呕吐一次,无视物模糊,无胸痛,无意识障碍。就诊于当地医院查心电图提示V1-V4 导联ST段抬高,肌钙蛋白0.021 ng/ml↑,血糖34.51mmol/l↑。当地医院诊断心肌梗塞后转诊我院心内科,查肌钙蛋白-T 0.038 ng/ml↑,糖化血红蛋白A1c16.4↑,β羟基丁酸0.75nmol/l↑,头颅CT提示鞍区少许高密度灶(图1A),我院心内科诊断:急性冠脉综合征、糖尿病酮症酸中毒 代谢性脑病。予双抗治疗,1天后由于患方拒绝任何检查治疗自动出院。
患者出院后回家,症状并无明显改善,2017.05.18日起出现头痛加重,神志淡漠,嗜睡,逐渐加重,2017.05.22再次就诊我院神经外科,查头颅CT提示蝶鞍扩大,鞍区高密度灶(图1B)。垂体磁共振增强提示鞍区占位伴出血。磁共振DWI相提示双侧额叶内侧及扣带回皮层下高信号,弥散受限,考虑急性脑梗塞(图2)。垂体激素提示:游离T3(FT3)1.74pmol/L↓、游离甲状腺素FT45.57pmol/L↓、总甲状腺素TT440.3nmol/L↓、皮质醇(8am)12.4nmol/L↓、黄体生成素<0.3IU/L↓、卵泡刺激素0.6IU/L↓。生长激素1.75ng/ml, IGF-1 79.3ng/ml↓,PRL79.3mIU/L正常。心电图提示前壁ST段抬高,肌钙蛋白-T 0.021ng/ml↑,空腹血糖14.0mmol/l↑,早餐后血糖16.2mmol/l↑。急诊拟“垂体腺瘤卒中,额叶梗塞,糖尿病”收住入院。
入院查体:生命体征正常,神志嗜睡,呼叫可睁眼,定向力差,不能正确对答,肢大面容,双手指粗大(图1C),视力检查不能配合,双侧瞳孔等大等圆约3mm,对光反射灵敏,四肢肌力V级,病理反射未引出。
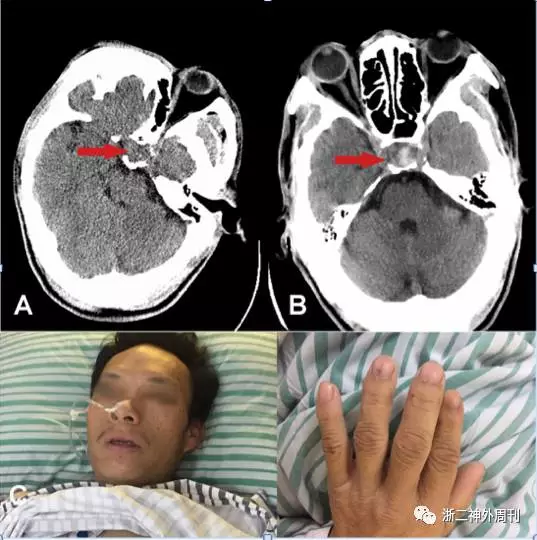
图1. A. 5月13日头颅CT可见鞍区高密度影;B. 5月22日CT提示随着病情进展,垂体卒中显著加重;C. 患者显著肢端肥大面容,手指粗大。

图2. A. 垂体增强磁共振提示鞍区占位,考虑垂体大腺瘤,伴双侧额底片状强化;B. DWI序列提示双侧额叶底部内侧,扣带回前部皮层和皮层下弥散受限,提示脑梗塞急性期。
诊疗经过
入院后我科邀请放射科,内分泌科,神经内科,心内科专家参与该病例的MDT讨论,针对该病例做了如下评估与治疗。
垂体激素:入院后患者表现为全垂体前叶功能减退,予氢化可的松50mg q12h静脉滴注,2天后改为氢化可的松10mg 8am,4pm,10pm口服补充皮质激素治疗,同时予优甲乐75mg qd补充甲状腺素。补充激素后患者意识障碍改善,能完成基本对答。OGTT生长激素抑制试验显示:生长激素不能被葡萄糖负荷抑制,OGTT谷值GH为1.43 ng/ml。补充激素后生长激素仍在正常水平,但IGF-1显著升高(图3)。患者并未出现尿崩症,24h尿量在正常范围内,监测电解质基本正常。
血糖控制:患者血糖控制不佳,入院时糖化血红蛋白A1c 17.3 ng/ml↑,血压偏低,结合上次入院时酮体增高,考虑有糖尿病酮症酸中毒存在,予补足液体量(约3000ml/day),门冬胰岛素+来得时控制血糖。血糖变化如图(图4)
脑灌注:在维持液体量的同时,予改善微循环,抗氧自由基治疗,由于考虑后续手术治疗,患者梗塞范围未再扩大,故未使用抗血小板药物。
心功能评估:完善心功能评估,行动态24h心电图提示窦性心律,心脏多普勒超声提示射血分数(EF)50-60%,冠状动脉CTA提示右冠轻度狭窄,评估心功能尚可耐受手术,肌钙蛋白T降至正常水平。

图3. OGTT抑制试验提示生长激素不能被抑制,外源性补充皮质醇及甲状腺素后IGF-1增高。
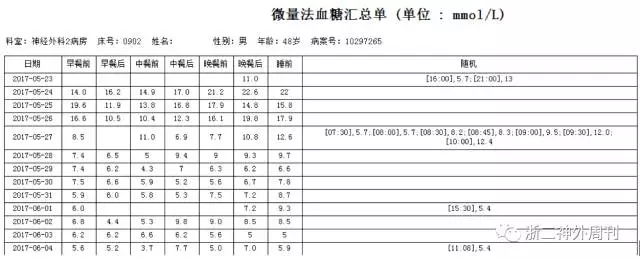
图4. 患者入院时血糖水平高,术前及术后血糖控制可。
手术所见:在完善相关检查,排除手术禁忌,补足激素和纠正高血糖后,患者在全麻下接受经鼻蝶鞍区肿瘤切除术。术中打开鞍底硬膜后,可见肿瘤中大量陈旧性血性混合豆腐渣样组织(图5B),肿瘤质地软,血供一般,刮匙予以各个方向充分刮除后,可见塌陷的鞍底,肿瘤近全切除,然后用人工脑膜以及带蒂黏膜瓣进行颅底重建,手术过程顺利。
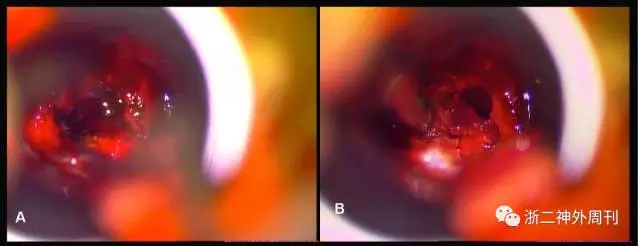
图5. 术中所见:A. 切开鞍底硬膜后可见陈旧性暗红色血性组织流出;B. 肿瘤深部可见豆腐渣样出血坏死组织,质韧。
病理结果:术后我院常规病理提示:(鞍区)垂体腺瘤,伴砂砾体,出血坏死,垂体卒中。结合免疫组化结果,符合催乳素生长激素细胞腺瘤。免疫组化结果:ACTH -,Prolactin +,GH +,FSH -,LH -,ER -,PR -,TSH -,CAM5.2 核旁+,P53 个别+,Ki-67 <3%,EMA -,PR -(图6)。
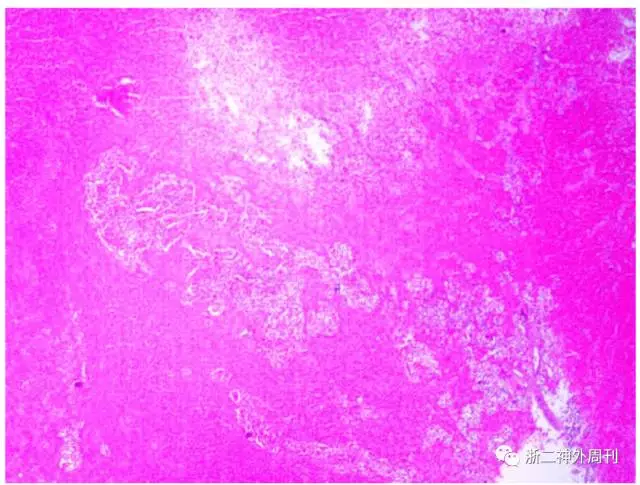
图6. HE染色可见腺瘤组织(右下角有核细胞)被大片出血坏死组织(染色较深组织)包绕,考虑垂体卒中。
术后情况:患者术后一般情况可,神清语利,术后继续口服补充皮质醇及甲状腺激素,术后第二天复查生长激素0.68ng/mL、IGF-1 224.0ng/mL、IGFBP-3 2.79μg/mL↓、皮质醇(8am)134.5nmol/L↓。术后复查垂体增强MR提示减压充分,肿瘤次全切除(图7)。患者术后无尿崩,无发热,无脑脊液漏等并发症,血糖控制可,于2017年6月6日出院,转当地医院继续治疗,嘱患者神经外科,内分泌科,心内科门诊随访。
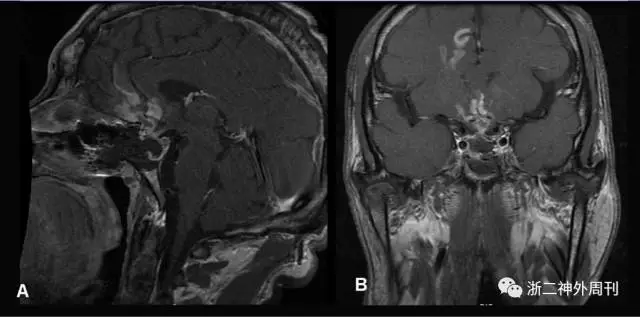
图7. 术后复查MRI矢状位(A)与冠状位(B)提示肿瘤次全切除术,垂体柄居中。
讨论
垂体卒中是一类危及生命的综合征,不同文献报道其在垂体瘤患者中发病率大约在2-7%左右,较多见于无功能腺瘤患者[1]。其经典的临床表现为继发于出血或缺血后的突发头痛 呕吐 视力障碍以及逐渐进展的意识障碍。而垂体卒中合并脑梗塞目前较为罕见,至2016年国际上仅有不到40例报道[2,3]。
据不同文献统计,合并脑梗塞的垂体卒中致死率达到30%和36%,均高于单纯垂体卒中0-12.5%的死亡率[2-4]。仅有8%的病例在发生垂体卒中前即诊断出垂体瘤。临床表现上,除了经典的垂体卒中所致头痛呕吐,视力障碍之外,意识障碍情况往往出现早,进展较快,其原因可能与坏死组织破裂进入蛛网膜下腔,下丘脑受压和继发于脑梗塞的恶性水肿等等因素叠加有关[1,2]。另外,根据新发梗塞的位置不同可出现相应部位的神经功能障碍,如偏瘫,偏身感觉障碍,眼肌麻痹等。
有意思的是,出现新发梗塞的部位不仅仅局限于垂体瘤解剖关系最为密切的大脑前动脉供血区,而双侧或单侧梗塞,梗塞面积大小亦各不相同。Zou等报道了一例垂体卒中合并右侧大脑中动脉和大脑前动脉回返支的大面积脑梗塞病例,2010年意大利的一例报道则展示了右侧枕叶梗塞的病例,2014年协和医院报道的一例病例出现右侧大脑中动脉和双侧大脑前动脉的梗塞,而2016年斯坦福医学院报道了一例右侧额叶、丘脑、枕叶散在梗塞灶,CTA提示前动脉中动脉供血区灌注不足的病例[2,5-7]。
Gambaracci等报道的垂体腺瘤卒中伴脑梗塞病例提示额叶、基底节、颞叶及小脑广泛散在的新发梗塞灶(图8)。Banerjee C回顾了25例垂体卒中合并脑梗塞病例,其中20例单侧脑梗塞中6例死亡,5例双侧脑梗塞中3例死亡,提示双侧脑梗塞合并垂体卒中可能预后不佳[3]。
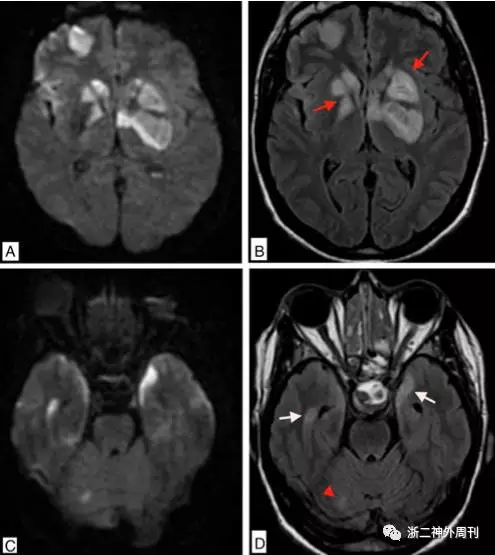
图8. Gambaracci等报道的垂体腺瘤卒中伴脑梗塞病例:A、B、C:DWI及FLAIR相提示额叶、基底节、颞叶及小脑均有新发梗塞灶。D. 可见鞍区内不均匀高信号影[8]。
目前关于垂体卒中合并脑梗塞的形成机制,主要聚焦于机械压迫和血管痉挛两种学说上。机械压迫主要由于肿瘤卒中后在原有基础上快速增大,从而压迫了willis环上的血管继而产生脑梗塞。Zou回顾的36例病例中有19例发病原因为机械压迫,其中颈内动脉床突上段和海绵窦段最容易受累,大脑前动脉和中动脉其次,单侧更加容易受累[2]。而血管痉挛的发生一方面是由肿瘤出血后引起的蛛网膜下腔出血所致,另一方面由于卒中后的垂体瘤中大量坏死炎性组织释放后引起。既往文献中有许多病例报道通过MRA和CTA证实了血管痉挛的存在(图9)。当然,许多病例中存在两种因素的协同作用。
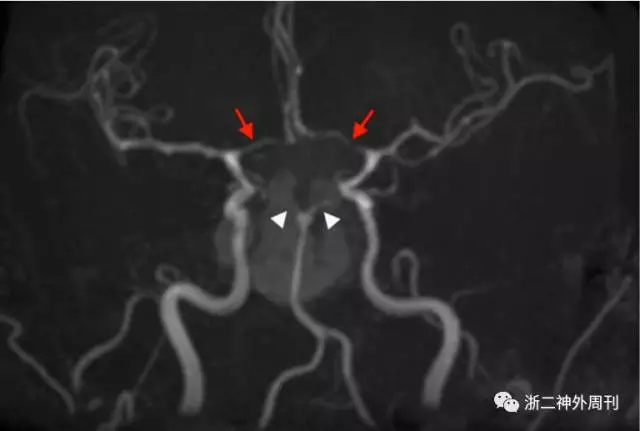
图9. 借助MRA可见痉挛的血管[8]。
然而,既往文献中缺乏对垂体瘤类型与卒中伴梗塞关系的分析,其原因一方面是部分病患起病急,意识状况差,疾病发展迅速,未行手术治疗,因此难以取得病理。Zou回顾的36例病例中有25例行手术治疗,Banerjee C回顾的25例病例中有20例行手术治疗,其中一些手术仅行去骨瓣减压,未处理原发肿瘤[2,3]。另一方面由于本疾病发病率较低,一些较早报道的病例中病理资料缺失,或未行免疫组化,无法明确病理类型。但是,通过本例患者的诊治的分析,我们认为GH腺瘤这一病理类型与肿瘤卒中合并脑梗塞有一定的相关性:
首先,患者起病时表现为突发头痛呕吐,而后有一个再发加重合并意识障碍的过程,CT中鞍区高密度影也有显著增多,说明肿瘤卒中程度不断加重,结合患者入院时血糖高,糖化血红蛋白高,酮体高,考虑长期高GH血症所致的糖尿病合并酮症酸中毒使得患者严重脱水,低血压,结合垂体卒中后垂体前叶功能低下,皮质醇分泌不足,更加剧了低血压的严重程度,为脑灌注不足和脑梗塞的发生提供了病理生理学基础。既往也有文献报道酮症酸中毒参与垂体卒中的过程[9]。
其次,患者初次入院时肌钙蛋白升高,心电图提示前壁ST段抬高,有亚临床急性冠脉综合征存在,由于长期高GH血症所致的心脏负荷加之高血糖高血压状态,使得冠状动脉易发生痉挛及梗塞,从而引起全身血流动力学的改变。Sherlock M等的综述指出,垂体前叶功能减退的患者的心血管疾病死亡率大大提高(男性增加1.4倍,女性增加1.7倍),如有合并糖尿病,这一死亡率更是成倍增长[10]。
第三,随着对于垂体卒中研究的深入,近来垂体缺血性卒中也越来越得到重视,有学者认为,垂体卒中的早期肿瘤内出血和缺血同时存在,甚至出血是继发于缺血的,即垂体卒中的早期出现梗塞后出血,晚期为坏死期。而南京军区福州总院2015年报道的9例垂体缺血性卒中患者中,6例为GH腺瘤,伴或不伴术前GH增高,且术中均可见凝固坏死组织,与本例颇为相似,提示GH腺瘤与垂体缺血性卒中亦有一定的联系(图10)[11]。
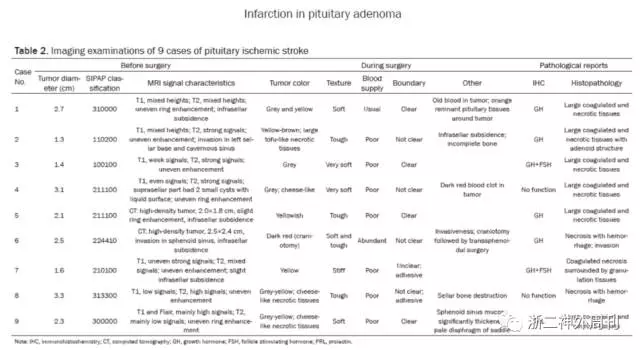
图10. 2015年南京军区福州总院发表的回顾性研究:9例垂体缺血性卒中患者中6例经病理证实为GH腺瘤[11]。
在该病例的诊治过程中,我们也得到了一些宝贵的经验:
1. 多学科评估和协作对于这一类复杂的垂体瘤卒中伴脑梗塞非常重要,也是患者能够获得较好预后的基础;
2. 文献报道约80%的患者在垂体卒中后出现垂体前叶功能低下,ACTH,TSH,GH出现缺乏的比率分别为70%,50%,75%[1],本例病例中,垂体激素低下掩盖了原发的高GH血症,因此IGF-1和生长激素葡萄糖抑制试验对明确诊断有较大的价值。从补充激素的顺序来讲,应优先补充皮质激素和甲状腺素,2011年英国垂体卒中指南推荐在急性期给予氢化可的松100-200mg每日静脉滴注,渡过急性期后,立即过渡为氢化可的松20-30mg一日三次口服;
3. 既往文献报道垂体卒中合并脑梗塞预后不佳,死亡率约30%(11/36),但也可以看出治疗方式与预后有一定的相关性,保守治疗与手术治疗在总体预后上差别不大,但手术治疗组死亡率稍有降低;择期手术相较急诊手术死亡率有降低(18%:36%);手术方式上,经鼻蝶手术组相较去骨瓣减压术组患者预后更好,当然其中患者初始GCS评分,梗塞范围等也是影响预后的混杂因素(图11)。
因此,我们认为对于垂体卒中合并脑梗塞的患者,应在疾病进展的窗口期抓住时机进行多学科团队的评估,给予补充激素,补足容量,纠正内环境,抗脑血管痉挛,评估血管情况等措施,排除手术禁忌后限期手术,术后规范化多学科治疗,使得患者能够获得较好的预后。
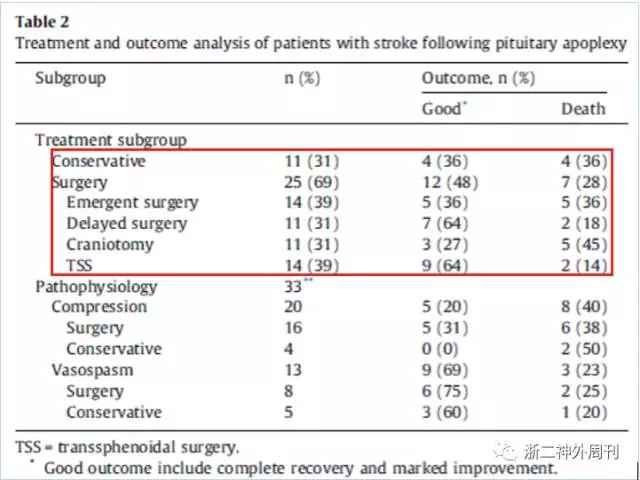
图11. ZOU等回顾的36例垂体卒中伴脑梗塞患者治疗与预后情况[2]。
参考文献
1. Rajasekaran S, Vanderpump M, Baldeweg S,Drake W, Reddy N, Lanyon M, Markey A, Plant G, Powell M, Sinha S, Wass J: Ukguidelines for the management of pituitary apoplexy. Clinical endocrinology2011;74:9-20.
2. Zou Z, Liu C, Sun B, Chen C, Xiong W,Che C, Huang H: Surgical treatment of pituitary apoplexy in association withhemispheric infarction. Journal of clinical neuroscience : official journal ofthe Neurosurgical Society of Australasia 2015;22:1550-1554.
3. Banerjee C, Snelling B, Hanft S, KomotarRJ: Bilateral cerebral infarction in the setting of pituitary apoplexy: A casepresentation and literature review. Pituitary 2015;18:352-358.
4. Bujawansa S, Thondam SK, Steele C,Cuthbertson DJ, Gilkes CE, Noonan C, Bleaney CW, Macfarlane IA, Javadpour M,Daousi C: Presentation, management and outcomes in acute pituitary apoplexy: Alarge single-centre experience from the united kingdom. Clinical endocrinology2014;80:419-424.
5. Cerase A, Tarantino A, Muzii VF, VittoriC, Venturi C: Vasospasm and cerebral infarction from pituitary apoplexy. A casereport. The neuroradiology journal 2010;23:321-324.
6. Sussman ES, Ho AL, Pendharkar AV, AchrolAS, Harsh GRt: Pituitary apoplexy associated with carotid compression and alarge ischemic penumbra. World neurosurgery 2016;92:581 e587-581 e513.
7. Zhang C, Feng F, Zhu Y, Wang R, Xing B:Cerebral infarction caused by pituitary apoplexy: Case report and review ofliterature. Turkish neurosurgery 2014;24:782-787.
8. Gambaracci G, Rondoni V, Guercini G,Floridi P: Pituitary apoplexy complicated by vasospasm and bilateral cerebralinfarction. BMJ case reports 2016;2016
9. Camara-Lemarroy CR, Infante-Valenzuela A,Rodriguez-Velver K, Rodriguez-Gutierrez R, Villareal-Velazquez HJ: Pituitaryapoplexy presenting as diabetic ketoacidosis: A great simulator? Neuroendocrinology letters 2016;37:9-11.
10. Sherlock M, Ayuk J, Tomlinson JW, ToogoodAA, Aragon-Alonso A, Sheppard MC, Bates AS, Stewart PM: Mortality in patientswith pituitary disease. Endocrine reviews 2010;31:301-342.
11. Xiao D, Wang S, Huang Y, Zhao L, Wei L,Ding C: Clinical analysis of infarction in pituitary adenoma. Internationaljournal of clinical and experimental medicine 2015;8:7477-7486.
(浙江大学医学院附属第二医院神经外科谷驰主治医师整理,陈景森、石键副主任医师审校,病理科许晶虹副主任医师提供病理解读,张建民教授终审)
往期回顾
浙二神外周刊(九十六)--桥小脑角脑膜瘤伽马刀后并发PICA血栓性动脉瘤一例
浙二神外周刊(九十四)--颅内表皮样囊肿自发破裂伴血清CA-199显著升高一例
浙二神外周刊(九十二)--鞍上毛细胞黏液样星形细胞瘤伴自发性出血一例
浙二神外周刊(九十一)--2017西湖神经外科论坛成功召开!
浙二神外周刊(九十)--以尿崩症为首发表现的Erdheim-Chester病一例并文献复习
浙二神外周刊(三十七)--垂体瘤伴发鞍结...
浙二神外周刊(三十六)--脑膜血管瘤病...



