今天为大家分享的是由苏燕东医师编译,《神外资讯》常务编辑、海军军医大学附属长征医院神经外科徐涛医师审校的:高流量搭桥的手术策略与技巧(High Flow Revascularization),欢迎观看、阅读。
Giant ICA aneurysm-Radial Bypass_Atlas
Bypass Techniques for Complex Intracranial Aneurysms
Giant MCA and bypass-long_Atlas
Management of Complex Aneurysms- Clip Reconstruction and Bypass Techniques
20世纪60年代早期,Woringer 首次报道高流量的颈外动脉-颈内动脉(EC-IC)搭桥,由此开启了脑血管显微外科技术时代。尽管Woringer的尝试因为技术复杂、并发症发生率高在起初并未被广泛接受,但这的确是脑血管重建领域里一个伟大的进步。
直至上世纪70年代伊始,医药和外科技术的不断进展再次引起了人们对搭桥手术的兴趣。1971年,William Lougheed以大隐静脉为桥血管实施了颈总动脉-颅内段颈内动脉搭桥并获得成功,随后,在此基础上,其他外科医师将这项技术进行改进并应用到颅内动脉瘤、缺血性脑血管病和颅底肿瘤的治疗。
EC-IC搭桥技术难度大、适应征局限,因此即便在现代神经外科中使用仍然不频繁。实施该手术前,有许多事项需要加以考虑,包括:选择合适病例、选用何种搭桥术式、技术要点、个体解剖学特征。
搭桥手术分类
几乎每一根颅内动脉都曾被作为受血血管进行脑血流重建。总体上有低流量、EC-IC的高流量和IC-IC的原位重建三种方式,应根据受血动脉的血流量需求以及是否有合适的供血血管来选择手术方式。低流量供血动脉提供的血流量少于50ml/min(15-25ml/min),高流量者则可超过50ml/min(70-140ml/min)。
低流量搭桥包括以颞浅动脉(STA)或枕动脉(OA)为供血血管将其吻合至颅内中等大小的动脉,比如STA与远端MCA(STA-MCA)搭桥,当然,小脑上动脉(SCA)或大脑后动脉(PCA)也可以作为受血动脉。
STA-MCA搭桥应用最为广泛,在“低流量搭桥”一章中已详细阐述。IC-IC原位吻合属于低流量搭桥,特别适合大脑前动脉(A3-A3搭桥)和小脑后下动脉(PICA-PICA搭桥)的复杂动脉瘤,该技术的优点为所吻合的两根血管管径相近、桥血管就位于颅内且所需长度短。
与低流量搭桥目的在于扩充受血动脉血流量不同,高流量搭桥以大管径血管为桥血管(一般取大隐静脉或非优势型的桡动脉),提供可靠的血流替代,比如使用桡动脉连接颈外动脉(ECA)与M2的一支。
适应征
脑血管重建手术主要有两个适应征:
1. 为Moyamoya或严重颅内动脉粥样硬化等难治性慢性缺血性脑病患者提供脑血流量扩充。
2. 为因复杂脑血管病变或颅底肿瘤治疗需要而牺牲颅内血管的患者进行脑血流替代。
一般低流量搭桥用于需扩充血流量的病例,高流量搭桥则用于需进行血流替代者。
尽管似乎有神经生理学依据支持脑血管重建,但是并没有I类证据支持EC-IC或IC-IC搭桥。此外,有许多研究(EC-IC搭桥试验和颈动脉闭塞手术试验)表明脑血流重建手术具有相当高的死亡率和并发症,尤其术者经验不足时。因此,搭桥手术的适应征目前仍然很局限而且广受争议。
尽管前述研究结果令人失望,目前学界还是公认EC-IC高流量搭桥手术适应征为因治疗颅内复杂动脉瘤或颅底肿瘤而需要牺牲大、中血管。
复杂的颅内动脉瘤
复杂颅内动脉瘤包括巨大型(有分支血管从瘤壁发出)、分叶型、宽颈型、梭形、钙化型和巨肠形的动脉瘤,因为这类动脉瘤的不典型性病理解剖学特征,它们不能像囊状动脉瘤那样可以通过显微手术夹闭或血管内栓塞获得成功治疗。
夹闭动脉瘤需要瘤颈显露满意、近端载瘤动脉可控、保护分支动脉和小穿支、瘤颈形态相对规则具有可塑性并能被夹闭。
复杂动脉瘤的夹闭必须牺牲某些载瘤或分支血管,不符合上述原则;而介入治疗对这些瘤壁累及供血动脉分支的动脉瘤并不能奏效;如此,复杂动脉瘤的最终治疗手段就只能是血管搭桥了。
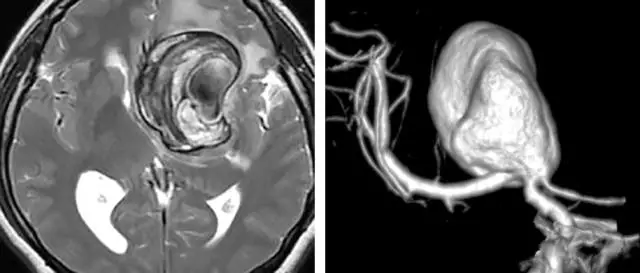
图1. 左侧颈内动脉分叉部动脉瘤,大小6cm,伴钙化和部分血栓形成,传统的显微手术夹闭不可行。治疗方案为:颅外段ICA-M2的高流量搭桥、结扎脉络前动脉以远的ICA(Hunter方式)、阻断同侧A1逆流进入瘤腔的血流。后文有展示本例术中情况的图片。
颅底肿瘤
个别罕见的颅底肿瘤会包裹临近的动脉,为了实现全切,必须切除受累血管。颈内动脉在颅底的特殊走形使得它是最常被评估能否牺牲掉的血管。
相当部分的患者可以耐受颈动脉闭塞并通过球囊阻塞试验(BTO),然而高达30%的BTO阴性者结扎颈动脉后依然会出现脑缺血。因此,通过外科手术或介入方式闭塞血管前经常需要进行血管搭桥。
绝大多数颅底肿瘤为良性,而且残留病变的放疗效果好,先搭桥后彻底切除肿瘤的风险远甚于收益,笔者极少使用。
创伤后动脉夹层和假性动脉瘤
颅内动脉夹层和假性动脉瘤的形成可以是自发性或者创伤性,对于保守或介入治疗效果均不佳的难治性病例,可能需要牺牲病变血管来降低卒中或蛛网膜下腔出血的风险。
尽管搭桥手术是治疗这类顽疾的有效手段,但是新兴的血管内支架技术将搭桥手术的使用范围进一步缩窄。
粥样斑块闭塞性疾病
患者常常出现短暂性脑缺血发作或者卒中,尤其是伴有低血压时;也可能存在颅内或颅外血管的狭窄-闭塞性病变、血管炎或Moyamoya病。脑血流量扩充技术可以使饱受因脑动脉粥样斑块所致闭塞性疾病造成的药物难治性缺血性并发症的患者受益。
若是前循环的狭窄-闭塞,药物或介入治疗无效时可考虑行EC-IC搭桥;若是后循环受累,特别是椎基底动脉的闭塞,EC-IC搭桥是最终治疗手段。
桥血管的术前评估与选择
术前应对准备接受脑血管重建术的患者进行详尽的评估,包括:测量桡动脉和大隐静脉的直径与长度、超声多普勒与Allen试验评价尺动脉对手掌血管弓的代偿能力。12岁以下儿童的桡动脉管径太细不适于搭桥。
最合适的高流量桥血管是桡动脉和大隐静脉,两者可以互换,但各有优缺点,选择何种取决于准备施行的搭桥方式。
静脉性桥血管在搭桥术后可能发生血管粥样化的前驱病变,导致血栓形成的风险更高。心血管领域的文献也表明术后1年时桡动脉作为桥血管的通畅率更高,但目前在脑血管病领域还没有类似报告。
研究显示大隐静脉参与的脑血管重建在术后1,5和13年时的通畅率分别为86%,82%和73%,已经是相当高的了。因此,选择桡动脉而不是大隐静脉主要基于其他考虑,比如术者的偏好和受训经历。桡动脉的管径和管壁厚度都与颅内中等大小的动脉(M2或P1)相似,这些优点有利于在缩短阻断时间的前提下更好地完成远端吻合口缝合和保持吻合口远期的通畅,所以,个人倾向首选桡动脉。
动脉性桥血管缺乏瓣膜而且不会曲张,故操作中不易形成栓子引起阻塞;其管壁的坚韧度也大大降低了扭曲缠结的风险。桡动脉的缺点有:被从前臂切取后的潜在并发症、长度短、可能出现血管痉挛造成功能性闭塞。可以使用钙通道阻滞剂或行血管成形预防血管痉挛,但这仍然是无法规避的不足之处。获取最大长度的桡动脉至关重要。有时桡动脉的长度确实不够,术者不得不放弃手术。
大隐静脉的壁厚和管径都比颅内的受血动脉大,这种不匹配使得吻合时技术难度更大。而且,大隐静脉可承载的血流量极高,可能导致远端吻合口出现血流紊乱。但是该静脉可获取的长度达40cm,足以胜任任何搭桥术式。
桥血管必须要具有足够的管径(2-3mm)和至少20cm的长度,除了桡动脉和大隐静脉之外也有其他选择,只是比较少,比如胫前动脉和旋股外侧动脉,但是这些血管获取困难而且容易出现动脉粥样硬化,因此限制了它们的使用。
术前脑血管评估
推荐术前行导管造影检查,详细评估颈部血管和包括颞浅动脉在内的颈外动脉、Willis环与目标病变周围的血流代偿能力和血管变异情况。
推荐行球囊阻塞试验(BTO)。该试验能够评价侧支循环和暂时的闭塞耐受性,而不能准确预测永久阻断后是否会发生缺血性并发症,但BTO也可以从另一个角度证实搭桥手术的必要性。
球囊阻塞ICA后开始观察患者神经功能状态、电生理学和影像学方面的变化,还有对外界刺激的反应。如果15分钟的时间里始终没有任何客观证据表明存在情况恶化,就可以认为患者成功通过了ICA闭塞挑战。
进行BTO的同时评价脑血流量和加做试验性低血压可以提高结果的可靠性。阻断ICA后,同侧MCA或ACA的血流量下降超过25%的患者更有可能出现缺血相关并发症,需要实施血管搭桥扩充血流量。个人建议,将BTO时间延长至30分钟,同时进行试验性降压(平均动脉压降低15-20mmHg),并利用CT灌注或氙-CT成像等工具评估血流量。也可以通过测量球囊远端的逆向动脉压间接反映侧支循环是否充分。
不能耐受常规BTO的患者需要行高流量的EC-IC搭桥。常规球囊闭塞试验阴性但逆流动脉压低、灌注不足或血压降低后出现恶化的患者可以从高/低流量搭桥手术中获益。
新的影像学工具-量化MRA对评估脑血流量也有相当大的帮助。Charbel及其同事研究了16例患者发现量化MRA提示同侧MCA或ACA血流量减少超过20%者都无法耐受BTO。
术前注意事项
术前1周患者开始每日口服325mg的阿司匹林预防术后桥血管血栓形成;高胆固醇血症会影响远期的通畅,所以有此合并症者推荐术前使用他汀类药物。
双侧桡动脉都有可能被使用,应做好准备和标记;股动脉置管可以监测平均动脉压和进行术中造影;监测脑电图、体感诱发电位、运动诱发电位和脑干听觉诱发电位,必要时监测肌电图预防颅神经损伤。
血管重建时需要非常宽阔的显微手术通道,脑松弛就显得异常重要。若要暴露充分,必须使用甘露醇(1g/kg)、地塞米松并吸引脑脊液,脑室穿刺或腰穿引流也有所帮助。
平稳的术中麻醉至关重要。为了防止临时阻断血流时发生缺血事件,推荐将吸入氧浓度分数(FiO2)上调至100%、诱导轻度低体温和使用巴比妥类药物介导爆发-抑制波形。严禁低血容量和低血压的出现,维持血碳酸浓度正常以防侧支血管挛缩。
吻合血管时,采取上述措施可以使脑组织更好地耐受局部血流的暂时中断。对于未破裂动脉瘤,临时阻断的过程中调整收缩压至正常高限以改善侧支循环
相关解剖
搭桥手术的学习曲线比较陡峭,需要术者熟识相关解剖学知识并具备扎实的显微神经血管外科技术。
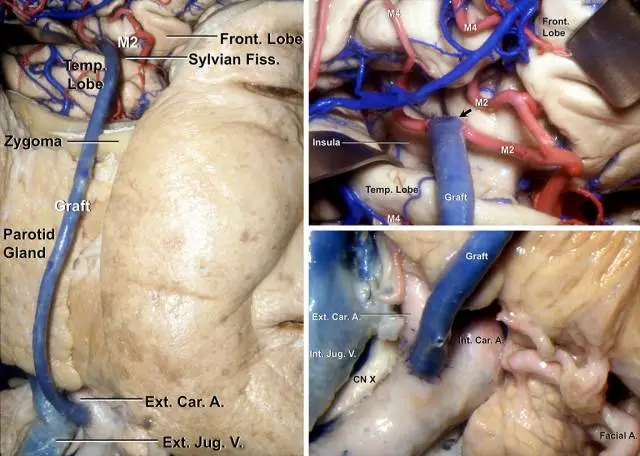
图2. 尸头标本演示使用静脉进行ECA/ICA-M2高流量搭桥。颧弓上钻一沟槽容纳桥血管无缠结地通过;在豆纹动脉远端选取一段分支最少的M2作为受血动脉临时阻断,采用端-侧吻合的方式以8-0或9-0的尼龙线间断缝合远端吻合口(右上图的箭头);随后完全阻断颈部的ICA或ECA,使用7-0尼龙线,桥血管近端可以端-侧吻合至ICA,也可以端-端吻合至ECA。(图片由AL Rhoton,Jr教授授权)
高流量搭桥技术
患者的体位取决于动脉瘤的位置、供血和受血动脉之间的关系。避免过度扭转患者的颈部以免椎动脉在颅颈交接区受压。
计划采用侧卧位时应在摆放体位前置入股动脉插管,仰卧位和侧卧位时均可获取桡动脉。
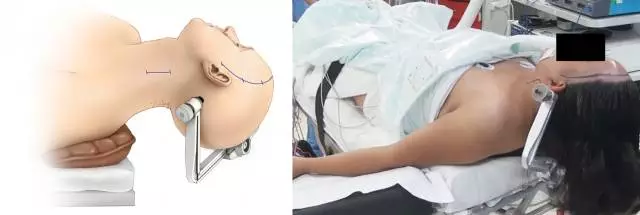
图3. 依据供血、受血动脉的位置和计划分离桥血管的部位来调整患者的体位。沿胸锁乳突肌前缘做一道5cm的切口暴露颈部的ICA和ECA。同时进行颈部解剖、开颅和取桥血管可以加快手术进程。
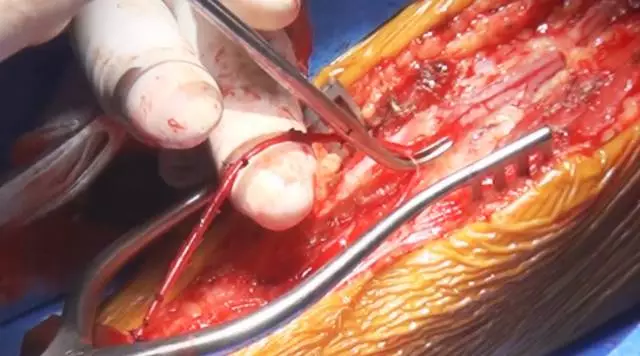
图4. 笔者偏好使用桡动脉。仔细分离、结扎该动脉的小分支,避免损伤主干。获取一段合适长度的桥血管并实现无张力吻合至关重要。该步骤由外周血管外科医师完成,个中细节这里不再详细论述。取得桥血管后,肝素盐水灌洗、膨胀管腔(压力扩张技术)。
颈部暴露
常规备好患者的颈部以便控制近端和备行EC-IC搭桥。若搭桥手术涉及颅外的颈动脉,以颈总动脉分叉水平为中心沿胸锁乳突肌前缘做一5cm切口,切开皮肤和颈阔肌。
随后游离胸锁乳突肌并牵向外侧,在颈内静脉内侧暴露颈动脉鞘。在头侧经常可见二腹肌后腹和舌下神经跨越ICA,应妥善保护。
面总静脉位于下端,可被结扎剪断增加CCA、ICA和ECA的显露。使用控制带分别套住这些动脉,每一根血管都应游离出距颈总动脉分叉处4cm的长度以便放置阻断夹、吻合时有足够的操作空间。推荐使用ECA作为近端的吻合部位,这样可避免临时阻断ICA的需要。但如果ECA的解剖走形会造成桥血管扭转,则改用ICA。
《颈动脉内膜剥脱术》一章里将更详细地介绍暴露颈总动脉分叉部的技术要点。
开颅
常规翼点入路,根据吻合口部位和目标病变位置做适当调整。开颅范围应足够大,充分暴露受体动脉;也可以通过去骨瓣缓解潜在的脑水肿和占位效应。
扩大骨瓣或联合眶壁截骨术可以增加暴露。术中常常需要静脉使用2000-3000IU的肝素预防桥血管血栓形成,因此,开颅过程中一定要彻底严密止血。
血管吻合
供端(ECA/ICA)、受端(M2)都准备好后就可以开始吻合血管了。广泛开放外侧裂,松解额下的蛛网膜并将额叶抬离颅底。
强烈推荐首先吻合颅内端,此时桥血管很松弛容易翻转,操作更方便。而如果先吻合颅外端血管,吻合颅内端时操作空间会受限,也容易形成血栓,难度更大。
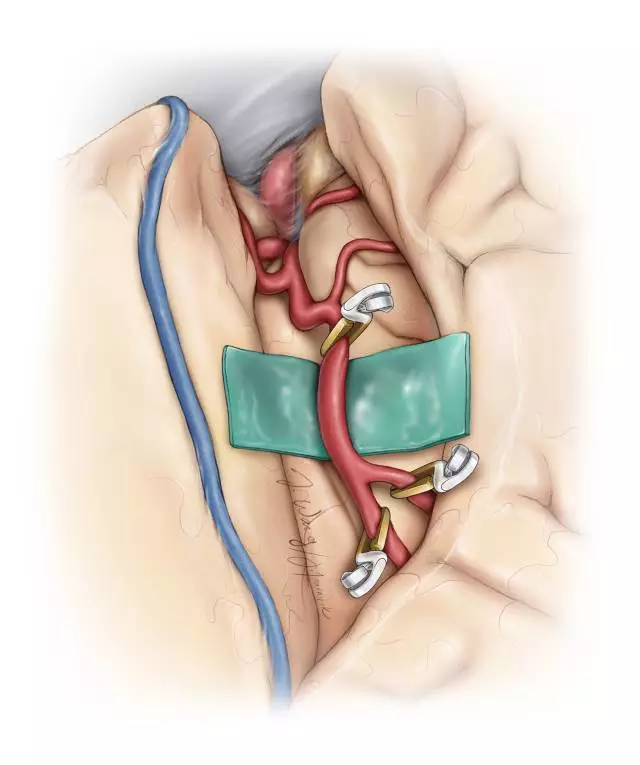
图5. 术区彻底止血。在受血动脉下方垫入一块带颜色的对照物(橡胶垫片)映衬透明的血管管壁,同时保护深面的脑组织。术中需要肝素盐水不断冲洗术区,在橡胶垫片下方留置一根具有持续吸引作用的引流管可以使吻合部位保持干燥。
随后,无菌油墨笔标记动脉管壁切开的位置。修整桥血管开口宽的一端并去除外膜,准备吻合。如果是大隐静脉,将断端宽的这侧吻合至受血动脉,可避免损伤静脉瓣膜,同时保持管腔内的血流方向。
临时阻断受血动脉(一般是M2)前,静脉使用2000-3000U的肝素。FiO2上调至100%,稍微升高血压促进侧支循环,并使用依托咪酯诱导爆发-抑制波形。尽量将临时阻断的时间控制在30-40min以下,但对于ECA-PCA这类技术难度大的搭桥,阻断时长往往会超过。
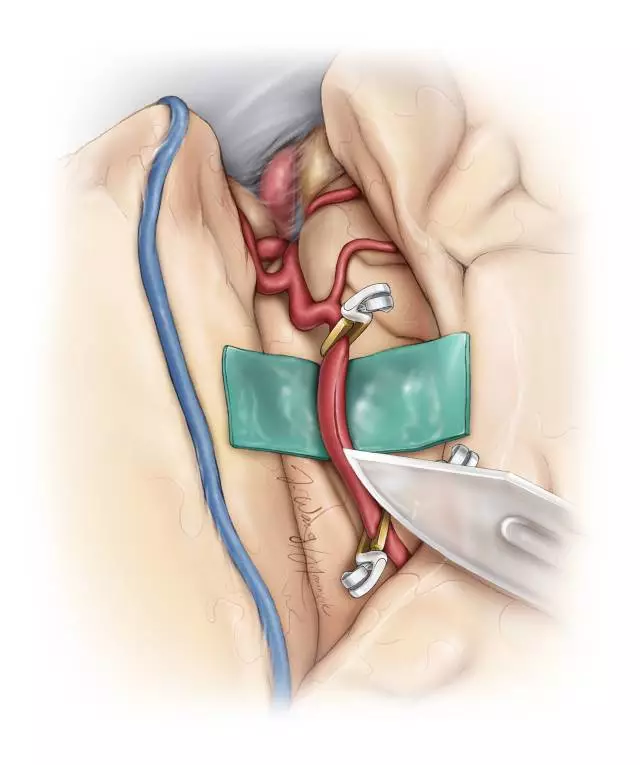
图6. 选取靠近MCA分叉部且没有分支的M2接受搭桥,小阻断夹中断其血流,然后,显微刀切开管壁并用显微剪沿标记线延长。
受血动脉造口的长度约为其管径的2-3倍。“鱼嘴样”扩大桥血管的远心端开口。采用间断缝合方式,以8-0或9-0的尼龙线吻合M2或P2端,以7-0的尼龙线吻合近端ICA。先在造口两极各缝合一针以对位、固定桥血管。
余下的漏口可以间断或连续缝合。结扎最后一针之前,再次用肝素盐水冲洗管腔。吻合完成后,在桥血管远离吻合口的部位放置一枚临时阻断夹,移除受血动脉的夹子使血流再通,以免阻断时间延长。吻合部位的出血/渗血可用止血纱和明胶海绵控制。
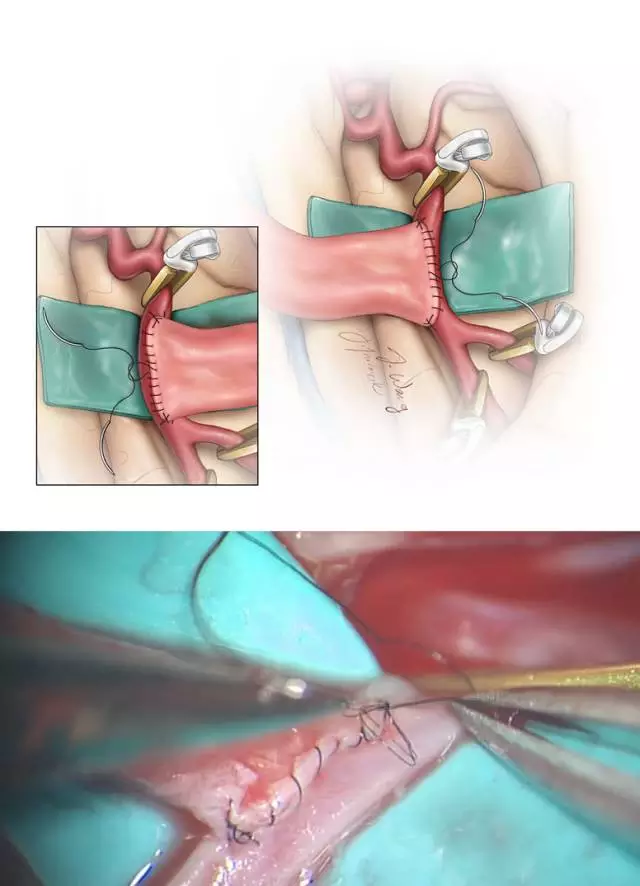
图7. 分别先在造口两极各穿入一针连续缝线以对位、固定桥血管(上图)。将桥血管翻向一侧便于完成侧壁的吻合。打结之前抽紧每根缝线(下图)。
接下来是将桥血管从颧弓根表面的皮下隧道拉向颈部的术区。将一把止血钳从颞肌附着处插入,朝下颌角方向,穿过咬肌和腮腺筋膜最终到达颈部切口的上端。钳子夹住一根儿童胸腔闭式引流管之后回退,这样引流管便可连接头颈部切口并能为桥血管提供稳固而平滑的通道。若计划将桥血管留置于耳前,为了避免盘曲扭结或管腔狭窄,可能需要在颧弓上磨一条沟槽。
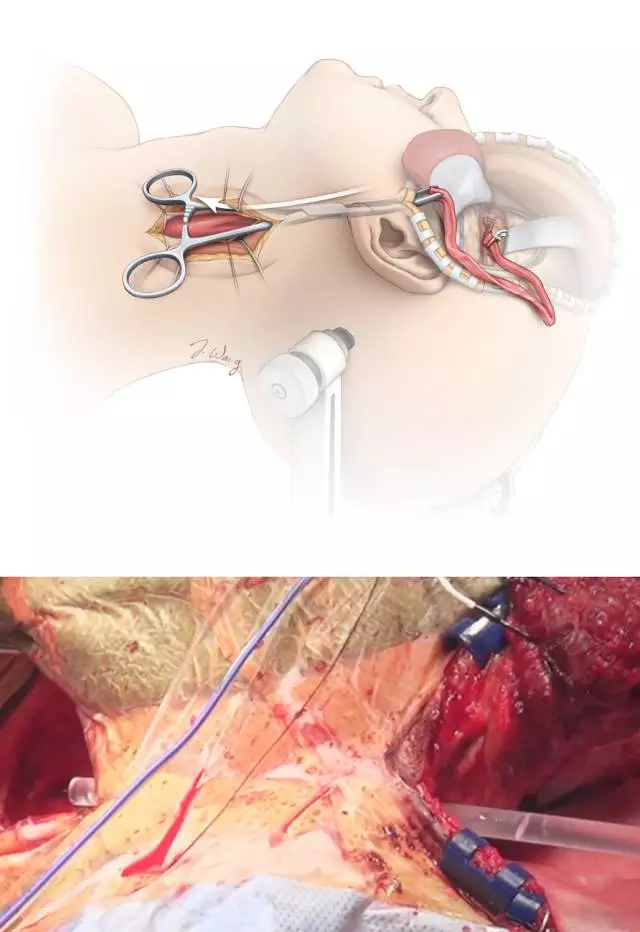
图8. 桥血管借助儿童胸腔闭式引流管通向颈部。在此之前,先于颧弓磨一条骨槽防止血管受卡压。引流管上剪开个小裂口以允许桥血管固定于管腔内,同时,后续引导血管通过时使用该裂口定位引流管的方向和预防桥血管出现扭结。随后引流管从颈部退出,并与桥血管脱离。
与远端吻合口一样,吻合近端前同法置入橡胶垫片和引流管。修剪桥血管长度,不仅要避免过短使吻合存在张力,也要防止过长使血管扭曲打折造成血流受阻。临时夹阻断分叉处的ECA,将其远端结扎切断,再行端-端吻合。
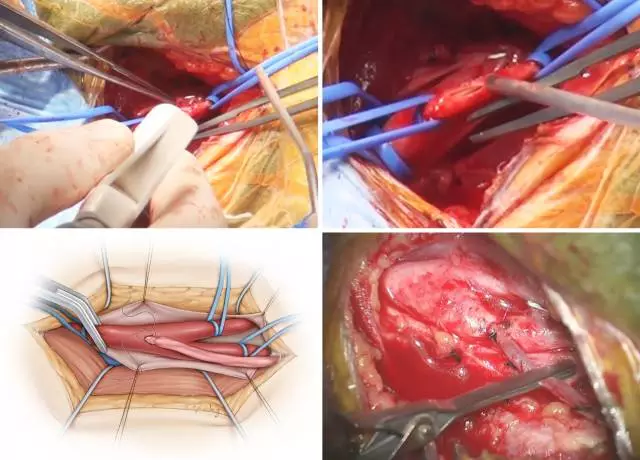
图9. 如图示将桥血管吻合于CCA或ICA,如果这样可以减少血管扭转的话。若颈动脉分叉部太高难以企及,可以CCA为供血血管。左上图演示使用血管打孔器在CCA侧壁创造一个卵圆形的开口,右上图中清晰可见动脉造口和控制带的位置。下图为吻合完成后所见。
无菌油墨笔标记供血动脉的造口处,“鱼嘴样”扩大桥血管断端增加吻合口面积,随后使用7-0的尼龙线进行端-端吻合。结扎最后一针之前,在吻合口远端的桥血管放置一枚临时阻断夹并用肝素盐水充分灌洗管腔。
通过移除ECA的阻断夹恢复近端ECA血流来冲刷出血栓和其他碎渣。然后再次阻断ECA,打紧最后一针的线结。移除桥血管阻断夹的顺序是先远端后近端。出血或渗血部位用止血纱或明胶海绵轻轻压塞,出血汹涌者可能需要缝合止血。术后颈部留置引流管预防血肿形成。
搭桥血流的术中评估
血管吻合全部完成后,很重要的一个环节就是明确搭桥是否通畅。通过观察和触摸初步判断桥血管有无血流通过。
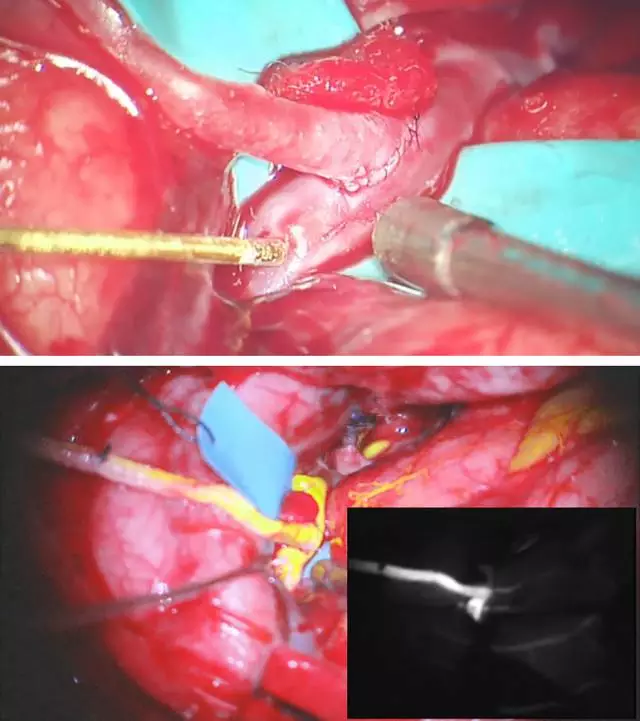
图10. 微型超声多普勒探测血流(上图)。创伤小和实施迅速的荧光或吲哚菁绿(ICG)造影是术中评价搭桥通畅性的可靠手段(下图)。荧光血管造影简单易行,能够发现血流不足、狭窄或闭塞的部位。
另外一种无创工具-Charbel微型血流探测器(Transonic Systems, Ithaca, NY)可以在术中实时量化桥血管的血流量,而常规的微型超声多普勒仅能判断是否有血流通过。
搭桥失败的术中应对策略
如果术中荧光造影提示桥血管闭塞,术者应该仔细检查双侧吻合口和桥血管全程。如果患者能耐受球囊阻塞试验,那么原因可能是对侧代偿过来的血流量大于桥血管所提供的,这种情况并不需要血管重建。
如果术中电生理监测没有检测到神经功能下降的迹象而且检查后证实不存在任何技术失误,那么最好将桥血管保留在原位。
如果搭桥不通畅伴有体感诱发电位或者运动诱发电位改变,应该依次打开远端(颅内)和近端(颈部)吻合口,用肝素盐水冲洗所有部位,随后重新吻合。若是这样做了之后,不存在张力和扭转的桥血管仍然不通,应该再次评估搭桥手术的安全性,并考虑是否放弃血管重建直接缝合受血动脉的切口。
术后注意事项
术毕患者入ICU监护。术后第1天每小时触摸桥血管的搏动并用微型超声多普勒探测,第2天和第3天时分别改为每4小时和8小时一次。术后24小时行常规CT检查,但如果怀疑存在血流不畅应即刻行CT或介入血管造影。
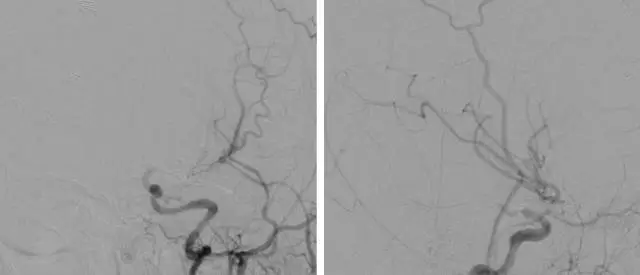
图11. 图1所示患者的术后血管造影证实动脉瘤已被孤立不显影,同时桥血管血流通畅。
术后48小时内应避免高血压以防出现高灌注性并发症;若使用桡动脉进行搭桥,应在术后24小时内评估手部的血供;术后前3天皮下注射肝素钠(5000U,q8h),之后患者终身服用阿司匹林(325mg,qd);术后3个月和1年时复查CTA,随后依据所处理病变的需要每2-5年复查1次。
搭桥的通畅率
随着近期EC-IC搭桥技术的进展,其并发症发生率和死亡率已经分别显著降至低于7%和2%,而且技术娴熟的术者可以将通畅率由66%提升至95%。
若是后循环的搭桥,以上数据会稍微差一些。血栓形成、血流滞缓和桥血管管壁的内皮脱落都会降低通畅率,所以术中应极力避免机械性损伤。绝大部分的搭桥失败发生在术后1周内,这可能与手术技巧问题和凝血障碍有关;超过1周仍通畅者在术后6个月复查时几乎全部依然保持畅通。
新的搭桥技术
和低流量搭桥比较,由于高流量搭桥需要临时阻断的颅内血管管径更粗、更靠近端,因此并发缺血事件的风险更高。有鉴于此,Tulleken及其同事介绍了一种新的吻合技术,以期降低缺血风险。
这种技术也被称作“准分子激光辅助的无阻断式吻合(excimer laser-assisted
nonocclusive anastomosis,ELANA)”,即使用准分子激光在受血动脉管壁上造口。完成颅内吻合后,无需阻断便可在颈部桥接血管。ELANA技术可以促进在更粗和更近端的血管完成搭桥而不增加手术风险。
DOI: https://doi.org/10.18791/nsatlas.v3.ch05.3
结语
脑血管外科医师处理各种颅内病变需要牺牲血管时,高流量搭桥是实现血流替代的一项重要技术。
合适的桥血管选择和搭桥策略对于成功实施高流量EC-IC搭桥至关重要。
感谢Tevfik Yılmaz,MD, Yiping Li, MD, 和 Mustafa K.Başkaya,MD对本文的贡献。




