今天为大家分享的是“景昱—神经科学专栏”第二十九期,由哈尔滨医科大学附属第二医院吉航编译的:对DBS治疗基底节源性运动障碍的作用研究,欢迎阅读。
【Ref: Wichmann T & DeLong MR. Neurotherapeutics. 2016 Apr;13(2):264-83. doi: 10.1007/s13311-016-0426-6.】
基底节源性运动障碍的治疗已由损毁术发展到多巴胺替代疗法。目前,发现脑深部电刺激术(DBS)具有可逆、可控和侵入性比损毁术小的特点,对药物难治性基底节源性运动障碍有较好疗效。美国亚特兰大埃默里大学医学院神经科的 Thomas Wichmann等回顾DBS相关研究,总结其作用机制,提出DBS可能将基底节病理性输出转变为兼容模式,致使下游结构恢复正常功能从而缓解运动障碍的观点。文章发表于2016年4月《Neurotherapeutics》上。
皮质下运动环路的纤维投射异常复杂(图1)。该环路起源于运动皮质(MC)、运动前区皮质、扣带回运动区以及辅助运动区。这些区域向纹状体、壳核发出支配感觉运动的投射纤维,终止于两个纹状体中部棘状投射神经元群(MSNs),后者发出的纤维分别投射至苍白球外侧(GPe)、苍白球内侧部(GPi)和网状核黑质部(SNr),即基底节两个负责输出的核团。由GPi或SNr输出的投射纤维,经丘脑终止于丘脑前腹外侧核(VLa)、前腹核大细胞神经元、正中核和束旁核(CM、Pf)。这些核团发出的输出纤维分别投射至MC皮质、运动前区皮质和扣带运动区,形成闭合运动环路。长期以来,人们认为基底节在动作选择上发挥重要功能,亦有研究认为基底节主要参与动作的幅度和速度等的调控。
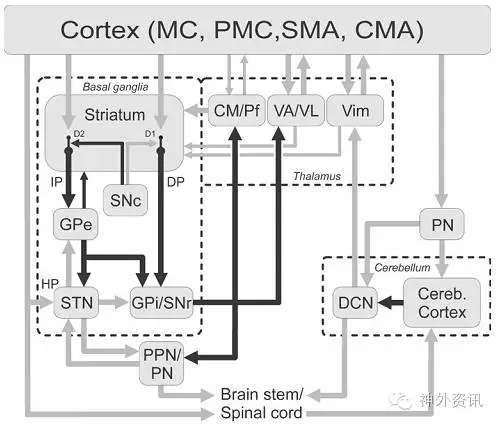
图1. 皮质及皮质下运动环路。黑色箭头代表抑制性投射纤维;灰色箭头则为兴奋性投射纤维。
动物模型和临床研究表明,帕金森病(PD)与基底节功能的异常密切相关。基底节多巴胺能神经元的缺乏是PD发生的主要原因。深入研究认为,基底节的活动模式改变、同步化放电异常、基底节形态学和基底节以外的结构的变化均可能参与PD病理生理学过程。研究亦表明,在皮质、脑干和脊髓等部位的GABA能神经元均受到广泛抑制,感觉运动信号整合和突触可塑性异常等,均与肌张力障碍有关。近期对灵长类动物模型的研究显示肌张力障碍与壳核-GPe联系活动减低以及GPe输出纤维对STN和GPi的抑制增强相关。小脑功能紊乱所发挥的作用尚不明确。
回顾既往研究,DBS的作用机制可能是抑制刺激位点神经元电活动,对经过该位点的病理或生理信息产生功能性阻断,亦或是作为“过滤器”滤过病理性低频电活动。作者指出,由基底节功能紊乱所致的运动障碍的临床表现繁多,可能导致人们夸大基底节在正常运动功能中发挥的作用。立体定向手术的一种“理论”,即通过苍白球切开术或丘脑切开术来干扰基底节的输出可缓解运动障碍的症状和体征,仅遗留较小的缺陷,提示基底节对运动功能更多起辅助作用。所以,不论是损毁术还是DBS,其疗效仅仅是将下游的脑区从基底节的病理性活动中释放出来,从而促进运动环路形成新的平衡状态,DBS的作用并非促进基底节功能的恢复。
(哈尔滨医科大学附属第二医院吉航编译,复旦大学附属华山医院寿佳俊博士审校,《神外资讯》主编、复旦大学附属华山医院陈衔城教授终审)
【景昱-神经科学专栏】往期回顾

更多资讯请关注神外资讯微信公众号:neurosurgerynews



