病史简介
患者:男,25岁,右利手,因“反复右面部抽搐6年,加重5天”入院。
6年前出现反复右面部抽搐,每次持续1分钟左右,偶可伴意识不清,持续十几分钟后清醒,于外院及本院神经内科多次就诊,考虑为症状性癫痫,长期口服奥卡西平,癫痫控制良好。4年前查头CT、MRI提示左额叶病灶(图1),由于担心手术风险(患者为销售人员,担心影响语言功能),未手术。1年来自行停服奥卡西平,近2周面部抽搐再发,加用德巴金治疗,控制不佳,1周前加用苯巴比妥,近5天来面部抽搐发作频繁,发作时无法言语,意识清楚,每天发作百余次,每次持续数十秒至1分钟不等。为求手术治疗来我院。
入院查体:神经系统检查阴性。
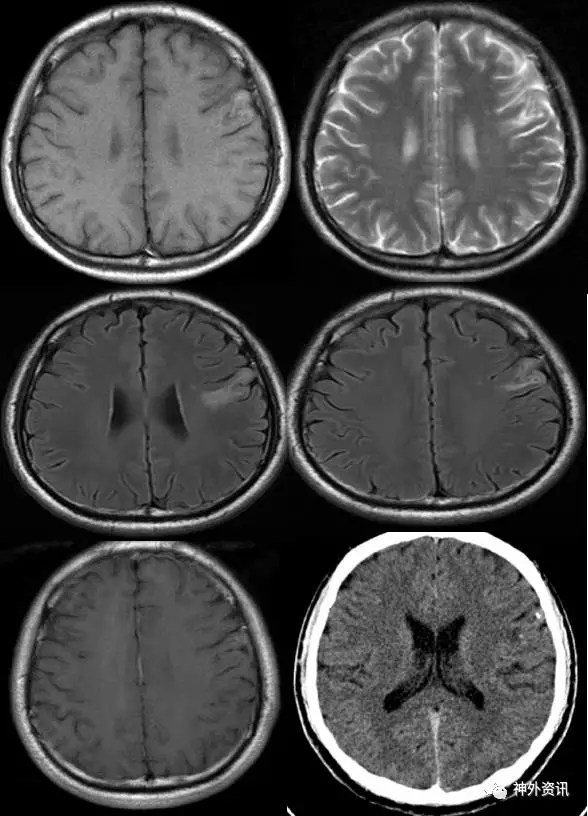
图1. 病灶位于左额叶Broca区,T1像高低混杂信号,T2像、Flair像高信号,无强化,CT显示左额叶病灶散在钙化。
诊疗经过
患者入院后行头MRI检查(见图2),较4年前无明显变化。
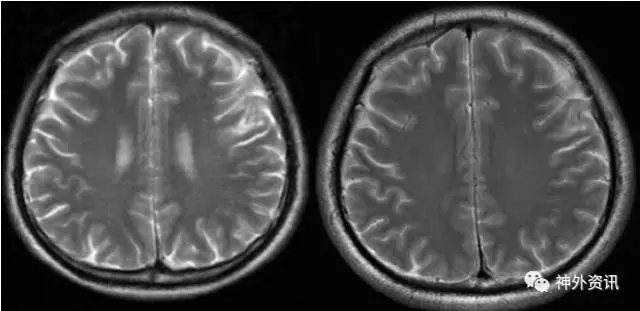
图2. 左侧为2011年,右侧为2015年,病灶无明显变化。
PET-CT 提示左额局部皮质多发钙化、糖代谢减低。双侧顶叶糖代谢弥漫性轻度减低(图3)。
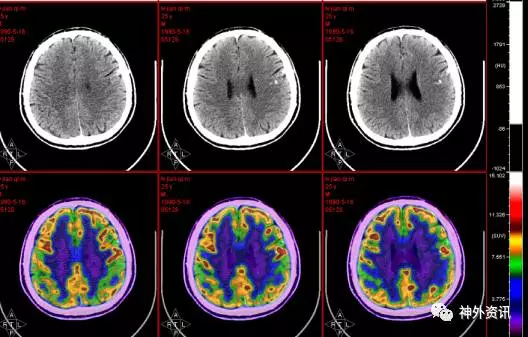
图3. 左额局部皮质多发钙化、糖代谢减低。双侧顶叶糖代谢弥漫性轻度减低。
视频EEG 捕捉到140余次惯常的右侧面部抽搐发作,患者先右侧面部僵住、嘴角向右侧歪斜,随后出现面部和嘴部的反复抽动,清醒时多见,平均数分钟一次。
脑电图发作:左侧额叶起源,描写:见左侧额叶低幅棘波节律出现,频率逐渐减慢,波幅逐渐增高,随后全导肌电干扰,持续约1分钟至2分钟。无发作间期癫痫样放电。
术前诊断 考虑胶质瘤或良性病变,伴癫痫发作,手术指征明确。
手术
患者右侧卧位,剪开硬膜后,取1*4片状电极SEP定位中央沟,导航定位病灶位置。唤醒患者,皮层脑电未记录到明确的癫痫样放电,电刺激皮层确定面部及手的运动区,刺激病灶所在脑回的过程中有2次明确的惯常发作,未刺激出语言区。显微镜下切除病灶所在脑回,外侧为外侧裂,后界为中央前沟,深部为岛叶(图4)。切除过程中面部及手活动良好,出现轻度的言语表达障碍。病灶白色,部分质韧,补血供一般,与正常脑组织边界不清,大部分切除病灶。术后MRI提示病灶深部小部分残留(图5)。术后存在部分运动性失语,1个月时言语明显好转,但仍遗留轻度障碍,3个月时言语基本恢复正常,一直无癫痫发作。
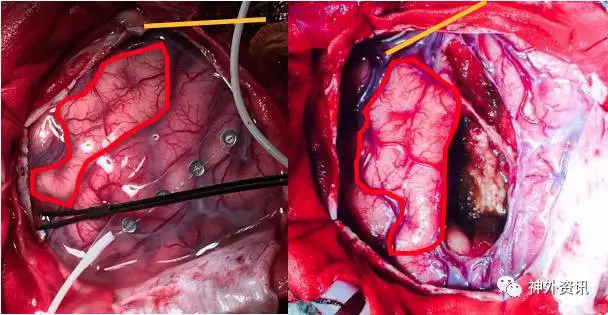
图4. 手术中图片,红线圈内为中央前回的面部运动区,黄线条标记侧裂位置。
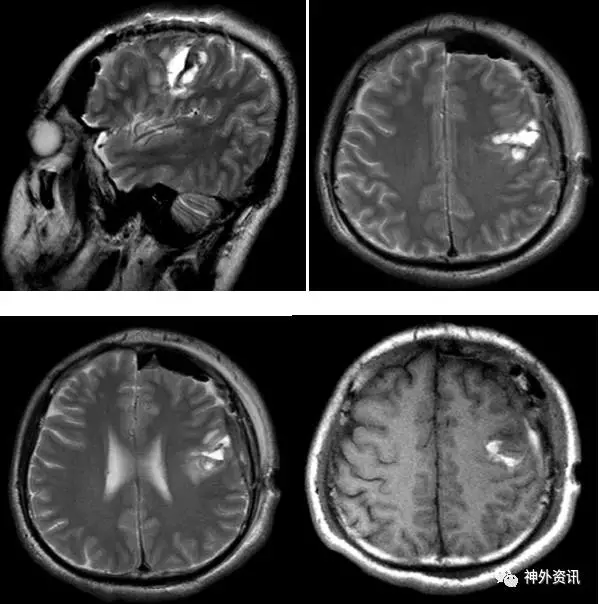
图5. 术后MRI提示病灶所在脑回切除,深部少部分病灶残留(T2像)。
病理
病理报告:组织学呈富于血管的胶质细胞增生,细胞温和,较一致,胞浆丰富,突起细长;胞核圆形椭圆形,核膜明显,可见小核仁。灶性钙化,并见散在神经元样细胞。未见核分裂,未见坏死,未见Rosenthal纤维及嗜酸性颗粒小体。结合免疫组化结果: GFAP +,S-100 +,Vimentin +,EMA +,NF 见阳性纤维,CD99 +,Ki-67 <5%+,P53 -,IDH1 R132H -,NeuN 散在+,Syn +(图6)。我院考虑低级别胶质肿瘤,需要鉴别的有毛细胞性星形胶质瘤,节细胞胶质瘤,血管中心性胶质瘤及室管膜瘤。故申请UCLA会诊。
UCLA会诊诊断:(右额叶)低级别胶质瘤,倾向血管中心性胶质瘤,WHO I级。
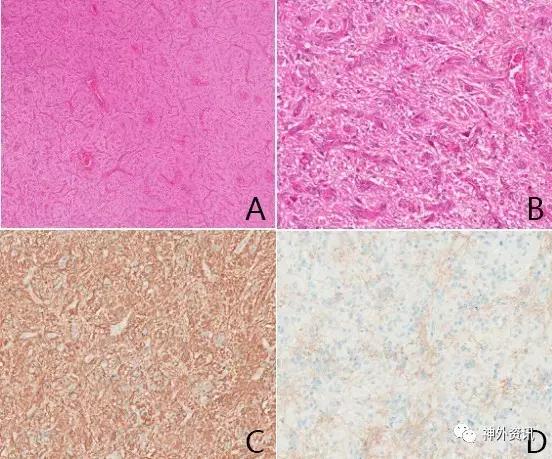
图6. A: 富于血管肿瘤;B: 肿瘤细胞温和,可见细长纤维并见散在神经元;C: GFAP弥漫阳性;D: EMA散在核旁点状阳性。
讨论
血管中心性胶质瘤是近年来发现的难治性癫痫相关的一种良性实体性脑肿瘤,2007 年被 WHO 神经系统肿瘤分类纳入并具体描述,临床多以癫痫发作为首发及主要症状,药物大多难以控制。鉴于血管中心性胶质瘤生长缓慢,增生潜能低,完全切除后症状可明显改善,且肿瘤无复发,故 WHO 将其分级定为I级。临床表现上血管中心性胶质瘤多见于儿童及青年人,约 84% 的患者在 18 岁以前出现症状。肿瘤常位于皮质或皮质下白质,90% 以上的患者有长期的癫痫发作史。血管中心性胶质瘤单发,主要位于幕上浅表脑实质,最常见于颞叶,其次是额叶[1]。
影像学上,血管中心性胶质瘤累及皮质及白质,弥漫性生长边界不清者常见,CT 检查钙化少见,多不强化。MRI上T2及FLAIR像呈高信号,但T1像信号多变,以低信号多见[1]。本例患者CT提示有散在钙化,MRI符合上述表现。
病理学上,其典型镜下特点是弥漫浸润性的单形双极梭形肿瘤细胞(核细长,染色质颗粒状,核仁不明显,嗜酸性胞质丰富)呈现出明显的血管中心性,沿血管长轴和(或)血管周围单层或多层袖套样排列,形成室管膜瘤样的假菊形团状结构。肿瘤细胞有轻度的细胞异型性,无明显的核分裂、小血管增生以及坏死组织。肿瘤细胞增殖速率低,Ki-67 指数一般低于 1% - 5%,但近来的一些报道发现其增殖速率可以增高,认为其可能有恶性分化的潜质[1]。
血管中心性胶质瘤组织学上有室管膜瘤分化特征,免疫组化不仅GFAP弥漫强阳性,EMA也可见核旁点状阳性(见于通常的室管膜瘤),超微结构上也有室管膜分化证据(肿瘤微腔隙中有微绒毛以及肿瘤细胞细长的中间连接)。但血管中心性胶质瘤和经典室管膜瘤之间的关系仍不明。现推测肿瘤是从胚胎发育过程中的双极放射状胶质细胞异常发育或瘤变而来,而可能会呈现类似室管膜胶质细胞特征或产生室管膜细胞[2]。
在分子遗传学方面,血管中心性胶质瘤研究较少,未发现IDH1, IDH2,及BRAF V600E的突变。但在最近的报道发现在研究的19例血管中心性胶质瘤中均存在MYB1重排,并且主要是MYB-QKI融合。通过体内外试验提示MYB-QKI融合很可能是血管中心性胶质瘤特异的驱动事件[3]。
血管中心性胶质瘤手术首选,肿瘤完全切除后预后好,绝大部分患者癫痫发作可完全缓解。Shakur等[4]报道了3例儿童血管中心性胶质瘤,2例首发症状为癫痫,手术全切后随访6-24个月,均疗效良好。Ampie等[5]荟萃分析目前已报道的88例患者,86%表现为癫痫,69%位于额叶或颞叶,54例全切,16例次全切,随访时5例(5.7%)肿瘤复发。
目前定位语言功能区的金标准仍是电刺激,本例通过术中唤醒电刺激来定位面部、手部及运动性语言区域,术中运动区定位明确,但在病灶表面皮层及周边未刺激出语言区域。位于Broca区的肿瘤可能会导致语言功能区的多变,而且并非所有的患者都能通过电刺激来定位出语言区[6]。术中切除过程中出现轻度的言语表达障碍是在切除病灶上半部分脑回深部的白质时出现,可能与切除过程中累及运动性语言区域的部分纤维连接有关。
对于伴癫痫发作的血管中心性胶质瘤,在保护功能的同时,应该尽可能全切肿瘤,尤其是肿瘤侵及的灰质,以改善术后癫痫的疗效。
参考文献
1. 章殷希,沈春红,丁美萍. 血管中心性胶质瘤的临床、影像与病理学研究现状.中华医学杂志,2014, 94卷23期:1835-1838.
2. Lellouch-Tubiana A1, Boddaert N, Bourgeois M,et al. Angiocentric neuroepithelial tumor (ANET): a new epilepsy-related clinicopathological entity with distinctive MRI. Brain Pathol. 2005 Oct;15(4):281-6.
3. Bandopadhayay P, Ramkissoon LA, Jain P,et al. MYB-QKI rearrangements in angiocentric glioma drive tumorigenicity through a tripartite mechanism. Nat Genet. 2016 Mar;48(3):273-82.
4. Shakur SF, McGirt MJ, Johnson MW, et al. Angiocentric glioma: a case series. J Neurosurg Pediatr 2009; 3(3):197-202.
5. Ampie L, Choy W, DiDomenico JD, et al. Clinical attributes and surgical outcomes of angiocentric gliomas. J Clin Neurosci 2016 Jan 8. [Epub ahead of print]
6. Chang EF, Breshears JD, Raygor KP, et al. Stereotactic probability and variability of speech arrest and anomia sites during stimulation mapping of the language dominant hemisphere. J Neurosurg 2016 Feb 19:1-8. [Epub ahead of print]
(本文由浙二神外周刊原创,郑喆副主任医师整理,朱君明主任医师审校,许晶虹副主任医师提供病理诊断意见,张建民主任终审)
往期回顾
浙二神外周刊(三十七)--垂体瘤伴发鞍结...
浙二神外周刊(三十六)--脑膜血管瘤病...
更多资讯请关注神外资讯微信公众号:neurosurgerynews



