译者:中国医学科学院北京协和医院神经外科 魏俊吉、杨泽一
● 理想情况下,在考虑了干预的潜在风险和益处以后,建议TBI患者保持临床参数在正常的生理范围内。
有效的TBI目标导向治疗的基石是将临床参数保持在正常生理范围内。其中一些参数与ICU中的患者更相关,例如脑灌注压(CPP)、ICP和部分脑组织氧合(PbtO2),而其他参数,例如氧饱和度(SpO2),适用于所有患者。实现所需参数的干预措施必须要考虑到患者的整体情况。当实现临床参数目标需要强化的治疗时,请仔细考虑每种干预措施的潜在风险和益处。表4中推荐的目标导向治疗参数代表理想范围,而不是所有场景的强制性、不惜一切代价的目标。
表4.治疗推荐的参数目标
*取决于大脑自动调节的状态
关键词:PaO₂:氧分压;PaCO₂:二氧化碳分压;ICP:颅内压;PbtO₂:部分脑组织氧合;CPP:脑灌注压;INR:国际标准化比率。
ICP设定为22 mmHg是治疗的有效初始阈值。但是,当进一步治疗的风险/益处成为问题时,例如对于具有重大风险的治疗(比如去骨瓣减压术),考虑将治疗范围设为20–25 mmHg更为合适。CPP≥60 mmHg是一个经验性目标,可根据脑自主调节状态按需进行调整。如果进行监测,建议将PbtO2控制在≥15 mmHg。
初始氧合目标包括SpO2≥94%和PaO2在80–100 mmHg内。考虑到高氧危险,除非有脑血氧测定指导,否则应避免PaO2>100 mmHg。在没有颅内高压的情况下,PaCO2和pH建议的初始目标分别为35–45 mmHg和7.35–7.45。患有严重肺部问题(例如急性呼吸窘迫综合征)的患者可能需要根据其临床状况设定肺部特定目标,例如允许性高碳酸血症,同时使用其他干预措施控制ICP升高。
需要密切监测收缩压(SBP)和平均动脉压(MAP),以避免低血压。在大多数情况下,当ICP未监测时,以SBP≥110 mmHg/MAP>80 mmHg为目标的治疗将保证足够的脑灌注1。虽然血压没有明确的临界值,但TBI患者的SBP在119 mmHg以下每下降10个点,死亡概率就会线性增加,这表明可能需要设定比之前的共识更高的目标2。体温管理的目标是维持正常体温(36–37.9°C),并积极治疗发热。
电解质管理至关重要,特别强调将钠水平保持在135–145 mEq/L范围内。预防低钠血症对于避免脑水肿加剧至关重要。频繁监测血清钠水平可能是必要的,因为TBI患者可能会出现尿崩症或抗利尿激素分泌不当综合征/脑盐耗竭综合征等症状。当使用甘露醇作为渗透剂时需要测量渗透压。
高血糖和低血糖都可能对患者预后产生不利影响。密切监测血糖水平,控制目标为100-180 mg/dL。在开始营养支持时,可能需要更频繁地监测血糖,尤其是对于确诊或疑似糖尿病的患者。
对于TBI患者,血液学监测必不可少。尽管对血红蛋白输血阈值的建议略有不同,但目前的文献和专家共识建议输血阈值为≥7 g/dL3,4。
对于TBI患者,早期评估凝血病非常重要。使用INR评估直接和间接凝血级联反应是必不可少的(INR≤1.4在大多数情况下是合适的)。使用血栓弹力图(TEG)、旋转血栓弹力测定(ROTEM)和血小板功能测定可以提供关于逆转凝血病的更多信息以实现靶向治疗需求。
1.Spaite DW, Hu C, Bobrow BJ, et al. Mortality and prehospital blood pressure in patients with major traumatic brain injury: Implications for the hypotension threshold. JAMA Surg. 2017 Apr 1;152(4):360–368. doi:10.1001/jamasurg.2016.4686. PMID: 27926759; PMCID: PMC5637731.
2.Hasler RM, Nüesch E, Jüni P, Bouamra O, Exadaktylos AK, Lecky F. Systolic blood pressure below 110 mmHg is associated with increased mortality in penetrating major trauma patients: Multicentre cohort study. Resuscitation. 2012 Apr;83(4):476–481. doi: 10.1016/j.resuscita-tion.2011.10.018. PMID: 22056618.
3.Robertson CS, Hannay HJ, Yamal J-M, et al. Effect of erythropoietin and transfusion threshold on neurological recovery after traumatic brain injury: A randomized clinical trial. JAMA. 2014 Jul 2;312(1):36–47. doi:10.1001/jama.2014.6490.
4.ACS Committee on Trauma. ACS TQIP Massive Transfusion in Trauma Guidelines. 2014. https://www.facs.org/media/zcjdtrd1/transfusion_guildelines.pdf. Accessed May 12, 2024.
译者:中南大学湘雅医院神经外科 刘劲芳、范凡、刘子源
● 颅内压监测很重要,但是不能替代TBI患者的神经系统体查和影像学检查。
● 对于初次CT扫描有结构性脑损伤的昏迷(GCS≤8)患者推荐进行ICP监测。
● 颅内压监测的金标准是采用带脑室外引流(EVD)的压变探头,这种方式既具有诊断价值又具有治疗价值。脑实质监测探头也能应用于颅内压监测。
● 对于儿童患者,采用EVD或脑实质探头进行颅内压监测具有相似的临床预后。虽然EVD有利于降低颅内压,但是因为技术方面的原因,一些特殊的病例需要选择脑实质探头。
● 基于与成人不同的ICP与CPP范围,儿童患者的目标颅内压低于成人。根据回顾性的研究证据,20 mmHg推荐作为儿童颅内压的上限,而采用其他的上限值预后未见改善。
持续性的颅内增高提示不良预后。脑灌注压(CPP)是一项重要的脑血流(CBF)指标,而CPP是由ICP推导而来(MAP-ICP=CPP),因此ICP监测尤为重要。CPP的升高有利于改善脑灌注和氧的输送。ICP监测也能预警结构性脑损伤(例如脑挫伤或血肿进展、脑水肿增加和术后并发症)。
对于初次CT扫描有结构性脑损伤的昏迷(GCS≤8)患者推荐进行ICP监测。在如下的其他患者也要考虑进行ICP监测:
● GCS>8分的患者,如果有脑结构的损伤并且进展风险高(如大的或多发的脑挫伤)
● GCS>8分的患者,如果ICP监测有利于其它脏器的管理(如骨科损伤需要早期手术治疗,或者急性呼吸衰竭进行俯卧位治疗有可能导致ICP增高)
● 患者CT扫描显示损伤病灶有进展的征象或临床出现恶化
● 患者颅外损伤需要紧急手术,或者因为气道损伤或呼吸衰竭进行机械通气时需要进行镇静治疗
如果没有结构性脑损伤的证据,或初次CT扫描无颅内压增高的证据(如基底池受压或消失),昏迷的患者通常无ICP监测的指征。这些患者没有颅内压监测则需要持续地密切观察,包括神经系统检查和连续的CT扫描。
明确存在颅内压升高时,患者可能需要进一步影像学复查、药物干预或手术治疗。明确颅内压没有升高时,TBI患者的管理也可以适当“降级”,如进行颅外损伤的早期手术治疗、减少镇静或拔除气管插管等等。一旦开始颅内压监测,无论患者转出ICU行颅外手术还是各类检查操作,都应保持颅内压监测。
颅内压监测在重型颅脑损伤患者的管理中一直是关键的一环。然而,如何最大化颅内压监测的效果仍有待商榷。在迄今最大规模的颅内压监测相关研究(ACS TQIP)中,通过观察参与单位的数据,人们发现使用颅内压监测可以降低住院期间死亡率1。在世界各地,不同医院和医生使用颅内压监测的习惯和管理方式大相径庭。一项大型国际前瞻性观察队列研究(SYNAPSE-ICU)发现使用ICP监测的患者往往有更激进的治疗方案,且其中重症患者的6个月死亡率更低2。通过颅内压监测指导重型颅脑创伤患者颅内高压的治疗,并为此类患者带来潜在的长期临床获益。
一项南美洲的随机对照试验(RCT)比较了通过颅内压监测将ICP维持在≤20 mmHg与基于影像学和神经体查管理患者的疗效差别3。尽管组间结果未见显著差异,但其结果证实了及早发现颅内高压的重要性——无论是借助ICP监测或是频繁的临床和影像学检查4。这项研究的发现还挑战了依赖固定ICP阈值判断病情的观点。目前广为接受的ICP警报阈值为22 mmHg(此阈值在20到25 mmHg均有意义),超过此阈值且持续超过5分钟应进行降颅压治疗。然而,有研究表明,该阈值依赖于患者的个体因素,如损伤类型和严重程度等。ICP的“剂量”(ICP升高的幅度和时间)可能比固定的ICP阈值更为重要。ICP剂量升高与整个格拉斯哥预后评分(GOS)下降相关,且不仅限于死亡率5。
进一步治疗颅内高压的决策应基于ICP升高的水平和持续时间。例如在RESCUE-ICP研究中,研究者证实应在颅内压升高到更高阈值或颅内压剂量更高后才提升治疗的层级(如去骨瓣减压术)6。ICP在一段时间内的趋势比瞬时ICP值更重要。需要区分ICP的逐渐上升是高原波还是由于呼吸机对抗导致的ICP短期升高,同时将ICP值与动脉血压、脑灌注压(CPP)和自我调节功能结合进行解读(详见“神经监测”章节)。基于不同的损伤类型,结合先进的神经监测,可能指导此类患者的个体化治疗。
监测ICP的金标准是采用带脑室引流管(EVD)的压变探头。将探头放置于脑室中部,其优势在于可以测量全脑的ICP,并可引流脑脊液(CSF)降低颅内压。脑实质内ICP监测也是一种可靠的方法,但无法引流脑脊液。硬膜下和硬膜外探头由于准确性较低,目前不推荐使用。
尽管ICP监测被推荐应用于重型颅脑创伤患者,但是上述推荐并不总适用于老年患者。老年患者有一定程度的脑萎缩,故颅内高压的风险通常较低。针对老年TBI患者应用ICP监测的研究不多。不同研究人群中,老年患者ICP监测率为5-44%7,8。有一些观察性研究报道接受ICP监测的老年患者(大于65岁)死亡率更低,而另一些研究却表明ICP监测与老年患者不良预后(严重残疾、植物状态或死亡)相关9-13。近期一项大型观察性研究表明,在多个大型创伤中心里,即使满足脑创伤基金会(BTF)的监测标准,老年患者的ICP监测率仍较低。老年患者行ICP监测是否有益于生存或功能预后还有待进一步的研究阐明14。
基于回顾性资料,儿童专家共识和指南建议对儿童重型TBI患者进行ICP监测。尽管某些针对儿童患者的研究报道ICP监测未能改善生存,甚至增加不良预后,但这些研究都未能控制好ICP监测组和非监测组之间的变量。近期有回顾性研究表明,脑实质型ICP监测对长期预后的影响与EVD监测的影响相当。然而,在急性期,EVD有助于部分降低颅内压从而有治疗获益15。这些研究表明,ICP监测技术的选择需要考虑到不同临床情况(例如年龄和其他因素)影响下的具体风险和获益。
正常CBF存在年龄依赖的变异性,而这一变异性与脑发育过程中的代谢水平变化密切相关。根据儿童年龄不同,CBF变异将影响脑血管自主调节、ICP、SBP和CPP之间的关系。对于儿童患者,经年龄修正后的最适MAP以及CPP通常比成年人更低。此外,儿童患者的最适CPP和ICP的范围窗更窄。基于治疗的研究表明,对于6-17岁的儿童,目标CPP>50 mmHg,而对于0-5岁的儿童,目标CPP>40 mmHg,似乎是合适的CPP目标范围16。对于儿童患者,ICP干预目标值目前暂限定于20 mmHg,这和先前研究设定20 mmHg作为干预阈值有关。现有文献尚不足以支持对于儿童患者使用低于20 mmHg作为ICP管理目标,此问题未来需要进一步研究。
1.Alali AS, Fowler RA, Mainprize TG, et al. Intracranial pressure monitor- ing in severe traumatic brain injury: Results from the American College of Surgeons Trauma Quality Improvement Program. J Neurotrauma. 2013 Oct 15;30(20):1737–1746. doi: 10.1089/neu.2012.2802.
2.Robba C, Graziano F, Rebora P, et al. Intracranial pressure moni- toring in patients with acute brain injury in the intensive care unit (SYNAPSE-ICU): An international, prospective observational cohort study. Lancet Neurol. 2021 Jul;20(7):548–558. doi: 10.1016/S1474- 4422(21)00138-1.
3.Chesnut RM, Temkin N, Carney N, et al. A trial of intracranial-pres- sure monitoring in traumatic brain injury. N Engl J Med. 2012 Dec 27;367(26):2471–2481. doi: 10.1056/NEJMoa1207363.
4.Chesnut RM. Intracranial pressure monitoring: Headstone or a new head start. The BEST TRIP trial in perspective. Intensive Care Med. 2013 Apr;39(4):771–774. doi: 10.1007/s00134-013-2852-9.
5.Vik A, Nag T, Fredriksli OA, et al. Relationship of “dose” of intracranial hypertension to outcome in severe traumatic brain injury. J Neurosurg. 2008 Oct;109(4):678–684. doi: 10.3171/JNS/2008/109/10/0678.
6.Hutchinson PJ, Kolias AG, Timofeev IS, et al. Trial of decompressive craniectomy for traumatic intracranial hypertension. N Engl J Med. 2016 Sep 22;375(12):1119–1130. doi: 10.1056/NEJMoa1605215.
7.Piccinini A, Lewis M, Benjamin E, Aiolfi A, Inaba K, Demetriades D. Intracranial pressure monitoring in severe traumatic brain injuries:A closer look at Level 1 trauma centers in the United States. Injury. 2017 Sep;48(9):1944–1950. doi: 10.1016/j.injury.2017.04.033. PMID: 28495204.
8.Aiolfi A, Benjamin E, Khor D, Inaba K, Lam L, Demetriades D. Brain Trauma Foundation guidelines for intracranial pressure monitoring: Compliance and effect on outcome. World J Surg. 2017 Jun;41(6):1543– 1549. doi: 10.1007/s00268-017-3898-6. Erratum in: World J Surg. 2017 Jun;41(6):1542. doi: 10.1007/s00268-017-3913-y. PMID: 28188356.
9.Alali AS, Fowler RA, Mainprize TG, et al. Intracranial pressure monitor- ing in severe traumatic brain injury: Results from the American College of Surgeons Trauma Quality Improvement Program. J Neurotrauma. 2013 Oct 15;30(20):1737–1746. doi: 10.1089/neu.2012.2802. PMID: 23731257; PMCID: PMC3796332.
10.You W, Feng J, Tang Q, et al. Intraventricular intracranial pressure monitoring improves the outcome of older adults with severe traumatic brain injury: An observational, prospective study. BMC Anesthesiol. 2016 Jul 11;16(1):35. doi: 10.1186/s12871-016-0199-9. PMID: 27401211; PMCID: PMC4940906.
11.Shimoda K, Maeda T, Tado M, Yoshino A, Katayama Y, Bullock MR. Outcome and surgical management for geriatric traumatic brain injury: Analysis of 888 cases registered in the Japan Neurotrauma DataBank. World Neurosurg. 2014 Dec;82(6):1300–1306. doi: 10.1016/j. wneu.2014.08.014. PMID: 25128777.
12.Utomo WK, Gabbe BJ, Simpson PM, Cameron PA. Predictors of in-hos- pital mortality and 6-month functional outcomes in older adults after moderate to severe traumatic brain injury. Injury. 2009 Sep;40(9):973– 977. doi: 10.1016/j.injury.2009.05.034. PMID: 19540490.
13.Dang Q, Simon J, Catino J, et al. More fateful than fruitful? Intracranial pressure monitoring in elderly patients with traumatic brain injury is associated with worse outcomes. J Surg Res. 2015 Oct;198(2):482–488. doi: 10.1016/j.jss.2015.03.092. PMID: 25972315.
14.Ghneim M, Albrecht J, Brasel K, et al. Factors associated with receipt of intracranial pressure monitoring in older adults with traumatic brain injury. Trauma Surg Acute Care Open. 2021 Jul 23;6(1):e000733. doi: 10.1136/tsaco-2021-000733.
15.Bell MJ, Rosario BL, Kochanek PM, et al. Comparative effectiveness of diversion of cerebrospinal fluid for children with severe traumatic brain injury. JAMA Netw Open. 2022 Jul 1;5(7):e2220969. doi: 10.1001/jama- networkopen.2022.20969. PMID: 24196011.
16.Allen BB, Chiu YL, Gerber LM, Ghajar J, Greenfield JP. Age-specif- ic cerebral perfusion pressure thresholds and survival in children and adolescents with severe traumatic brain injury. Pediatr Crit Care Med. 2014 Jan;15(1):62–70. doi: 10.1097/PCC.0b013e3182a556ea. PMID: 24196011.
● 颅内压升高是一个关键的可测量的继发性损伤,发现颅内压升高必须治疗以防止严重TBI后的继发性脑损伤。
● 严谨的、基于一致结论的共识,如来自西雅图国际严重创伤性颅脑损伤共识会议(SIBICC)的共识,通过改善现有证据与患者治疗需求之间的差距来补充基于循证医学的指南。
● SIBICC共识采用三层级治疗策略,通常先采用风险-收益比更佳的干预措施,然后再采用风险-收益比较差的干预措施。这种阶梯层级治疗方案将医疗决策限制在各层级内,并支持针对特定生理紊乱进行干预。
● SIBICC共识是通过严谨的、基于领域内专家的讨论得出的,推荐应用SIBICC共识会从治疗标准化中获益。但不要将SIBICC共识视为实践标准。最理想的情况是,这些共识应由当地创伤中心进行评估,并根据当地情况进行批准或调整。
如果不进行治疗,颅内压升高可能会迅速致命,可能是由于小脑幕裂孔疝和脑干受压,也可能是由于CPP显著降低导致脑缺血。在极端情况下,当升高的ICP阻止脑灌注时,脑死亡随之而来。由于其准确性,有创颅内压监测是目前管理颅内高压的首选方法。
● 颅内压监测可以发现颅脑损伤的进展,有助于颅内高压的靶向治疗。
● 它可以计算CPP和推测脑血管自主调节状态。
● 颅内压波形也可反映脑顺应性和代偿能力。
尽管基于循证医学TBI指南的实施与预后的显著改善相关,但这些指南仅限于现有科学文献中证据。在生成正式证据之前,基于Delphi的共识形成过程对于消除现有治疗方案所依据的证据之间的差距是有价值的。SIBICC使用这种严谨的共识形成过程来挖掘专家的集体智慧,发布了一个版本的TBI管理共识1,2。
SIBICC共识是对治疗的建议,而非治疗的标准。它们的目标提供全面地、基于共识的治疗方案,标准化治疗决策和尽量减少治疗的差异。完整的SIBICC共识提供了三阶梯治疗方案,并解决了以下问题:
● ICP及ICP+低脑组织氧的管理
● 不推荐进行的干预措施
● 临床神经系统恶化的定义及其处理
● 对减撤过程的建议
SIBICC共识将治疗划分为三个层级,根据相对风险-收益比,将治疗方法划分为各个层级。T0代表所有入ICU的TBI患者,无论其ICP如何,均应实施的干预措施,(例如,基本的ICU管理)。T1、T2、T3则为针对颅内高压的治疗。
使用分层治疗的指南基于三项原则:
● 在同一层级中没有等级顺序。
● 在进入下一阶梯层级前,没有必要用尽该层级中的所有处置。
● 如果认为有利,在推进治疗时可跳过某一层级(如早期开颅减压)。
分层方案为在相应层级内的制定医疗决策提供了构架。每一层级内治疗的多样性也支持对特异性生理紊乱的针对性干预(靶向治疗)。T0干预共识见表2。T1、T2、T3对ICP干预共识见表3。完整版的SIBICC I方案(ICP监测)2和SIBICC II方案(ICP + 脑氧监测)1的是开放获取的。
框2.T0-ICU基础干预-SIBICC I共识
预期措施
• 收入ICU
• 气管插管和机械通气
• 神经功能和瞳孔反射的系列评估
• 将床头抬高30-45°
• 有疼痛表现时给予镇痛(非ICP导向)
• 镇静以防止躁动、人机对抗等。(非ICP导向)
• 体温管控,防止发热
• 测量核心温度
• 核心温度高于38.0°C予以降温
• 仅考虑预防性应用抗癫痫药物1周(无继续应用适应症时)
• 维持初始CPP≥60mmhg
• 维持血红蛋白>7g/dL
• 避免低钠血症
• 保证头部静脉回流通畅(例如,保持头部中立位,颈托不能过紧)
• 持续有创动脉压监测
• SpO₂≥94%
推荐措施
• 深静脉置管
• 呼气末CO₂监测
引自: Hawryluk GW, Aguilera S, Buki A, et al. A management algorithm for patients with intracranial pressure monitoring: The Seattle International Severe Traumatic Brain Injury Consensus Conference (SIBICC). Intensive Care Med. 2019 Dec;45(12):1783–1794. doi: 10.1007/s00134-019-05805-9.已获得作者许可。
框3.SIBICC I共识对有颅内压监测患者颅内高压的阶梯治疗• PaCO₂维持在正常值下限(35-38mmHg/4.7-5.1kPa)2• 间断快速静滴甘露醇(0.25-1.0g/kg)*• 如果最初使用脑室质探头,考虑放置EVD以引流脑脊液• 仅考虑预防性应用抗癫痫药物1周(无继续应用适应症时)• 轻度过度通气(32-35mmHg/4.3-4.6kPa)• 如果有效降低ICP,在充分镇静的情况下使用肌松剂**• 采用MAP负荷†评估脑自主调节功能,指导制定MAP和CPP个体化目标(详见“神经监测”章节)。• 将目标MAP目标调整回基线(自主调节功能破坏)或调整到一个新的、较高的目标以降低ICP(自主调节功能完整)。• 给予苯巴比妥或硫喷妥钠。如果巴比妥昏迷有效,则滴定药物用于ICP控制。• 使用主动降温措施维持轻度低温(35-36°C)*推荐使用高渗盐水或甘露醇时血钠和渗透压的高限为155mEq/L和320mEq/L。
**推荐使用试验剂量的肌松药,若有效方可持续输注。
†MAP负荷方案参见开放获取的参考文献1和2。
††ICP有效降低时,可持续输注巴比妥类药物。滴定巴比妥的剂量,以控制ICP,但不要超量应用以导致爆发抑制。使用巴比妥类药物时避免低血压。
引自:Hawryluk GW, Aguilera S, Buki A, et al. A management algorithm for patients with intracranial pressure monitoring: The Seattle International Severe Traumatic Brain Injury Consensus Conference (SIBICC). Intensive Care Med. 2019 Dec;45(12):1783–1794. doi: 10.1007/s00134-019-05805-9.已获得作者许可。
SIBICC工作组列出了治疗严重TBI患者时不建议采用的治疗方法。该工作组决策包括证据明确反对的措施(例如,激素,CPP>70mmHg)和缺乏足够的支持证据的措施(例如,腰大池引流脑脊液,定时输注高渗盐水)。下面列出的措施在某些个别情况下也可考虑应用。见表4。
• 甘露醇非快速静滴,持续静脉输注
• 定时输注高渗盐水(例如,每4-6小时)
• 腰大池引流脑脊液
• 呋塞米
• 常规使用激素
• 由于全身并发症,常规治疗性低温,使体温低于35°C
• 大剂量丙泊酚以致爆发抑制
• 常规将PaCO₂降至30mmHg/4.0kPa以下
• 常规将CPP升至90mmHg以上
引自:Hawryluk GW, Aguilera S, Buki A, et al. A management algorithm for patients with intracranial pressure monitoring: The Seattle International Severe Traumatic Brain Injury Consensus Conference (SIBICC). Intensive Care Med. 2019 Dec;45(12):1783–1794. doi: 10.1007/s00134-019-05805-9.已获得作者许可。
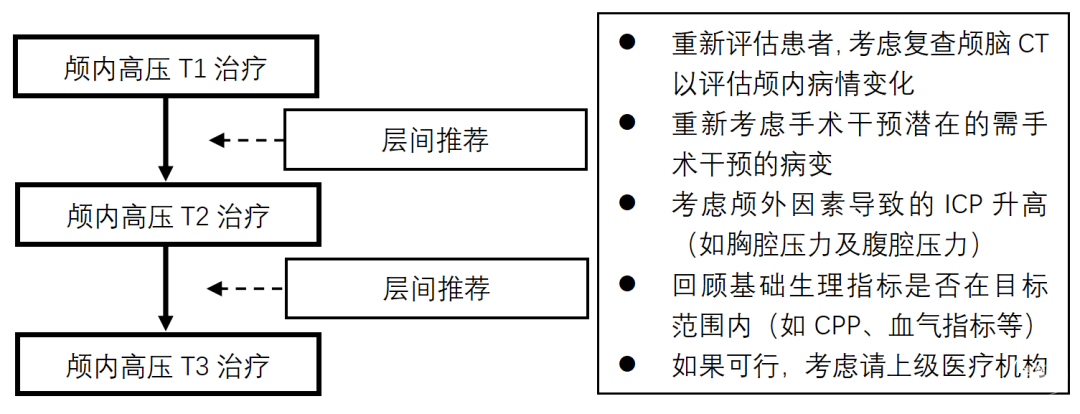
分层治疗的辅助价值是,层级框架可作为反映治疗抵抗(即疾病严重程度)的一个指标。SIBICC工作组制定了层级治疗间的推荐处置措施,以便在向下一层级治疗推进时应用(见图1)。这些处置措施旨在确保基线治疗参数的可接受性,无需要重新评估判断(如脑挫裂伤是否手术),不包括可治疗的影响ICP外部因素(如胸腔压力或腹腔压力)。如果有条件,这也是考虑会诊或转院的好时机。
对于老年人的ICP管理,需评估药物治疗策略,调整剂量以防止药物毒性和作用时间的延长。药物活性成分浓度的增加可能是由老年人的生理改变引起的,包括容量减少、药物与血浆蛋白结合减少、肝脏代谢能力下降和肾脏排泄功能减弱。合并症和先前存在的疾病,如痴呆或中风,以及药物的不良反应,也使诊断和治疗目标的制定更具挑战。老年患者可能有较慢的恢复轨迹和较差的预后,积极的治疗和良好的伤前健康状态可改善患者预后。
2019年,一个跨学科团队更新了管理儿童严重TBI的共识指南6。与SIBICC相似的阶梯治疗方案被写入这项指南,但被压缩为两个层级;分类中的细小变化并不表明有循证医学的差异。注:这些指南早于“儿童急性创伤性颅脑损伤的措施和决策(ADAPT)”这项临床研究的结果。
在少数情况下,现有证据支持对患有严重TBI的儿童采取不同的治疗方法。例如,有证据支持可使用3%生理盐水快速静滴,或按2-5 mL/kg,持续10至20分钟输注,或以0.1-1 mL/kg/h的恒定速率输注,或23.4%的浓度,0.5 mL/kg(最多30 mL),持续10至20分钟输注。支持使用甘露醇的证据较少[7]。此外,二级干预建议减少低通气将二氧化碳目标控制在28-34 mmHg7。不建议应用适度预防性低温治疗(32-33°C)以改善整体预后,但建议应用于ICP控制6,7。
图1.层间推荐
1.Galimberti S, Graziano F, Maas AI, et al. Effect of frailty on 6-month outcome after traumatic brain injury: A multicentre cohort study with external validation. Lancet Neurol. 2022 Feb;21(2):153–162. doi: 10.1016/ S1474-4422(21)00374-4.
2.Kochanek PM, Tasker RC, Carney N, et al. Guidelines for the management of pediatric severe traumatic brain Injury, third edition: Update of the Brain Trauma Foundation guidelines. Pediatr Crit Care Med. 2019 Mar;20(3S Suppl 1):S1–S82. doi: 10.1097/PCC.0000000000001735. Erratum in: Pediatr Crit Care Med. 2019 Apr;20(4):404. doi: 10.1097/ PCC.0000000000001945. PMID: 30829890.
3.Kochanek PM, Tasker RC, Bell MJ, et al. Management of pediatric severe traumatic brain injury: 2019 consensus and guidelines-based algorithm for first and second tier therapies. Pediatr Crit Care Med. 2019 Mar;20(3):269–279. doi: 10.1097/PCC.0000000000001737. PMID: 30830015.
4.Bell MJ, Adelson PD, Wisniewski SR, Investigators of the ADAPT Study. Challenges and opportunities for pediatric severe TBI—review of the evidence and exploring a way forward. Childs Nerv Syst. 2017 Oct;33(10):1663–1667. doi: 10.1007/s00381-017-3530-y. Epub 2017 Sep 6. PMID: 29149394.
5.Galimberti S, Graziano F, Maas AI, et al. Effect of frailty on 6-month outcome after traumatic brain injury: A multicentre cohort study with external validation. Lancet Neurol. 2022 Feb;21(2):153–162. doi: 10.1016/ S1474-4422(21)00374-4.
6.Kochanek PM, Tasker RC, Carney N, et al. Guidelines for the management of pediatric severe traumatic brain Injury, third edition: Update of the Brain Trauma Foundation guidelines. Pediatr Crit Care Med. 2019 Mar;20(3S Suppl 1):S1–S82. doi: 10.1097/PCC.0000000000001735. Erratum in: Pediatr Crit Care Med. 2019 Apr;20(4):404. doi: 10.1097/ PCC.0000000000001945. PMID: 30829890.
7.Kochanek PM, Tasker RC, Bell MJ, et al. Management of pediatric severe traumatic brain injury: 2019 consensus and guidelines-based algorithm for first and second tier therapies. Pediatr Crit Care Med. 2019 Mar;20(3):269–279. doi: 10.1097/PCC.0000000000001737. PMID: 30830015.
8.Bell MJ, Adelson PD, Wisniewski SR, Investigators of the ADAPT Study. Challenges and opportunities for pediatric severe TBI—review of the evidence and exploring a way forward. Childs Nerv Syst. 2017 Oct;33(10):1663–1667. doi: 10.1007/s00381-017-3530-y. Epub 2017 Sep 6. PMID: 29149394.
译者:哈尔滨医科大学附属第一医院神经外科 梁洪生、孟祥毅、范照鑫
●定期进行神经系统状态的系列临床评估为创伤性脑损伤(TBI)患者的神经监测奠定基础。
● 神经监测不只限于监测颅内压(ICP),其有助于为患者制定个体化的护理目标和治疗方案。
● 评估脑自主调节功能有助于明确患者脑灌注压(CPP)个体化目标。对于对初始(第一层级)降低ICP的治疗无反应的患者,应考虑进行神经监测。
● 无论ICP正常或升高的情况下均可能会出现脑氧合障碍。根据潜在的病理生理状态和逐级管理方法来治疗脑组织缺氧。
● 连续脑电图(EEG)监测有助于癫痫发作的诊断和管理,特别是非惊厥性癫痫发作。
定期进行神经状态的临床评估为TBI的神经监测提供了基础。可以辅以无创的方法进行监测,例如定时瞳孔测量以量化瞳孔光反射(详见“基本评估”章节)。尽管ICP监测最常用于辅助临床评估,但其他技术亦能够提供补充信息。(详见“颅内压监测”章节)。
TBI是一种具有显著异质性的复杂疾病。仅靠ICP监测无法检测到脑组织受到的所有潜在损伤,也无法根据脑组织自主调节机制的存在或缺失等因素,为患者提供个体化的护理。颅内压的自主调节机制是脑组织在一定全身血压范围内维持恒定脑血流量(CBF)的内在能力,该机制保护大脑免受低血压所致的脑缺血和可能导致ICP升高的血流增加。SIBICC共识建议在对降低ICP的初始治疗无反应的患者进行自主调节状态评估(详见框3中的一级治疗“T1”)1。
平均动脉压激发试验:在密闭颅腔内监测ICP的情况下,可进行平均动脉压(MAP)激发试验,以实现在ICU床旁评估患者脑自主调节功能。该方法在血容量正常的患者中开始或增加血管加压药的剂量,使MAP增加10-15 mmHg,持续时间不超过20分钟。需要在有经验的医务人员的直接监督下进行MAP激发试验,以确保受试者的反应和安全。在MAP激发试验期间不进行其他治疗调整。
在MAP激发试验前后记录关键生命体征及相关数据(MAP、ICP、CPP、PbtO2)。对于密闭颅腔中ICP随MAP激发实验而增加的患者,可认为该患者的脑自主调节受损,可能会在较低的CPP目标受益。相反,对于ICP随MAP激发实验而降低或无显著变化的患者,认为其脑自主调节完整,提高这些患者(尤其是ICP降低的患者)的CPP目标可能获益。
脑血管压力反应指数:另一种基于ICP的连续评估脑自主调节状态的方法是监测脑血管压力反应指数(PRx)。PRx是MAP和ICP之间回归线的斜率,可用于建立患者的个体化CPP阈值。对于脑自主调节受损的患者(PRx斜率>0.13),可考虑较低的CPP(50-60 mmHg)作为治疗目标。自主调节完整的患者(PRx斜率<0.13)可能会在较高的CPP(60-70 mmHg)中受益。值得注意的是,PRx的评估需要专门的技术和额外的硬件与软件。
脑组织氧分压:当全身氧合(PaO2)维持在恒定水平,也可以通过监测PbtO2来评估自主调节状态。在MAP激发实验前后检查动脉血气来监测该指标。
监测脑血流量:直接监测脑血流量(CBF)也可以用于在MAP激发实验中判断患者脑自主调节状态2。在脑自主调节完整的患者中,CBF对MAP增加的反应变化最小;在自主调节受损的患者中,CBF会随着MAP的增加而上升。一旦确定脑自主调节状态,可用于设定如上所述的CPP目标。同样,经颅多普勒超声和血流动力学测试也可用于评估TBI患者的脑自主调节功能。
研究发现:低PbtO2(≤15 mmHg)和颈静脉氧饱和度下降(≤50%)与患者不良结局相关3-7。需要注意的是,即使在ICP和CPP正常的情况下,脑组织也可能发生缺氧。一项基于PbtO2的重度TBI患者管理二期前瞻性RCT(BOOST II)研究中,比较了单独ICP指导的治疗与ICP和PbtO2共同指导的治疗。该研究显示,ICP + PbtO2共同管理组在脑缺氧的持续时间和严重程度上有统计学上显著降低,并在6个月时表现出降低死亡率和改善神经学结局的趋势8。然而,该试验的统计效能不足以显示结局的显著差异。几项具有一定统计效能的三期试验(BOOST III和BONANZA)正在进行中,比较单独ICP指导的治疗与ICP + PbtO₂共同指导的治疗之间的结局。最近结束的Oxy-TC试验未发现非穿透性TBI患者接受ICP + PbtO2监测治疗与仅接受ICP监测治疗的患者之间在功能结局上有差异9。
脑组织氧管理:公认的脑组织缺氧治疗阈值为15-20 mmHg8,10,11。用于改善脑组织氧合的干预措施在分层的SIBICC II共识中有详细说明,包括以下内容¹:
● 将吸入氧浓度(FiO2)提高到60%(第一层级)或将PaO2提高到150 mmHg(第二层级)
● 尝试增加镇静或神经肌肉松弛药物以改善PbtO2(第二层级)
● 根据MAP激发实验,在自主调节完整的患者中升高CPP目标(第二层级)
● 将PaO2提高到150 mmHg以上(第三层级)
● 如果在优化CPP后PbtO2仍低于20 mmHg,则输注1单位的红细胞浓缩液(第三层级)
如上所述,了解脑自主调节状态也有助于利用PbtO2来实现个体化CPP目标。但需要牢记高氧潜在的有害影响,特别是在进行第三层级治疗时。
使用脑电图(EEG)可以在床旁持续监测脑功能,有助于癫痫发作的检测和管理。它在判断非惊厥性癫痫发作方面具有重要作用,后者可能是意识水平降低的潜在原因,否则可能被忽略12。据报道,约25%的中重度TBI患者发生非惊厥性癫痫发作,可能与较差的结局和长期海马萎缩相关13,14。
EEG需要有经验的技术人员在场和有经验医生判读波形。新技术(包括定量EEG)可能减少对接受过波形解释训练的医生的需求,但并非所有创伤中心都具备如此条件。EEG的作用正在扩展到癫痫发作检测之外。虽然仍被视为实验性的,但使用深度和表面EEG有可能检测到继发性脑缺血和潜在意识障碍。
具备诊治大量重度TBI患者能力的创伤中心以及在神经重症监护方面有专业知识的中心,可尝试进行多模态神经监测,纳入至少一种除单独ICP监测之外的神经监测技术。TBI患者容量较少的创伤中心可能没有资源实施ICP监测之外的完整神经监测方案。
目前很少有文献专门讨论多模态监测在老年患者中的应用。因此,必须推断其潜在的影响。衰老生理的差异可能会影响不同监测中获得数据的可用性和对其进行的判读。
已发表的研究显示,对老年患者的侵入性ICP监测使用减少和/或使用后结局更差15,16。这些观察结果可能反映了护理积极性的差异,或由于脑容量减少而对ICP升高的怀疑减少。其他研究报告了TBI患者的年龄与侵入性测量的ICP之间的负相关。因此,“正常"ICP被认为随着年龄增长而降低17。
老化的血管对脑损伤的反应可能不同或不可预测。动脉硬化程度增加导致CBF减少和血流脉动性增加,最终结果是CBF调节受损18。直立性发作和晕厥可能使大脑处于低灌注期。然而,随着年龄增长,自主调节能力被认为是保留的19。慢性高血压使自主调节曲线右移,保护大脑免受更高的血压影响,但可能增加相对低血压时期低灌注的风险。受到随着年龄增长所发生自然变化的影像,瞳孔测量数据的解释可能会变得复杂(有关瞳孔测量的更多信息,详见“基本评估”章节)
基线EEG异常(通常是弥漫性或局灶性减缓,有时是癫痫样活动)在患有各种合并症的老年患者中很常见20。虽然这可能反映了老年患者中一定比例的脑功能障碍,但在临床状态急性变化的情况下进行的EEG解读可能会受到干扰。
在儿童中,临床检查可能更难进行,需要进行适合年龄的调整以最大限度地提高临床检查的敏感性。关于在儿童中脑组织氧合应用的数据比成人少,并且存在年龄相关的变异性。在缺少经过验证的正常阈值的情况下,尚不清楚如何在儿科患者中使用PbtO₂或自主调节测量等数据。
虽然目前连续EEG并未常规用于儿童,但一部分儿童,特别是婴儿,可能因TBI而处于特别高的癫痫发作风险中,因此,更广泛的应用EEG可能是必要的21-25。
1.Hawryluk GW, Aguilera S, Buki A, et al. A management algorithm for patients with intracranial pressure monitoring: The Seattle International Severe Traumatic Brain Injury Consensus Conference (SIBICC). Intensive Care Med. 2019 Dec; 45(12):1783–1794. doi: 10.1007/s00134-019-05805-9.
2.Rosenthal G, Sanchez-Mejia RO, Phan N, Hemphill JC III, Martin C, Manley GT. Incorporating a parenchymal thermal diffusion cerebral blood flow probe in bedside assessment of cerebral autoregulation and vasoreactivity in patients with severe traumatic brain injury. J Neurosurg. 2011 Jan; 114(1):62–70. doi: 10.3171/2010.6.JNS091360.
3.Van den Brink WA, van Santbrink H, Steyerberg EW, et al. Brain oxygen tension in severe head injury. Neurosurgery. 2000 Apr; 46(4):868–876; discussion 876–878. doi: 10.1097/00006123-200004000-00018.
4.Maloney-Wilensky E, Gracias V, Itkin A, et al. Brain tissue oxygen and outcome after severe traumatic brain injury: A systematic review. Crit Care Med. 2009 Jun; 37(6):2057–2063. doi: 10.1097/CCM.0b013e3181a009f8.
5.Oddo M, Levine JM, Mackenzie L, et al. Brain hypoxia is associated with short-term outcome after severe traumatic brain injury independently of intracranial hypertension and low cerebral perfusion pressure. Neurosurgery. 2011 Nov; 69(5):1037–1045; discussion 1045. doi: 10.1227/NEU.0b013e3182287ca7.
6.Robertson CS, Gopinath SP, Goodman JC, Contant CF, Valadka AB, Narayan RK. SjvO2 monitoring in head-injured patients. J Neurotrauma. 1995 Oct; 12(5):891–896. doi: 10.1089/neu.1995.12.891.
7.Valadka AB, Gopinath SP, Contant CF, Uzura M, Robertson CS. Relationship of brain tissue PO2 to outcome after severe head injury. Crit Care Med. 1998 Sep; 26(9):1576–1581. doi: 10.1097/00003246-199809000-00029.
8.Okonkwo DO, Shutter LA, Moore C, et al. Brain oxygen optimization in severe traumatic brain injury phase-II: A phase II randomized trial. Crit Care Med. 2017 Nov; 45(11):1907–1914. doi: 10.1097/CCM.0000000000002619.
9.Payen JF, Launey Y, Chabanne R, et al. Intracranial pressure monitoring with and without brain tissue oxygen pressure monitoring for severe traumatic brain injury in France (OXY-TC): An open-label, randomised controlled superiority trial. Lancet Neurol. 2023 Nov; 22(11):1005–1014. doi: 10.1016/S1474-4422(23)00290-9.
10.Narotam PK, Morrison JF, Nathoo N. Brain tissue oxygen monitoring in traumatic brain injury and major trauma: Outcome analysis of a brain tissue oxygen-directed therapy. J Neurosurg. 2009 Oct; 111(4):672–682. doi: 10.3171/2009.4.JNS081150.
11.Haitsma IK, Maas AI. Advanced monitoring in the intensive care unit: Brain tissue oxygen tension. Curr Opin Crit Care. 2002 Apr; 8(2):115–120. doi: 10.1097/00075198-200204000-00005.
12.Alkhachroum A, Appavu B, Egawa S, et al. Electroencephalogram in the intensive care unit: A focused look at acute brain injury. Intensive Care Med. 2022 Oct; 48(10):1443–1462. doi: 10.1007/s00134-022-06854-3.
13.Vespa PM, McArthur DL, Xu Y, et al. Nonconvulsive seizures after traumatic brain injury are associated with hippocampal atrophy. Neurology. 2010 Aug 31; 75(9):792–798. doi: 10.1212/WNL.0b013e3181f07334.
14.Vespa PM, Nuwer MR, Nenov V, et al. Increased incidence and impact of nonconvulsive and convulsive seizures after traumatic brain injury as detected by continuous electroencephalographic monitoring. J Neurosurg. 1999 Nov; 91(5):750–760. doi: 10.3171/jns.1999.91.5.0750.
15.Schupper AJ, Berndtson AE, Smith A, Godat L, Costantini TW. Respect your elders: Effects of aging on intracranial pressure monitor use in traumatic brain injury. Trauma Surg Acute Care Open. 2019; 4(1). doi: 10.1136/tsaco-2019-000306.
16.Dang Q, Simon J, Catino J, et al. More fateful than fruitful? Intracranial pressure monitoring in elderly patients with traumatic brain injury is associated with worse outcomes. J Surg Res. 2015 Oct; 198(2):482–488. doi: 10.1016/j.jss.2015.03.092.
17.Czosnyka M, Balestreri M, Steiner L, et al. Age, intracranial pressure, autoregulation, and outcome after brain trauma. J Neurosurg. 2005 Mar; 102(3):450–454. doi: 10.3171/jns.2005.102.3.0450.
18.Tarumi T, Zhang R. Cerebral blood flow in normal aging adults: Cardiovascular determinants, clinical implications, and aerobic fitness. J Neurochem. 2018 Mar; 144(5):595–608. doi: 10.1111/jnc.14234.
19.Van Beek AH, Claassen JA, Olde Rikkert MG, Jansen RW. Cerebral autoregulation: An overview of current concepts and methodology with special focus on the elderly. J Cereb Blood Flow Metab. 2008 Jun; 28(6):1071–1085. doi: 10.1038/jcbfm.2008.13.
20.Michel VH, Ourabah Z, Boudali Y, et al. The yield of routine EEG in geriatric patients: A prospective hospital-based study. Neurophysiol Clin. 2010 Nov–Dec; 40(5–6):249–254. doi: 10.1016/j.neucli.2010.08.003.
21.Liesemer K, Bratton SL, Zebrack CM, Brockmeyer D, Statler KD. Early post-traumatic seizures in moderate to severe pediatric traumatic brain injury: Rates, risk factors, and clinical features. J Neurotrauma. 2011 May; 28(5):755–762. doi: 10.1089/neu.2010.1518. PMID: 21381863.
22.Yoon SY, Choi YJ, Park SH, Hwang JH, Hwang SK. Traumatic brain injury in children under age 24 months: Analysis of demographic data, risk factors, and outcomes of post-traumatic seizure. J Korean Neurosurg Soc. 2017 Sep; 60(5):584–590. doi: 10.3340/jkns.2016.0707.008.
23.Bansal S, Kebede T, Dean NP, Carpenter JL. Predictors of acute symptomatic seizures after intracranial hemorrhage in infants. Pediatr Crit Care Med. 2014 Oct; 15(8):750–755. doi: 10.1097/PCC.0000000000000221.
24.Ates O, Ondül S, Onal Ç, et al. Post-traumatic early epilepsy in pediatric age group with emphasis on influential factors. Childs Nerv Syst. 2006 Mar; 22(3):279–284. doi: 10.1007/s00381-005-1177-6.
25.Arango JI, Deibert CP, Brown D, Bell M, Dvorchik I, Adelson PD. Post-traumatic seizures in children with severe traumatic brain injury. Childs Nerv Syst. 2012 Nov; 28(11):1925–1929. doi: 10.1007/s00381-012-1863-0.
译者:四川大学华西医院神经外科/创伤医学中心 杨朝华● 无论GCS评分如何,要在出现神经功能恶化之前清除大量的外伤性血肿。
● 对于急性SDH的清除,进行外伤大骨瓣开颅以实现最佳的损伤控制,并提供一期去骨瓣减压术(骨瓣除去)的选择。
● 血肿清除后,通过评估诸如伴随脑损伤的影响、其他的颅外损伤、ICP监测是否可用和ICU设备等因素,考虑是否可以在没有脑受压的情况下将骨瓣复位。如果骨瓣复位导致脑受压,就除去骨瓣。
● 二期去骨瓣减压术可以有效控制ICP并改善长期预后。
TBI患者通常进行手术治疗是为了清除EDH或SDH或者为了降低脑挫裂伤或脑内血肿对大脑的压力。如果确认大血肿是昏迷的可能原因并且患者有较好的康复机会,昏迷的患者在到达急诊科时应该立即进行手术。即使患者的GCS评分相对较高,也应该在血肿扩大或脑肿胀导致神经功能恶化之前清除大量的(>25 ml)外伤性血肿。较低的手术干预阈值可能适用于后颅窝损伤。因迟发血肿或血肿扩大而导致神经系统恶化的住院患者,需要立即手术清除血肿以防止神经功能进一步恶化。
对于急性SDH患者,进行大骨瓣开颅术以达到最佳的损伤控制,包括血肿清除,出血来源的识别(例如桥静脉、颞底、浅表性挫伤)和细致的止血。与脑创伤基金会(BTF)重型TBI管理指南(第4版)一致,进行大骨瓣开颅(≈12 × 15 cm)可以直视看到矢状窦旁、顶枕和颞基底区域的出血来源1。这也可以最大限度利用一期和二期减压的机会。在一些头颅较小的患者中,推荐15 cm可能太大了。但要注意,在垂直平面中至少13 cm的骨瓣为中颅窝的最佳减压提供了机会。可以考虑在颞下区和蝶骨翼进行附加的骨切除,以便扩大暴露和减压(见图2)。试图对凝固的血肿进行钻孔引流是无效的。
图2.外伤大骨瓣开颅术
由加利福尼亚州旧金山,加州大学旧金山分校Ken Probst提供
额颞顶大骨瓣开颅手术可以提供最佳直视出血来源的术野,并为一期或二期减压提供了机会。在颧弓根部的耳屏前1cm开始,做一个大的反向问号切口沿着耳廓上方向后延伸到顶结节,然后在中线旁开1.5-2cm向前到发际。肌皮瓣翻转以暴露关键孔和颧弓根部。设点钻孔以便做大骨瓣开颅术进行前颅底、中窝底减压。
去骨瓣减压术最近越来越受欢迎,是在进行额颞顶大骨瓣开颅术后骨瓣不复位。在创伤的情况下,存在两种去骨瓣减压术的适应症。
一期去骨瓣减压术:此过程涉及在急诊清除占位性损伤(通常是急性SDH)后将骨瓣去除。在出现脑肿胀的情况下,建议在清除占位性损伤后进行一期去骨瓣减压术。然而,如果下方的大脑没有受压,并且考虑了其他因素(例如,伴随脑损伤的影响,其他颅外损伤,ICP监测是否可用和ICU设备),则可以保留骨瓣。参见图3。
图3.初始手术治疗路径
由Geoffrey Manley, M.D., Ph.D.,(San Francisco General Hospital, UCSF, San Francisco, CA) 和Peter Hutchinson, F.R.C.S. (Surg. Neurol. Addenbrooke’s Hospital, University of Cambridge, UK)提供
二期去骨瓣减压术:此过程涉及去除骨瓣以控制脑肿胀以及药物难治的ICP增高。血肿、挫伤和/或弥漫性损伤的患者,没有立即手术指征的,给予内科治疗。然而,在出现难治性ICP增高(>25mmHg)的情况下,二期去骨瓣减压术被证明可以降低死亡率并随着时间的推移改善预后(24个月的数据)2,3。RESCUEicp试验预测,如果100名患者接受二期去骨瓣减压术治疗(与保守治疗相比),则有21名额外的存活者具有以下功能结局:三分之一在家外独立,三分之一在家独立,三分之一依赖(见图4)2。
图4.初始内科治疗路径
由Geoffrey Manley, M.D., Ph.D.,(San Francisco General Hospital, UCSF, San Francisco, CA) 和Peter Hutchinson, F.R.C.S. (Surg. Neurol. Addenbrooke’s Hospital, University of Cambridge, UK)提供
外伤性脑内血肿/出血性挫伤:这种情况的处理仍然存在争议。对于有占位效应和神经功能下降的患者,手术干预的决定是比较明确的。然而,对于病变较小的患者,选择早期手术以防止继发性损伤是有争议的。由于患者招募缓慢而提前终止的STITCH(外伤)试验表明,早期手术组的生存率有所提高,并且有改善功能结局的趋势,尤其是在GCS 9-12分的亚组中4。最近,在前瞻性纵向CENTER-TBI队列中研究了早期手术与保守治疗的比较。对于GCS 9-12分的外伤性脑内血肿或单独的外伤性脑内血肿患者,早期手术可改善预后,与STITCH(创伤)研究相似5。
颅骨凹陷性骨折:如果凹陷大于相邻颅骨的厚度,特别是如果位于像前额这样的美容重要区域,凹陷骨折通常进行手术整复。为了防止感染,开放性凹陷性颅骨骨折通常进行手术治疗。但是,在某些情况下可以尝试非手术治疗,仅限于那些没有硬脑膜破裂、严重污染、感染证据或额窦损伤的病例。在大多数情况下,由于无法控制的出血风险很高,硬脑膜静脉窦上的凹陷性骨折不进行手术治疗。
1.Carney N, Totten AM, O’Reilly C, et al. Guidelines for the management of severe traumatic brain injury, fourth edition. Neurosurgery. 2017 Jan 1;80(1):6–15. doi: 10.1227/NEU.0000000000001432. PMID: 27654000.
2.Hutchinson PJ, Kolias AG, Timofeev IS, et al. Trial of decompressive craniectomy for traumatic intracranial hypertension. N Engl J Med. 2016 Sep 22;375(12):1119–1130. doi: 10.1056/NEJMoa1605215. Epub 2016 Sep 7. PMID: 27602507.
3.Kolias AG, Adams, H, Timofeev IS,…et al. Evaluation of outcomes among patients with traumatic intracranial hypertension treated with decompressive craniectomy vs standard medical care at 24 months: A secondary analysis of the RESCUEicp randomized clinical trial. JAMA Neurol. 2022 Jul 1;79(7):664–671. doi: 10.1001/jamaneurol.2022.1070.
4.Mendelow AD, Gregson BA, Rowan EN, et al. Early surgery versus initial conservative treatment in patients with traumatic intracerebral hemorrhage (STITCH[Trauma]): The first randomized trial. J Neurotrauma. 2015 Sep 1;32(17):1312–1323. doi: 10.1089/neu.2014.3644.
5.van Erp IA, van Essen TA, Lingsma H, et al. Early surgery versus conservative treatment in patients with traumatic intracerebral hematoma: A CENTER-TBI study. Acta Neurochir (Wien). 2023 Nov;165(11):3217– 3227. doi: 10.1007/s00701-023-05797-y. PMID: 37747570.
● 一旦患者血流动力学稳定,最好在受伤后的24-72小时内开始启动肠内营养(EN)支持治疗。
● 在受伤后7天内逐步达到足量的营养支持治疗。
● 如果可以快速实施且不会延误EN启动的时机,那么幽门后喂养通路是更优的选择。但如果因为实施幽门后喂养遇到困难而导致EN启动被延误,那么经胃管早期启动喂养也是合理的选择。
● 当EN存在禁忌时,建议考虑实施肠外营养(PN)支持治疗。
在住院期间,TBI患者有明显的蛋白质和能量缺乏的风险,往往在康复的关键阶段,他们已经遭受到了严重的体重下降1。营养支持治疗对于满足病人的营养需求至关重要,既可以防止营养不良的发生,也能削弱TBI后的高代谢效应2,3。
脑外伤患者在受伤后会出现持续1周至数月的代谢紊乱。有报道称其能量消耗为预测基础代谢值的120%至250%4-6。肌肉活动、发热、感染和多发损伤可能会加剧患者的高代谢,而实施正常体温管理策略可能会使患者的能量消耗低于预测水平7,8。间接热量测定法是确定TBI后患者热量需求目标的最佳方法。一项针对重症和创伤患者的研究发现,颅脑损伤患者的蛋白质需求并没有比无颅脑损伤的创伤患者更高,且只需每天提供2g/kg体重的蛋白质就可以改善患者的负氮平衡9。
包括大型荟萃分析在内的很多研究表明,早期营养支持治疗可以降低患者感染发生的风险与死亡率6,10-14。在TBI后入院的前两天内启动EN,与降低肺炎发生率和缩短住院时间(LOS)有关。早期EN通常被定义为在受伤后24-72小时内启动的肠内营养治疗。我们建议将这种早期EN的启动时机(伤后24-72小时)与脑创伤基金会(BTF)关于在受伤后7天内实现足量营养支持治疗的推荐相结合15。且美国肠内和肠外营养协会也提出了类似的建议16,17。
高蛋白EN制剂是首选的,因为它可以更好地满足TBI后患者的蛋白质需求。免疫增强型肠内配方制剂可能会减少TBI患者感染的发生并改善其营养相关指标18。在小鼠模型研究和小型人类临床研究中证实了鱼油可以减少炎症应激和细胞损伤19-21。除非有相关的禁忌症,否则在临床实施中可以考虑使用添加鱼油的配方制剂。
针对TBI患者的特定研究显示,幽门后喂养可显著降低肺炎的发生率。然而,喂养量并未对其他预后指标产生影响22。临床实施过程中我们要权衡幽门后喂养的潜在获益与早期启动EN获益之间的平衡,应避免为了获得幽门后喂养通路而延迟启动EN。当存在绝对的EN禁忌症,且预计会延迟EN支持治疗的启动时,可以考虑使用PN16。然而,EN在成本效益和生理适应性方面较PN更为理想,因此EN是临床首选的一线营养支持治疗方式。如果EN确实存在禁忌,建议在受伤后72小时内启动PN支持治疗。
在已发布的指南中,重症成年患者的血糖目标范围为100-180mg/dL(5.6-10 mmol/L)。在对TBI患者的观察性研究中发现,过低或过高的血糖水平均与不良预后存在相关性23,24。
老年TBI患者伤后发生营养相关并发症的风险明显增加。在治疗期间,其营养不良(蛋白质-能量缺乏或营养不足)的发生率可高达62%,且这与很多其他并发症的发生率也存在相关性(如认知功能障碍、感染、抑郁等)。营养不良还会导致老年患者卧床时间延长、住院时间延长与再住院25。临床上对老年人的营养管理措施包括营养筛查和持续的营养状态监测26。迷你营养评估工具是全球使用最广泛的营养筛查工具,链接为https://www.mna-elderly.com/sites/default/files/2021-10/mna-mini-english.pdf)27,28。老年营养风险指数(GNRI)是另一种基于血清白蛋白水平和体重指数的适用于老年患者的营养评估方法29–31。
营养治疗的目的包括:
● 补充蛋白质和能量储备
● 维持器官功能
● 降低与营养不良相关的成本(如LOS、亚急性护理和生活质量)32
吞咽困难会增加误吸和营养不良的风险32。吞咽困难的主要危险因素是机械通气及其相关并发症33。针对吞咽困难的筛查工具包括可以在床旁进行的容积-黏度吞咽测试(volume-viscosity swallowing test,V-VST)34。
对于患有重度TBI的儿童患者,营养疗法必须考虑水分和电解质的目标,以防止电解质紊乱渗透压改变导致液体进入神经元而加重脑水肿的相关风险。用于预测能量消耗的公式可能会高估sTBI患者的实际需求。当下流行的TBI管理中的神经保护性措施(如镇静、肌松药、有效的体温调节和癫痫控制)可能会降低患者的能量消耗,甚至使其可能低于预测的基础水平35–37。
儿童特有的数据支持以下与成人标准一致的营养建议:
● 一旦患者血流动力学稳定,最好在受伤后24-72小时内开始启动EN支持治疗38,39。
● 尝试在受伤后7天内逐步实现足量的营养支持治疗38。
● 胃管通路或幽门后喂养通路都是可行的EN喂养模式,但使用幽门后喂养的患者更容易达到热卡目标,且其并不会增加喂养不耐受的并发症40。
● 对于EN禁忌的患者,考虑PN支持。
1.Chapple LA, Deane AM, Williams LT, et al. Longitudinal changes in anthropometrics and impact on self-reported physical function after traumatic brain injury. Crit Care Resusc. 2017 Mar;19(1):29–36. PMID: 28215129.
2.Bistrian BR, Askew W, Erdman JW Jr, Oria MP. Nutrition and traumatic brain injury: A perspective from the Institute of Medi- cine report. J Parenter Enteral Nutr. 2011 Sep;35(5):556–559. doi: 10.1177/0148607111416122.
3.Maxwell J, Gwardschaladse C, Lombardo G, et al. The impact of measurement of respiratory quotient by indirect calorimetry on the achievement of nitrogen balance in patients with severe traumatic brain injury. Eur J Trauma Emerg Surg. 2017 Dec;43(6):775–782. doi: 10.1007/ s00068-016-0724-z.
4.Vizzini A, Aranda-Michel J. Nutritional support in head injury. Nutrition. 2011 Feb;27(2):129–132. doi: 10.1016/j.nut.2010.05.004.
5.Gadisseux P, Ward JD, Young HF, Becker DP. Nutrition and the neuro- surgical patient. J Neurosurg. 1984 Feb;60(2):219–232. doi: 10.3171/ jns.1984.60.2.0219.
6.Young B, Ott L, Norton J, et al. Metabolic and nutritional sequelae in the non-steroid treated head injury patient. Neurosurgery. 1985 Nov;17(5):784–791. doi: 10.1227/00006123-198511000-00010.
7.Clifton GL, Robertson CS, Choi SC. Assessment of nutritional require- ments of head-injured patients. J Neurosurg. 1986 Jun;64(6):895–901. doi: 10.3171/jns.1986.64.6.0895.
8.Osuka A, Uno T, Nakanishi J, Hinokiyama H, Takahashi Y, Matsuoka T. Energy expenditure in patients with severe head injury: Controlled normothermia with sedation and neuromuscular blockade. J Crit Care. 2013 Arp;28(2):218.e9–13. doi: 10.1016/j.jcrc.2012.05.012.
9.Dickerson RN, Pitts SL, Maish GO III, et al. A reappraisal of nitrogen requirements for patients with critical illness and trauma. J Trauma Acute Care Surg. 2012 Sep;73(3):549–557. doi: 10.1097/TA.0b013e- 318256de1b.
10.Minard G, Kudsk KA, Melton S, Patton JH, Tolley EA. Early versus delayed feeding with an immune-enhancing diet in patients with severe head injuries. J Parenter Enteral Nutr. 2000 May–Jun;24(3):145–149. doi: 10.1177/0148607100024003145.
11.Härtl R, Gerber LM, Ni Q, Ghajar J. Effect of early nutrition on deaths due to severe traumatic brain injury. J Neurosurg. 2008 Jul;109(1):50– 56. doi: 10.3171/JNS/2008/109/7/0050.
12.Chiang YH, Chao DP, Chu SF, et al. Early enteral nutrition and clinical outcomes of severe traumatic brain injury patients in acute stage: A multi-center cohort study. J Neurotrauma. 2012 Jan 1;29(1):75–80. doi: 10.1089/neu.2011.1801.
13.Dhandapani S, Dhandapani M, Agarwal M, et al. The prognostic sig- nificance of the timing of total enteral feeding in traumatic brain injury. Surg Neurol Int. 2012;3:31. doi: 10.4103/2152-7806.93858.
14.Chourdakis M, Kraus MM, Tzellos T, et al. Effect of early compared with delayed enteral nutrition on endocrine function in patients with trau- matic brain injury: An open-labeled randomized trial. J Parenter Enteral Nutr. 2012 Jan;36(1):108–116. doi: 10.1177/0148607110397878.
15.Brain Trauma Foundation, American Association of Neurological Surgeons, Congress of Neurological Surgeons, et al. Guidelines for the management of severe traumatic brain injury. XII. Nutrition. J Neu- rotrauma. 2007;24(Suppl 1):S77–82. doi: 10.1089/neu.2006.9984.
16.McClave SA, Taylor BE, Martindale RG, et al. Guidelines for the provi- sion and assessment of nutrition support therapy in the adult critically ill patient: Society of Critical Care Medicine (SCCM) and American So- ciety for Parenteral and Enteral Nutrition (A.S.P.E.N.). J Parenter Enteral Nutr. 2016 Feb;40(2):159–211. doi: 10.1177/0148607115621863.
17.Compher C, Bingham AL, McCall M, et al. Guidelines for the provision of nutrition support therapy in the adult critically ill patient: The Amer- ican Society for Parenteral and Enteral Nutrition. J Parenter Enteral Nutr. 2022 Jan;46(1):12–41. doi: 10.1002/jpen.2267.
18.Painter TJ, Rickerds J, Alban RF. Immune enhancing nutrition in trau- matic brain injury—A preliminary study. Int J Surg. 2015 Sep;21:70–74. doi: 10.1016/j.ijsu.2015.07.008.
19.Chen X, Chen C, Fan S, et al. Omega-3 polyunsaturated fatty acid atten- uates the inflammatory response by modulating microglia polarization through SIRT1-mediated deacetylation of the HMGB1/NF-κB pathway following experimental traumatic brain injury. J Neuroinflammation. 2018 Apr 20;15(1):116. doi: 10.1186/s12974-018-1151-3.
20.Chen X, Pan Z, Fang Z, et al. Omega-3 polyunsaturated fatty acid atten- uates traumatic brain injury-induced neuronal apoptosis by inducing autophagy through the upregulation of SIRT1-mediated deacetylation of Beclin-1. J Neuroinflammation. 2018 Nov 8;15(1):310. doi: 10.1186/ s12974-018-1345-8.
21.Rai VR, Phang LF, Sia SF, et al. Effects of immunonutrition on biomarkers in traumatic brain injury patients in Malaysia: A prospective random- ized controlled trial. BMC Anesthesiol. 2017 Jun 15;17(1):81. doi: 10.1186/ s12871-017-0369-4.
22.Wang D, Zheng SQ, Chen XC, Jiang SW, Chen HB. Comparisons between small intestinal and gastric feeding in severe traumatic brain injury: A systematic review and meta-analysis of randomized controlled trials. J Neurosurg. 2015 Nov;123(5):1194–1201. doi: 10.3171/2014.11. JNS141109.
23.Badjatia N, Vespa P, Participants of the International Multi-disciplinary Consensus Conference on Multimodality Monitoring. Monitoring nutri- tion and glucose in acute brain injury. Neurocrit Care. 2014 Dec;21(Suppl 2):S159–167. doi: 10.1007/s12028-014-0036-2.
24.Vespa P, McArthur DL, Stein N, et al. Tight glycemic control increases metabolic distress in traumatic brain injury: A randomized controlled within-subjects trial. Crit Care Med. 2012; 40(6): 1923–1929. doi: 10.1097/CCM.0b013e31824e0fcc.
25.Dijkink S, Meier K, Krijnen P, Yeh DD, Velmahos GC, Schipper IB. Malnutrition and its effects in severely injured trauma patients. Eur J Trauma Emerg Surg. 2020 Oct;46(5):993–1004. doi: 10.1007/s00068- 020-01304-5.
26.Volkert D, Beck AM, Cederholm T, et al. Management of malnutrition in older patients—current approaches, evidence and open questions. J Clin Med. 2019 Jul 4;8(7):974. doi: 10.3390/jcm8070974.
27.Guigoz Y, Vellas B, Garry PJ. Assessing the nutritional status of the elderly: The Mini Nutritional Assessment as part of older adult evaluation. Nutr Rev. 1996 Jan:54(1 Pt 2):S59–65. doi: 10.1111/j.1753- 4887.1996.tb03793.x.
28.Kaiser MJ, Bauer JM, Ramsch C, et al. Validation of the Mini Nutritional Assessment short-form (MNA-SF): A practical tool for identification of nutritional status. J Nutr Health Aging. 2009 Nov;13(9):782–788. doi: 10.1007/s12603-009-0214-7.
29.Cereda E, Pedrolli C. The Geriatric Nutritional Risk Index. Curr Opin Clin Nutr Metab Care. 2009 Jan;12(1):1–7. doi: 10.1097/ MCO.0b013e3283186f59.
30.Lee HY, Oh BM. Nutrition management in patients with traumatic brain injury: A narrative review. Brain Neurorehabil. 2022 Mar 28;15(1):e4. doi: 10.12786/bn.2022.15.e4.
31.Su WT, Tsai CH, Huang CY, et al. Geriatric Nutritional Risk Index as a prognostic factor for mortality in elderly patients with moderate to severe traumatic brain injuries. Risk Manag Healthc Policy. 2021 June 10;14:2465–2474. doi: 10.2147/RMHP.S314487.eCollection2021.
32.Molfenter SM. The relationship between sarcopenia, dysphagia, malnu- trition, and frailty: Making the case for proactive swallowing exercises to promote healthy aging. Curr Opin Otolaryngol Head Neck Surg. 2022 Dec 1;30(6):400–405. doi: 10.1097/MOO.0000000000000835.
33.Kregel HR, Attia M, Pedroza C, et al. Dysphagia is associated with worse clinical outcomes in geriatric trauma patients. Trauma Surg Acute Care Open. 2022 Dec 5;7(1):e001043. doi: 10.1136/tsaco-2022-001043.
34.Taveira I, Silva S, Bonança Í, Parreira D, Antunes C. Recognizing dyspha- gia: Implementation of an in-hospital screening protocol. Ir J Med Sci. 2021 May;190(2):605–608. doi: 10.1007/s11845-020-02371-8.
35.Havalad S, Quaid MA, Sapiega V. Energy expenditure in children with severe head injury: Lack of agreement between measured and estimat- ed energy expenditure. Nutr Clin Pract. 2006 Apr;21(2):175–181. doi: 10.1177/0115426506021002175. PMID: 16556928.
36. Mtaweh H, Smith R, Kochanek PM, et al. Energy expenditure in chil- dren after severe traumatic brain injury. Pediatr Crit Care Med. 2014 Mar;15(3):242–249. doi: 10.1097/PCC.0000000000000041. PMID: 24394999; PMCID: PMC4703075.
37. Elliott E, Shoykhet M, Bell MJ, Wai K. Nutritional support for pediatric severe traumatic brain injury. Front Pediatr. 2022 May 17;10:904654. doi: 10.3389/fped.2022.904654. PMID: 35656382; PMCID: PMC9152222.
38. Taha AA, Badr L, Westlake C, Dee V, Mudit M, Tiras KL. Effect of early nutritional support on intensive care unit length of stay and neurological status at discharge in children with severe traumatic brain injury. J Neurosci Nurs. 2011 Dec;43(6):291–297. doi: 10.1097/ JNN.0b013e318234e9b2. PMID: 22089405.
39. Meinert E, Bell MJ, Buttram S, et al. Initiating nutritional support before 72 hours is associated with favorable outcome after severe trau-
matic brain injury in children: A secondary analysis of a randomized, controlled trial of therapeutic hypothermia. Pediatr Crit Care Med. 2018 Apr;19(4):345–352. doi: 10.1097/PCC.0000000000001471. PMID: 29370008; PMCID: PMC5886794.
40. Meert KL, Daphtary KM, Metheny NA. Gastric vs small-bowel feeding in critically ill children receiving mechanical ventilation: A random- ized controlled trial. Chest. 2004 Sep;126(3):872–878. doi: 10.1378/ chest.126.3.872. PMID: 15364769.
译者:天津市环湖医院神经外科 张国斌、刘俊、张述升
● 对于意识水平降低(即GCS<9)、严重躁动、气道保护性反射丧失或胸部和腹部损伤而GCS>8的患者,建议早期气管插管和机械通气。
● 调整呼吸机设置,以确保动脉pH值保持7.35-7.45,PaCO2为35-45 mmHg(在没有颅内高压和/或严重代谢性酸中毒的情况下),血氧饱和度至少为94%。
● 神经重症监护患者的气管拔管可能具有挑战性。当ICP增高得到解决、最后一次CT扫描未见到进展性病变、并且患者能够控制上气道反射和咳嗽时,可考虑拔管。
早期插管和机械通气是意识水平下降(即GCS<9)、严重躁动和气道保护性反射丧失患者TBI管理的基石。其目的是避免缺氧、控制二氧化碳水平、并将误吸的风险降至最低。由于可能相关的脊髓损伤,故在气管插管期间请保护颈椎。插管后,通气目标为维持动脉pH 7.35-7.45、PaCO2 35-40 mmHg(在没有ICP增高和/或严重代谢性酸中毒的情况下)和血氧饱和度至少94%。
● PaO2的最佳目标范围为80–100 mmHg。如果神经监测(例如以脑组织氧指标为靶向的方法)有指导下则可以更高些。
● 对于没有ICP升高的患者,PaCO2的最佳目标范围是35-45 mmHg。
轻度过度通气(PaCO2为32-35 mmHg)被建议作为SIBICC二级治疗,用于控制高ICP或在神经系统恶化(钩回疝)期间1。在存在难治性严重ICP增高的情况下,或者当检测到先兆或实际的脑疝(例如瞳孔放大无反应)时,将PaCO2降低到30 mmHg以下可能是一种临时措施,同时采取其他干预措施(包括手术)。然而,仅可将这种深度过度通气视为一种抢救措施,并尽可能短地使用,因为它可能导致动脉痉挛和CBF降低1。此处指示的PaCO2水平可以通过连续的呼气末CO2监测以获取,同时应认识到动脉呼气末CO2梯度在病患和个体之间随时间而变化。在大多数情况下,即便有高颅压存在、<10 cmH2O的中等水平呼气末正压(PEEP)将不会进一步升高ICP。当伴有ICP监测时,可以安全地使用它来维持氧合2。
在TBI的背景下,尚未系统地研究严重/难治性通气衰竭的抢救疗法,例如俯卧位、神经肌肉阻滞剂和体外膜肺氧合(ECMO)。因为必须要监测和控制其对颅内容物体积和颅内出血的影响,故须谨慎地根据个体情况应用它们。ECMO越来越多地用于急性呼吸窘迫综合征的严重多发性创伤患者。与静脉-心房ECMO相比,在患者全身氧合对常规管理无反应的选定性监测病例中、无抗凝治疗的静脉-静脉ECMO被证明具有生存获益3。
气管拔管仍然是具有挑战性的4。在后叙情况下,拔管成功的几率会增加:
● GCS运动评分为6分
● 正常的呼吸驱动
● 稳定的颅内状况
● 气道保护性反射完整(咳嗽反射活跃、呕吐反射和吞咽尝试)
● 气管内吸痰≤每小时2次
统一预测TBI患者气管拔管成功的困难意味着:一些患者可能会在尝试气管拔管仍可能需要重新插管。如果气管拔管失败或由于缺乏安全标准而无法拔管,则必须评估是否需要气管切开术。
作为一般规则,存在严重TBI的老年病人机械通气的决策和管理与年轻患者相同。在决定是否提供侵入性支持时,请考虑个体患者的管理目标。尽管缺氧显然对任何年龄的严重TBI患者有害,但对于脑萎缩和ICP增高风险相对较低的患者来说、使用机械通气来严格控制CO₂可能并不那么重要。然而,因老年患者可能有基础口咽功能障碍,这使得TBI后的早期插管显得更加合适。老年患者的气管插管和机械通气与年轻患者具有相同的风险。
有关TBI后机械通气的儿科特定文献或指南尚无发表。对于需要插管的TBI患儿,首选使用带囊气管插管以促进最佳通气策略并最大限度地降低误吸风险。总体而言,推动TBI儿童通气管理的一般生理因素与成人是相近的。
1.Chesnut R, Aguilera S, Buki A, et al. A management algorithm for adult patients with both brain oxygen and intracranial pressure monitoring: The Seattle International Severe Traumatic Brain Injury Consensus Conference (SIBICC). Intensive Care Med. 2020 May;46(5):919–929. doi: 10.1007/s00134-019-05900-x.
2.Robba C, Poole D, McNett M, et al. Mechanical ventilation in patients with acute brain injury: Recommendations of the European Society of Intensive Care Medicine consensus. Intensive Care Med. 2020 Dec;46(12):2397–2410. doi: 10.1007/s00134-020-06283-0.
3.Zonies D, Codner P, Park P, et al. AAST Critical Care Committee clinical consensus: ECMO, nutrition. Trauma Surg Acute Care Open. 2019 Apr 3;4(1):e000304. doi: 10.1136/tsaco-2019-000304.
4.Cinotti R, Mijangos JC, Pelosi P, et al. Extubation in neurocritical care patients: The ENIO international prospective study. Intensive Care Med. 2022 Nov;48(11):1539–1550. doi: 10.1007/s00134-022-06825-8.
● 考虑一周内病情改善不明显的重度TBI患者,应尽早气管切开。
● 早期气管切开可以降低长期机械通气和肺炎的风险。
ICU中重度TBI患者通常需要长期机械通气,原因如下:
● 咽反射减弱或丧失
● 过多的分泌物
● 呼吸机不同步
● 氧气和二氧化碳交换受损
● 严重的躁动
● 严重的复合伤,包括面部、气道或胸部损伤
当患者的意识水平持续加深时,应考虑行气管切开术,以确保气道通畅,并减少与呼吸机相关的肺炎和肺损伤的风险。
尽管没有明确证据表明早期气管切开术对患者存活有益,但研究显示它可以减少TBI患者在ICU和医院的住院天数。气管切开术没有绝对禁忌症,但相对禁忌症包括以下情况:无法控制的颅内高压、血流动力学不稳定,以及需要吸入高浓度氧气(FiO2>50%)和高呼气末正压(PEEP>10 cmH2O)的严重呼吸衰竭1。气管切开患者接受长期机械通气的其他获益还包括改善患者舒适度,减少口咽部刺激,以及改善肺部卫生。这些因素也有利于患者尽早脱离机械通气2。最近的一项研究显示,重度TBI患者的气管切开术发生率为31.8%。其中41%的气管切开术在受伤后7天内进行,26%的气管切开术在受伤14天后3。这表明各临床中心在气管切开术的时机上存在显著差异3。脑创伤基金会(BTF)第四版指南针对重度TBI患者提供了IIA级的推荐,建议尽早进行气管切开术以缩短通气天数。然而,该建议并未提及与之相关的死亡率或肺炎的减少4。目前针对TBI患者推荐行外科气管切开术或经皮气管切开术的证据有限。然而,经皮气管切开术操作被认为是安全且耐受性良好。建议在伤后7天内不太可能脱离呼吸机的重度TBI患者考虑尽早进行气管切开术5。
多项研究报告显示,老年患者接受气管切开术的可能性较低6,7。老年患者气管切开术的时机相比年轻患者,通常在住院治疗的后期进行7。报道称,老年患者行气管切开术与较低的住院死亡率有关7。气管切开术和经口插管都是导致吞咽困难的独立风险因素,这是受伤老年人常见的并发症8。对于重度TBI的老年患者进行气管切开术,必须权衡患者的治疗目标。
一项单中心和北美国家数据库对儿童气管切开的时机进行了回顾性研究9。与成人证据相似,建议早期进行气管切开术以减少儿童TBI患者在ICU的并发症和住院时间9-11。然而,关于虐待致头部创伤婴儿进行气管切开术的时机,缺乏相关的证据10。青少年可能会像成人一样从早期气管切开术中获益。
10岁以下的儿童可能在气管切开术的风险特征上有所不同。因此,将成人和青少年在TBI后早期气管切开术的好处推广到年幼的儿童和婴儿可能是不恰当的。此外,儿童气管切开术的技术和并发症可能与成人不同。在10岁以下的儿童中,与成人在ICU中的使用频率相比,经皮气管切开技术并不常用12-14。气道解剖结构以及可用于儿童的气管切开设备也有所不同。例如,儿科气管套管是单腔且不带有开孔,并且合适的套管尺寸变化更大13。
1.Marra A, Vargas M, Buonanno P, Iacovazzo C, Coviello A, Servillo G. Early vs. late tracheostomy in patients with traumatic brain injury: Systematic review and meta-analysis. J Clin Med. 2021 Jul 28;10(15):3319. doi: 10.3390/jcm10153319.
2.De Franca SA, Tavares WM, Salinet AS, Paiva WS, Teixeira MJ. Early tracheostomy in severe traumatic brain injury patients: A meta-analysis and comparison with late tracheostomy. Crit Care Med. 2020 Apr;48(4):e325–e331. doi: 10.1097/ccm.0000000000004239.
3.Robba C, Galimberti S, Graziano F, et al. Tracheostomy practice and timing in traumatic brain-injured patients: A CENTER-TBI study. Intensive Care Med. 2020 May;46(5):983–994. doi: 10.1007/s00134-020-05935-5.
4.Carney N, Totten AM, O’Reilly C, et al. Guidelines for the management of severe traumatic brain injury, fourth edition. Neurosurgery. 2017 Jan 1;80(1):6–15. doi: 10.1227/NEU.0000000000001432. PMID: 27654000.
5.Zahari Y, Wan Hassan WM, Hassan MH, Zaini RH, Abdullah B. The practice, outcome and complications of tracheostomy in traumatic brain injury patients in a neurosurgical intensive care unit: Surgical versus percutaneous tracheostomy and early versus late tracheostomy. Malays J Med Sci. 2022 Jun;29(3):68–79. doi: 10.21315/mjms2022.29.3.7.
6.Humble SS, Wilson LD, McKenna JW, et al. Tracheostomy risk factors and outcomes after severe traumatic brain injury. Brain Inj. 2016;30(13–14):1642–1647. doi: 10.1080/02699052.2016.1199915.
7.Carlson KA, Dhillon NK, Patel KA, et al. Utilization of tracheostomy among geriatric trauma patients and association with mortality. Eur J Trauma Emerg Surg. 2020 Dec;46(6):1375–1383. doi: 10.1007/s00068-019-01199-x.
8.Nieto K, Ang D, Liu H. Dysphagia among geriatric trauma patients: A population-based study. PLoS One. 2022 Feb 8;17(2):e0262623. doi: 10.1371/journal.pone.0262623.
9.Holloway AJ, Spaeder MC, Basu S. Association of timing of tracheostomy on clinical outcomes in PICU patients. Pediatr Crit Care Med. 2015 Mar;16(3):e52–58. doi: 10.1097/PCC.0000000000000336. PMID: 25581633.
10.McLaughlin C, Darcy D, Park C, et al. Timing of tracheostomy placement among children with severe traumatic brain injury: A propensity-matched analysis. J Trauma Acute Care Surg. 2019 Oct;87(4):818–826. doi: 10.1097/TA.0000000000002237. PMID: 30882764; PMCID: PMC6744364.
11.Sheehan BM, Grigorian A, Gambhir S, et al. Early tracheostomy for severe pediatric traumatic brain injury is associated with reduced in tensive care unit length of stay and total ventilator days. J Intensive Care Med. 2020 Nov;35(11):1346–1351. doi: 10.1177/0885066619870153. Epub 2019 Aug 27. PMID: 31455142.
12.Raju A, Joseph DK, Diarra C, Ross SE. Percutaneous versus open tracheostomy in the pediatric trauma population. Am Surg. 2010 Mar;76(3):276–278. doi: 10.1177/000313481007600307. PMID: 20349656.
13.Watters KF. Tracheostomy in infants and children. Respir Care. 2017 Jun;62(6):799–825. doi: 10.4187/respcare.05366. PMID: 28546379.
14.Pacheco AE, Leopold E. Tracheostomy in children: Recommendations for a safer technique. Semin Pediatr Surg. 2021 Jun;30(3):151054. doi: 10.1016/j.sempedsurg.2021.151054. Epub 2021 May 23. PMID: 34172211.
译者:华中科技大学同济医学院附属同济医院神经外科 赵恺、李宇
● 对于TBI合并颅外损伤的患者,在决定是否进行颅外损伤的手术时,应权衡急诊手术的必要性和颅高压的风险。
● 除非是抢救生命的手术,否则对已存在颅高压或颅内压增高风险极高的患者都应推迟颅外的手术。
● 如果患者已实施ICP监测且ICP控制良好,或ICP升高并不需要处理,临床医生可在患者入院后48小时内进行必要的骨科固定手术和其他需要急诊完成的手术。
● 避免腹腔镜手术,因为腹腔镜手术会升高腹内压和诱发高碳酸血症。
● 在全麻手术期间应进行严密的监测,避免出现ICP升高、低血压、缺氧、低碳酸血症或高碳酸血症。
多发伤患者的死亡率通常取决于头部损伤的严重程度1。即使是中型TBI,如果伴有颅外器官的损伤,预计死亡率也会增加一倍2。对于重型TBI合并多发伤的患者,颅外损伤的最佳手术方案仍需要经过多学科讨论制定系统的治疗策略。在影像学检查和临床处理前,必须优先保证血流动力学稳定。当患者血流动力学稳定时,神经系统损伤应优先处理。当患者因创伤出血而导致血流动力学不稳定时,首要任务是积极抢救和控制出血。
颅外损伤的手术目标包括预防多器官功能衰竭和降低继发性脑损伤两方面。最近的一项大型队列研究发现,对于CT阳性的急性TBI患者实施颅外的手术和麻醉,术后2周和6个月的功能预后明显较差3。
麻醉注意事项:确保在麻醉期间进行严密监测,以避免低血压、缺氧、低碳酸血症或高碳酸血症。仅术中低血压就可能使患者死亡率增加一倍4。如果使用ICP监测,应将CPP维持在60 mmHg5。由于吸入麻醉药会影响ICP,因此手术通常选择静脉麻醉。对于颅高压患者,神经轴区域麻醉(如脊髓和硬膜外麻醉)是禁忌症,然而外周神经阻滞(无论是间断还是连续)可以发挥镇痛和辅助加速手术操作的作用,因而可以使用。
手术的时机:损伤控制骨科手术的理念是指在患者病情初步稳定后尽早行外固定手术,而推迟标准的骨科固定手术,旨在将早期骨科手术可能导致的所谓神经系统“二次损伤”的风险降至最低10-12。最近提出的安全标准手术的概念,是在早期骨科手术和损伤控制骨科手术之间取得平衡13。通过反复评估患者生理情况和临床病情的变化,将其分为稳定、临界、不稳定或濒死,从而优化手术时机。
在不违背以下治疗原则的情况下,骨科手术(主要指长骨的修复手术)时机似乎对严重TBI患者的总体预后并没有影响6-9。对于颅高压患者,除非需要抢救生命否则应尽可能推迟手术。对于需要进行开腹或开胸手术的患者,应避免造成继发性脑损伤的原则。尽可能避免腹腔镜手术,尤其是在早期,因为腹腔镜手术会使腹腔内压力升高并诱发高碳酸血症14,15。但是高碳酸血症对TBI患者长期神经功能的影响仍有争议。大多数面部骨折不会危及生命,不需要紧急干预;但此类患者容易出现呼吸窘迫。ICU常规治疗(如气管切开术和经皮内镜胃造口术)可在患者病情稳定后进行。脊柱骨折脱位的手术时机可能取决于脊柱的稳定性以及脊髓损伤患者是否需要进行紧急脊髓减压。
近年来多发伤患者的平均年龄不断增加16。众所周知重型TBI和年龄>65岁是住院患者死亡的独立预测因素。由于老年患者可能存在较多合并症,神经或精神系统疾病病史,和长期抗血小板或抗凝治疗病史17,因此与伤情相仿的年轻患者相比,老年多发伤患者损伤可能更严重,LOS更长,死亡率更高16。在考虑实施颅外手术时应权衡以上情况,以避免这些情况影响手术时机和手术策略。
儿童TBI患者更易合并多发伤,而且至少1/3的重型TBI患儿还需要进行颅外损伤的手术治疗18。TBI的严重程度也是多发伤患儿预后的主要影响因素,这一点与成人研究结果相似19。目前尚无确切数据表明儿童颅外损伤的手术策略与成人不同。因此,对于TBI合并颅外损伤的患儿的处理,也应优先考虑稳定血流动力学状态,尽可能减少继发性脑损伤20,21。
1.Lefering R, Paffrath T, Linker R, et al. Head injury and outcome— What influence do concomitant injuries have? J Trauma. 2008 Nov;65(5):1036–1044. doi: 10.1097/TA.0b013e318184ee48.
2.McMahon CG, Yates DW, Campbell FM, Hollis S, Woodford M. Unexpected contribution of moderate traumatic brain injury to death after major trauma. J Trauma. 1999 Nov;47(5):891–895. doi: 10.1097/00005373-199911000-00013.
3.Roberts CJ, Barber J, Temkin NR, et al. Clinical outcomes after traumatic brain injury and exposure to extracranial surgery: A TRACK-TBI study. JAMA Surg. 2024 Mar 1;159(3):248–259. doi: 10.1001/jamasurg.2023.6374.
4.Manley G, Knudson MM, Morabito D, Damron S, Erickson V, Pitts L. Hypotension, hypoxia, and head injury: Frequency, duration, and consequences. Arch Surg. 2001 Oct;136(10):1118–1123. doi: 10.1001/ archsurg.136.10.1118. PMID: 11585502.
5.Moore LE, Sharifpour M, Shanks A, Kheterpal S, Tremper KK, Mashour GA. Cerebral perfusion pressure below 60 mm Hg is common in the intraoperative setting. J Neurosurg Anesthesiol. 2012 Jan;24(1):58–62. doi: 10.1097/ANA.0b013e31822b4f05.
6.Gandhi RR, Overton TL, Haut ER, et al. Optimal timing of femur fracture stabilization in polytrauma patients: A practice management guideline from the Eastern Association for the Surgery of Trauma. J Trauma Acute Care Surg. 2014 Nov;77(5):787–795. doi: 10.1097/ TA.0000000000000434.
7.Wang MC, Temkin NR, Deyo RA, Jurkovich GJ, Barber J, Dikmen S. Timing of surgery after multisystem injury with traumatic brain injury: Effect on neuropsychological and functional outcome. J Trauma. 2007 May;62(5):1250–1258. doi: 10.1097/01.ta.0000215581.50234.56.
8.Dunham CM, Bosse MJ, Clancy TV, et al. Practice management guidelines for the optimal timing of long-bone fracture stabilization in trauma patients: The EAST Practice Management Guidelines Work Group. J Trauma. 2001 May;50(5):958–967. doi: 10.1097/00005373- 200105000-00037.
9.Zirkle L, ed. Timing of surgery in orthopaedic patients with brain injury. In Wheeless CR, Nunley JA, Urbaniak JR, eds. Wheeless’ Textbook of Orthopaedics. 2023. https://www.wheelessonline.com/bones/femur/timing-of-surgery-in-orthopaedic-patients-with-brain-injury/ . Accessed May 23, 2024.
10.Tuttle MS, Smith WR, Williams AE, et al. Safety and efficacy of damage control external fixation versus early definitive stabilization for femoral shaft fractures in the multiple-injured patient. J Trauma. 2009 Sep;67(3):602–605. doi: 10.1097/TA.0b013e3181aa21c0.
11.Flierl MA, Stoneback JW, Beauchamp KM, et al. Femur shaft fracture fixation in head-injured patients: When is the right time? J Orthop Trauma. 2010 Feb;24(2):107–114. doi: 10.1097/BOT.0b013e3181b6bdfc.
12.Nahm NJ, Vallier HA. Timing of definitive treatment of femoral shaft fractures in patients with multiple injuries: A systematic review of randomized and nonrandomized trials. J Trauma Acute Care Surg. 2012 Nov;73(5):1046–1063. doi: 10.1097/TA.0b013e3182701ded.
13.Volpin G, Pfeifer R, Saveski J, Hasani I, Cohen M, Pape HC. Damage control orthopedics in polytraumatized patients—current concepts. J Clin Orthop Trauma. 2021 Jan;12(1):72–82. doi: 10.1016/j. jcot.2020.10.018.
14.Mobbs RK, Yang MO. The dangers of diagnostic laparoscopy in the head injured patient. J Clin Neurosci. 2002 Sep;9(5):592–593. doi: 10.1054/jocn.2001.1070.
15.Kamine TH, Papvassiliou E, Schneider BE. Effect of abdominal insufflation for laparoscopy on intracranial pressure. JAMA Surg. 2014 Apr;149(4):380–382. doi: 10.1001/jamasurg.2013.3024.
16.Weihs V, Frenzel S, Dedeyan M, et al. 25-Year experience with adult polytraumatized patients in a European Level 1 trauma center: Polytrauma between 1995 and 2019. What has changed? A retrospective cohort study. Arch Orthop Trauma Surg. 2023 May;143(5):2409–2415. doi: 10.1007/s00402-022-04433-1.
17.Yovev T, Burnic A, Kniha K, Knobe M, Hölzle F, Modabber A. Surgical management of facial fractures in geriatric patients. J Craniofac Surg. 2021 Sep 1;32(6):2082–2086. doi: 10.1097/SCS.0000000000007708.
18.Vavilala MS, King MA, Yang JT, et al. The Pediatric Guideline Adherence and Outcomes (PEGASUS) programme in severe traumatic brain injury: A single-centre hybrid implementation and effectiveness study. Lancet Child Adolesc Health. 2019 Jan;3(1):23–34. doi: 10.1016/S2352- 4642(18)30341-9. PMID: 30473440; PMCID: PMC6301024.
19.Huang YT, Huang YH, Hsieh CH, Li CJ, Chiu IM. Comparison of injury severity score, Glasgow Coma Scale, and Revised Trauma Score in predicting the mortality and prolonged ICU stay of traumatic young children: A cross-sectional retrospective study. Emerg Med Int. 2019 Dec 1;2019:5453624. doi: 10.1155/2019/5453624. PMID: 31885926; PMCID: PMC6914995.
20.Zebrack M, Dandoy C, Hansen K, Scaife E, Mann NC, Bratton SL. Early resuscitation of children with moderate-to-severe traumatic brain injury. Pediatrics. 2009 Jul;124(1):56–64. doi: 10.1542/peds.2008-1006. PMID: 19564283.
21.Kannan N, Wang J, Mink RB, et al. Timely hemodynamic resuscitation and outcomes in severe pediatric traumatic brain injury: Preliminary findings. Pediatr Emerg Care. 2018 May;34(5):325–329. doi: 10.1097/ PEC.0000000000000803. PMID: 27387972; PMCID: PMC5233691.
译者:昆明医科大学第二附属医院神经外科 赵宁辉、高永军、赵凯● 当发生钝性脑血管损伤(BCVI)时,一旦创伤性颅脑损伤(TBI)稳定,最好在24小时内开始抗凝或抗血小板治疗。
● 脊柱骨折是BCVI的单一最具预测性的因素,对椎动脉损伤的风险最大。
● 因为BCVI是老年患者死亡的独立危险因素,因此对存在钝性脑血管损伤(BCVI)风险因素的老年患者应进行自主筛查。
据报道,钝性创伤后CT血管造影的患者中,颅外BCVI的发生率为2.7%-7.6%1,2。未检测到的颈动脉和椎动脉损伤会导致治疗延迟,并增加卒中的风险。卒中高危患者可能同时出现颈动脉和椎动脉损伤。未经治疗的颈动脉和椎动脉损伤的死亡率分别高达38%和18%3,4。Denver和Memphis创伤组都推荐了BCVI的筛查标准(见框5)。
框5:推荐的BCVI筛查标准5-10
• 局灶性神经功能缺损(短暂性脑缺血发作、轻偏瘫、椎基底动脉症状、眼交感神经麻痹/霍纳综合征)• 复杂颅骨骨折(例如,累及额窦或其他鼻窦、眼眶等)• 伴有明显肿胀、疼痛或精神状态改变的晾衣绳型损伤或安全带导致的损伤
脊柱骨折是BCVI的唯一最具预测性的因素,其对椎动脉损伤的风险最大3,5,11-13。低能量损伤机制(包括跌倒)的老年患者也有发生BCVI的风险14。CT血管造影进行BCVI的放射筛查是一种充分且经济有效的方法,推荐使用该方法15-17。然而,对于可疑的损伤或可能适合行血管内治疗的损伤,可以行血管造影术。
即使严格遵守Denver和Memphis的筛查标准,仍有20%至30%的BCVI漏诊12,18,19。一些研究现在建议对所有严重创伤患者使用全身CT(WBCT)扫描进行普筛1,2,18。WBCT包括头部平扫CT,随后是多层CT(40层或64层)扫描,包括从骨盆到Willis环的造影增强扫描。这种成像可以在评估颈椎、胸部、腹部和骨盆的同时筛查BCVI1,2,19。尽管一些作者对创伤患者使用WBCT的益处提出质疑,但美国放射学会(ACR)支持在重大钝性创伤患者中使用适当的CT扫描标准20,21。
BCVI的管理主要集中在降低血栓栓塞的风险,这会导致缺血性卒中9,22,23。其治疗方案包括使用抗血小板、抗凝药物和血管内治疗。大型观察研究发现,与未治疗相比,使用任何抗血栓药物治疗后似乎卒中风险更低,尽管这尚未得到大型随机试验验证4,22。颈动脉夹层患者(包括但不主要集中于BCVI)的试验中发现,抗血小板和华法林治疗(联合桥接IV肝素,直到INR达到治疗范围)通常发挥相似作用,虽然华法林可能存在轻微优势24-26。
当发生BCVI时,当前最佳治疗方案是在TBI稳定后立即开始抗凝或抗血小板药物治疗,而对于TBI进展风险不高且颅外损伤出血得到控制的患者,理论上应在最初24小时内启动治疗23,27-30。这一建议对于出现脑缺血症状的患者(短暂性脑缺血发作或脑梗死)和无颅外BCVI症状的患者来说是合理的。其他的问题,包括双重抗血小板治疗是否优于阿司匹林单药,以及高风险特征如腔内血栓或BCVI等级是否需要抗凝治疗而非抗血小板治疗?关于直接口服抗凝剂取代华法林的研究有限。
一般来说,抗血栓药物治疗至少持续3个月26,再行无创影像(CT血管造影或MRI)随访评估疗效26。虽然对于接受了抗血栓治疗但仍未愈合的假性动脉瘤或复发性脑缺血可以考虑血管内治疗包括支架植入或弹簧圈栓塞29,但对于受BCVI影响的动脉,通常不建议初始使用血管内栓塞/闭塞,因为存在围术期并发症的风险29且许多损伤存在自愈情况,只要患者通过某种形式的抗血栓治疗避免发生血栓栓塞。但是根据相应血管损伤的分级和结构,颈动脉损伤的支架植入,脊柱损伤的支架植入和栓塞术都可以安全实施,但可能仍需要持续的抗血小板辅助治疗31。
关于老年BCVIs的数据相对较少。BCVI通常与高能损伤机制相关,但老年人的BCVI,低能量损伤机制更常见,并且他们可能不会进行BCVI的自主筛查32。然而,老年人受伤的风险很高,尤其是与BCVI相关的损伤,例如椎体骨折。尽管老年人BCVI的总体发生率低于年轻人,但老年人跌倒后发生BCVI的后果是灾难性的14。他们不仅更可能出现更复杂的损伤,而且老年BCVIs也是死亡的独立危险因素14,33。因此,对有BCVI危险因素的老年患者应进行自主筛查。
儿童BCVI评估须考虑辐射暴露的额外风险。与成人相比,儿童BCVI患病率较低,采用丹佛标准可能会高估BCVI发病率34。Utah评分是一种经过验证的BCVI评分系统,具有高度特异性,并纳入了风险因素,将患者分为BCVI相关并发症“低”或“高”风险人群(见表5)35,36。McGovern修正案增加了两条与车祸相关的严重损伤的机制,也因此提高了BCVI诊断的准确性37。
最高11分,评分≥3的BCVI风险为18%,评分≤2的风险低于3%。
来源:Ravindra VM, Riva-Cambrin J, Sivakumar W, Metzger RR, Bollo RJ. Risk factors for traumatic blunt cerebrovascular injury diagnosed by computed tomography angiography in the pediatric population: A retrospective cohort study. J Neurosurg Pediatr. 2015;15(6):599–606.
本图受版权保护,归Journal of Neurosurgery Publishing Group(JNSPG)所有,仅在美国外科医生学会网站上托管的本文档中使用。否则必须获得JNSPG的许可才能使用它。包含原始图的文章全文可在https://doi.org/10.3171/2014.11.PEDS14397上查阅。
建议使用风险评分辨别需要接受专科CT血管造影检查的高风险群体。与成人推荐类似,当诊断BCVI,颅内损伤情况稳定且颅外出血控制后应开始抗血小板或抗凝治疗。具体的治疗持续时间需要进一步的证据确定。治疗应个体化,但是,对于较高级别损伤(Biffl评级≥3)或接受药物治疗病情仍进展的患者,应考虑手术或血管内治疗36-38。
1.Black JA, Abraham PJ, Abraham MN, et al. Universal screening for blunt cerebrovascular injury. J Trauma Acute Care Surg. 2021 Feb 1;90(2):224–231. doi: 10.1097/TA.0000000000003010. PMID: 33502144.
2.Leichtle SW, Banerjee D, Schrader R, et al. Blunt cerebrovascular injury: The case for universal screening. J Trauma Acute Care Surg. 2020 Nov;89(5):880–886. doi: 10.1097/TA.0000000000002824. PMID: 32520898.
3.Rutman AM, Vranic JE, Mossa-Basha M. Imaging and management of blunt cerebrovascular injury. Radiographics. 2018 Mar–Apr;38(2):542–563. doi: 10.1148/rg.2018170140.
4.Russo, RM, Davidson AJ, Alam HB, et al. Blunt cerebrovascular injuries: Outcomes from the American Association for the Surgery of Trauma PROspective Observational Vascular Injury Treatment (PROOVIT) multicenter registry. J Trauma Acute Care Surg. 2021 Jun 1;90(6):987–995. doi: 10.1097/TA.0000000000003127.
5.Biffl WL, Moore EE, Offner PJ, et al. Optimizing screening for blunt cerebrovascular injuries. Am J Surg. 1999 Dec;178(6):517–521. doi: 10.1016/S0002-9610(99)00245-7
6.Cothren CC, Moore EE, Ray CE Jr, Johnson JL, Moore JB, Burch JM. Cervical spine fracture patterns mandating screening to rule out blunt cerebrovascular injury. Surgery. 2007 Jan;141(1):76–82. doi: 10.1016/j.surg.2006.04.005.
7.Burlew CC, Biffl WL, Moore EE, Barnett CC, Johnson JL, Bensard DD. Blunt cerebrovascular injuries: Redefining screening criteria in the era of noninvasive diagnosis. J Trauma Acute Care Surg. 2012 Feb;72(2):330–335; discussion 336–337. doi: 10.1097/TA.0b013e31823de8a0.
8.Geddes AE, Burlew CC, Wagenaar AE, et al. Expanded screening criteria for blunt cerebrovascular injury: A bigger impact than anticipated. Am J Surg. 2016 Dec;212(6):1167–1174. doi: 10.1016/j.amjsurg.2016.09.016.
9.Kim DY, Biffl W, Bokhari F, et al. Evaluation and management of blunt cerebrovascular injury: A practice management guideline from the Eastern Association for the Surgery of Trauma. J Trauma Acute Care Surg. 2020 Jun;88(6):875–887. doi: 10.1097/TA.0000000000002668.
10.Ciapetti M, Circelli A, Zagli G, et al. Diagnosis of carotid arterial injury in major trauma using a modification of Memphis criteria. Scand J Trauma Resusc Emerg Med. 2010 Nov 22;18:61. doi: 10.1186/1757-7241-18-61.
11.Cothren CC, Moore EE, Biffl WL, et al. Cervical spine fracture patterns predictive of blunt vertebral artery injury. J Trauma. 2003 Nov;55(5):811–813. doi: 10.1097/01.TA.0000092700.92587.32.
12.Kopelman TR, Leeds S, Berardoni NE, et al. Incidence of blunt cerebrovascular injury in low-risk cervical spine fractures. Am J Surg. 2011 Dec;202(6):684–688; discussion 688–689. doi: 10.1016/j.amjsurg.2011.06.033.
13.American College of Surgeons. ACS TQP Best Practices Guidelines: Spine Injury. 2022. https://www.facs.org/media/k45gikqv/spine_injury_guidelines.pdf. Accessed May 24, 2024.
14.Anto VP, Brown JB, Peitzman AB, et al. Blunt cerebrovascular injury in elderly fall patients: Are we screening enough? World J Emerg Surg. 2018 Jul 4;13:30. doi: 10.1186/s13017-018-0188-z. PMID: 29997683; PMCID: PMC6031193.
15.Shafafy R, Suresh S, Afolayan JO, et al. Blunt vertebral vascular injury in trauma patients: ATLS® recommendations and review of current evidence. J Spine Surg. 2017; 3(2): 217–225. doi: 10.21037/jss.2017.05.10.
16.Goodwin RB, Beery PR, Dorbish RJ, et al. Computed tomographic angiography versus conventional angiography for the diagnosis of blunt cerebrovascular injury in trauma patients. J Trauma. 2009; 67(5): 1046–1050. doi: 10.1097/TA.0b013e3181b83b63.
17.Eastman AL, Chason DP, Perez CL, et al. Computed tomographic angiography for the diagnosis of blunt cervical vascular injury: Is it ready for primetime? J Trauma. 2006; 60(5): 925–929; discussion 929. doi: 10.1097/01.ta.0000197479.28714.62.
18.Bruns BR, Tesoriero R, Kufera J, et al. Blunt cerebrovascular injury screening guidelines: What are we willing to miss? J Trauma Acute Care Surg. 2014 Mar; 76(3): 691–695. doi: 10.1097/TA.0b013e3182ab1b4d. PMID: 24553535.
19.Bensch FV, Varjonen EA, Pyhältö TT, Koskinen SK. Augmenting Denver criteria yields increased BCVI detection, with screening showing markedly increased risk for subsequent ischemic stroke. Emerg Radiol. 2019; 26(4): 365–372. doi: 10.1007/s10140-019-01677-0.
20.Long B, April MD, Summers S, Koyfman A. Whole body CT versus selective radiological imaging strategy in trauma: An evidence-based clinical review. Am J Emerg Med. 2017 Sep; 35(9): 1356–1362. doi: 10.1016/j.ajem.2017.03.048. Epub 2017 Mar 21. PMID: 28366287.
21.Expert Panel on Major Trauma Imaging, Shyu JY, Khurana B, et al. ACR Appropriateness Criteria® Major Blunt Trauma. J Am Coll Radiol. 2020 May; 17(5S): S160–S174. doi: 10.1016/j.jacr.2020.01.024. PMID: 32370960.
22.Cothren CC, Biffl WL, Moore EE, et al. Treatment for blunt cerebrovascular injuries: Equivalence of anticoagulation and antiplatelet agents. Arch Surg. 2009; 144(7): 685–690. doi: 10.1001/archsurg.2009.111.
23.Burlew CC, Sumislawski JJ, Behnfield CD, et al. Time to stroke: A Western Trauma Association multicenter study of blunt cerebrovascular injuries. J Trauma Acute Care Surg. 2018; 85(5): 858–866. doi: 10.1097/TA.0000000000001989.
24.Kleindorfer DO, Towfighi A, Chaturvedi S, et al. 2021 guideline for the prevention of stroke in patients with stroke and transient ischemic attack: A Guideline from the American Heart Association/American Stroke Association. Stroke. Jul 2021; 52(7): e364–e467. doi: 10.1161/STR.0000000000000375.
25.Engelter ST, Traenka C, Gensicke H, et al. Aspirin versus anticoagulation in cervical artery dissection (TREAT-CAD): An open-label randomised, non-inferiority trial. Lancet Neurol. May 2021; 20(5): 341–350. doi: 10.1016/S1474-4422(21)00044-2.
26.Markus HS, Levi C, King A, et al. Antiplatelet therapy vs anticoagulation therapy in cervical artery dissection: The Cervical Artery Dissection in Stroke Study (CADISS) randomized clinical trial final results. JAMA Neurol. 2019 Jun 1; 76(6): 657–664. doi: 10.1001/jamaneurol.2019.0072.
27.Callcut RA, Hanseman DJ, Solan PD, et al. Early treatment of blunt cerebrovascular injury with concomitant hemorrhagic neurologic injury is safe and effective. J Trauma Acute Care Surg. 2012; 72(2) 338–345. doi: 10.1097/TA.0b013e318243d978.
28.Pierre E, Cardinale M, Boret H, et al. Blunt cerebrovascular injuries in severe traumatic brain injury: Incidence, risk factors, and evolution. Journal of Neurosurgery. 2016; 127(1): 16–22. doi: 0.3171/2016.4.JNS152600.
29.Figueroa JM, Berry K, Boddu J, et al. Treatment strategies for patients with concurrent blunt cerebrovascular and traumatic brain injury. Journal of Clinical Neuroscience. 2021; 88: 243–250. doi: 10.1016/j.jocn.2021.03.044.
30.Esposito EC, Kufera JA, Wolff TW, et al. Factors associated with stroke formation in blunt cerebrovascular injury: An EAST multicenter study. J Trauma Acute Care Surg. 2022; 92(2): 347–354. doi: 10.1097/TA.0000000000003455.
31.Edwards NM, Fabian TC, Claridge JA, et al. Antithrombotic therapy and endovascular stents are effective treatment for blunt carotid injuries: Results from longterm followup [sic]. J Am Coll Surg. 2007 May; 204(5): 1007–1013; discussion 1014–1015. doi: 10.1016/j.jamcollsurg.2006.12.041. Epub 2007 Mar 27. PMID: 17481530.
32.Flashburg E, Ong AW, Muller A, et al. Fall downs should not fall out: Blunt cerebrovascular injury in geriatric patients after low-energy trauma is common. J Trauma Acute Care Surg. 2019 Jun 1; 86(6): 1010–1014. doi: 10.1097/TA.0000000000002241.
33.Le DT, Barhorst KA, Castiglione J, et al. Blunt cerebrovascular injury in the geriatric population. Neurosurg Focus. 2020 Oct;49(4):E10. doi: 10.3171/2020.7.FOCUS20499.
34.Azarakhsh N, Grimes S, Notrica DM, et al. Blunt cerebrovascular injury in children: Underreported or underrecognized?: A multicenter ATOMAC study. J Trauma Acute Care Surg. 2013 Dec;75(6):1006–1012; discussion 1011–1012. doi: 10.1097/TA.0b013e31829d3526.
35.Ravindra VM, Bollo RJ, Sivakumar W, et al. Predicting blunt cerebrovascular injury in pediatric trauma: Validating of the “Utah Score.” J Neurotrauma. 2017 Jan 15;34(2):391–399. doi: 10.1089/neu.2016.4415. PMID: 27297774. PMCID: PMC5220560.
36.Ravindra VM, Riva-Cambrin J, Sivakumar W, Metzger RR, Bollo RJ. Risk factors for traumatic blunt cerebrovascular injury diagnosed by computed tomography angiography in the pediatric population: A retrospective cohort study. J Neurosurg Pediatr. 2015 Jun;15(6):599–606. doi: 10.3171/2014.11.PEDS14397. Epub 2015 Mar 6. PMID: 25745952.
37.Herbert JP, Venkataraman SS, Turkmani AH, et al. Pediatric blunt cerebrovascular injury: The McGovern screening score. J Neurosurg Pediatr. 2018 Jun;21(6):639–649. doi: 10.3171/2017.12.PEDS17498.
38.Dewan MC, Ravindra VM, Gannon S, et al. Treatment practices and outcomes after blunt cerebrovascular injury in children. Neurosurgery. 2016 Dec;79(6):872–878. doi: 10.1227/NEU.0000000000001352.
● 对于低风险非手术治疗的创伤性颅脑损伤(TBI)患者,若随访CT显示颅内损伤无进展,建议在伤后24小时内开始静脉血栓栓塞(VTE)预防。
● 对于中度或高风险非手术治疗的创伤性颅脑损伤患者,若随访头部CT显示颅内损伤无进展,建议在伤后24至48小时内开始静脉血栓栓塞预防。
● 对于已接受开颅术或去骨瓣减压术的患者,若术后CT显示脑内出血(ICH)稳定,考虑在术后24至48小时内开始或恢复药物性静脉血栓栓塞预防。
● 在创伤性颅脑损伤患者的预防中,建议优先选择低分子量肝素(LMWH)而非普通肝素(UFH)。
对于颅脑创伤患者,尤其是多发伤或重度颅脑损伤的患者是静脉血栓栓塞(VTE)高风险人群1–3。在没有预防措施或仅接受机械性预防的情况下,创伤性脑损伤患者的VTE风险非常高1,2。对于重型创伤性颅脑损伤的患者,提供药物性VTE预防是标准1–3。对于创伤性颅脑损伤患者,每延迟一天开始药物性VTE预防,VTE风险就会增加;当创伤患者漏服药物性VTE预防剂量时,VTE的发生率也会提高3–5。大量证据表明,药物性VTE预防可降低一般创伤和创伤性颅脑损伤患者的VTE发生率,并可能改善创伤性颅脑损伤患者的预后6。目前的最佳时机是在所有创伤性颅脑损伤患者入院时立即开始使用机械性预防措施,无论他们是否符合药物性预防的条件3。
对于创伤性颅脑损伤患者,临床医生必须在考虑是否进行药物性预防静脉血栓栓塞情况下颅内出血(ICH)进展的风险与已知的药物预防降低静脉血栓栓塞风险的益处之间权衡。研究已表明,创伤性颅脑损伤的严重程度与ICH进展风险之间存在总体相关性7,8。个体患者因素也可能影响出血或血栓的风险,例如先天性或后天性高凝状态或凝血功能障碍、使用抗血栓和抗凝药物,以及急性损伤模式。改良的Berne-Norwood标准和脑损伤指南根据轻度、中度和重度损伤模式对ICH进展风险进行分层,脑损伤指南还考虑了若干临床因素(见表6)7,8。
表6:颅内出血进展的解剖因素和风险
数据引自:Pastorek RA, Cripps MW, Bernstein IH, et al. The Parkland Protocol’s modified Berne-Norwood criteria predict two tiers of risk for traumatic brain injury progression. J Neurotrauma. 2014; 31: 1737–1743. doi: 10.1089/neu.2014.3366; Joseph B, Friese RS, Sadoun M, et al. The BIG (Brain Injury Guidelines) project: Defining the management of traumatic brain injury by acute care surgeons. J Trauma Acute Care Surg. 2014; 76: 965–969. doi: 10.1097/ TA.0000000000000161.
现有证据支持在创伤性颅脑损伤患者中早期启动药物性预防静脉血栓栓塞。在过去十年中,多项研究和两项系统综述表明,对于随访CT扫描显示ICH稳定的患者,无论创伤性颅脑损伤的严重程度如何,提早开始预防与降低静脉血栓栓塞发生率相关,而且不会导致临床显著的ICH进展6,9–14。然而,对于在接受预防前已出现ICH进展的患者以及那些接受颅脑手术的患者,情况可能不同,启动预防前需要进行额外的观察4,15。虽然在创伤性颅脑损伤患者中使用药物性静脉血栓栓塞预防仍是一个不断研究的发展领域,但对现有证据和专家共识的重新评估促成了这些更新的建议。
对于非手术治疗的创伤性颅脑损伤患者,建议在初次CT后24小时内复查颅脑CT,帮助开始药物性静脉血栓栓塞预防前评估ICH的稳定性。可能的例外是初始CT上出血极少的患者,他们可能无需影像复查。对于住院的ICH 风险低的患者(如表6所述),如果复查CT显示ICH稳定,考虑在24小时内开始药物性静脉血栓栓塞预防。对于有中度或高度ICH进展风险的患者,如果复查CT显示ICH稳定,考虑在 24至48小时内开始药物性静脉血栓栓塞预防。
对于有颅内压(ICP)监测器(脑实质内或脑室外引流,EVD)的患者,但未接受开颅术或去骨瓣减压术,可以按照上述非手术创伤性颅脑损伤患者的方式考虑使用药物性静脉血栓栓塞预防。不建议在放置ICP监测器之前或监测期间暂停药物性静脉血栓栓塞预防。考虑在移除ICP监测前持续进行药物性脉血栓栓塞预防,而不需要停药。另一种选择是,在药物经过一个半衰期后,调整ICP监测探头的植入或移除时间。对于已接受开颅术或去骨瓣减压术的患者,如果术后CT显示ICH稳定,考虑在术后24至48小时内启动或恢复药物性静脉血栓栓塞预防。对于CT显示ICH进展的患者,建议暂停药物性静脉血栓栓塞预防,直到在复查影像中证实ICH稳定,通常需要再过24至48小时14,15。
低分子量肝素(LMWH)被认为在没有颅脑损伤的创伤患者的静脉血栓栓塞预防中优于普通肝素(UFH)1,3。LMWH也是创伤性颅脑损伤患者的首选药物,包括那些使用颅内压(ICP)监测的患者3,16–21。现有证据表明,在接受手术和非手术治疗的创伤性颅脑损伤患者中,与UFH相比,LMWH与较低的静脉血栓栓塞发生率和相似的颅内出血(ICH)进展率相关16–21。
目前,对于一般创伤患者,依诺肝素的最佳剂量是每12小时40 mg 1。由于缺乏对创伤性颅脑损伤患者使用该剂量方案的充分和特异性研究,建议创伤性颅脑损伤患者初始剂量为每12小时30 mg。如果使用达肝素钠,建议采用标准剂量。此外,应考虑监测抗Xa因子活性水平,以指导后续LMWH的剂量调整1–3,22。
如果选择普通肝素进行药物性静脉血栓栓塞预防,最佳做法是每8小时给予5000 U。无论创伤性颅脑损伤患者开始药物性静脉血栓栓塞预防的时间如何,都不再推荐预防性使用下腔静脉滤器3。下腔静脉滤器的放置指征是患者存在已知的静脉血栓栓塞,且有治疗性抗凝的禁忌症。
结合本地经验以寻找症状改善(PI)机会是有益的。可考虑的症状改善指标包括:
● 开始药物性静脉血栓栓塞预防的时间
● 使用的药物性静脉血栓栓塞预防剂
● 延迟开颅术/去骨瓣减压术的发生率
在老年患者中,药物性VTE预防的管理与其他成人相同。需要注意的是,肾功能的改变可能会影响LMWH的剂量,或促使使用UFH。
与成人人群相比,儿科创伤患者发生VTE的情况非常罕见。年龄是儿童VTE的一个重要风险因素;估计显示,0-12岁患者的VTE发病率为0.09%,13-15岁的患者为0.27%16-21,16-21岁的患者为0.73%22,23。多个评分系统被提出用于确定个体儿科创伤患者的VTE风险,并为是否使用机械和药物性VTE预防提供决策依据。总体的风险因素包括年龄较大、损伤严重程度评分(ISS)较高、格拉斯哥昏迷评分(GCS)较低、输血、长期使用中心静脉导管以及重大手术23–25。考虑到这些因素,建议包括:
● 医院需要为儿科创伤患者采用已发布的 VTE 风险评估工具(例如ROCKIT),并在入院后进行VTE风险分层26。
● 低风险儿童不需要药物性VTE预防。
● 中等风险儿童需要在入院时开始机械性VTE预防。
● 对于被认为是VTE高风险的患者,应考虑使用药物性VTE预防。
● 儿童对药物性VTE预防的禁忌症与成人相同(关于存在颅内出血、脑出血进展的风险以及近期手术)。
● LMWH是儿科人群中药物性VTE预防的首选药物。在幼儿中应使用基于体重的剂量。
● 尽管VTE预防的持续时间尚未得到充分研究,但在患者能够行走且不存在其他促凝因素的情况下,应停止VTE预防。
1.Yorkgitis BK, Berndtson AE, Cross A, et al. American Association for the Surgery of Trauma/American College of Surgeons–Committee on Trauma clinical protocol for inpatient venous thromboembolism prophylaxis after trauma. J Trauma Acute Care Surg. 2022 Mar 1;92(3):597–604. doi: 10.1097/TA.0000000000003475.
2.Rappold JF, Sheppard FR, Carmichael SP II, et al. Venous thromboembolism prophylaxis in the trauma intensive care unit: An American Association for the Surgery of Trauma Critical Care Committee clinical consensus document. Trauma Surg Acute Care Open. 2021 Feb 24;6(1):e000643. doi: 10.1136/tsaco-2020-000643.
3.Ley EJ, Brown CV, Moore EE, et al. Updated guidelines to reduce venous thromboembolism in trauma patients: A Western Trauma Association critical decisions algorithm. J Trauma Acute Care Surg. 2020 Nov;89(5):971–981. doi: 10.1097/TA.0000000000002830.
4.Byrne JP, Witiw CD, Schuster JM, et al. Association of venous thromboembolism prophylaxis after neurosurgical intervention for traumatic brain injury with thromboembolic complications, repeated neurosurgery, and mortality. JAMA Surg. 2022 Mar 1;157(3):e215794. doi: 10.1001/jamasurg.2021.5794.
Louis SG, Sato M, Geraci T, et al. Correlation of missed doses of enoxaparin with increased incidence of deep vein thrombosis in trauma and general surgery patients. JAMA Surg. 2014;149(4):365–370. doi: 10.1001/jamasurg.2013.3963.
6.Huijben JA, Pisica D, Ceyisakar I, et al. Pharmaceutical venous thrombosis prophylaxis in critically ill traumatic brain injury patients. Neurotrauma Rep. 2022 Jan 7;2(1):4–14. doi: 10.1089/neur.2021.0037.
7.Pastorek RA, Cripps MW, Bernstein IH, et al. The Parkland Protocol’s modified Berne-Norwood criteria predict two tiers of risk for traumatic brain injury progression. J Neurotrauma. 2014 Oct 15;31(20):1737–1743. doi: 10.1089/neu.2014.3366.
8.Joseph B, Friese RS, Sadoun M, et al. The BIG (Brain Injury Guidelines) project: Defining the management of traumatic brain injury by acute care surgeons. J Trauma Acute Care Surg. 2014 Apr;76(4):965–969. doi: 10.1097/TA.0000000000000161.
9.Störmann P, Osinloye W, Freiman TM, Seifert V, Marzi I, Lustenberger T. Early chemical thromboprophylaxis does not increase the risk of intracranial hematoma progression in patients with isolated severe traumatic brain injury. World J Surg. 2019 Nov;43(11):2804–2811. doi:
10.1007/s00268-019-05072-1.
10.Byrne JP, Mason SA, Gomez D, et al. Timing of pharmacologic venous thromboembolism prophylaxis in severe traumatic brain injury: A propensity-matched cohort study. J Am Coll Surg. 2016 Oct;223(4):621– 631.e5. doi: 10.1016/j.jamcollsurg.2016.06.382.
11.Spano PJ II, Shaikh S, Boneva D, Hai S, McKenney M, Elkbuli A. Anticoagulant chemoprophylaxis in patients with traumatic brain injuries: A systematic review. J Trauma Acute Care Surg. 2020 Mar;88(3):454– 460. doi: 10.1097/TA.0000000000002580.
12.Lu VM, Alvi MA, Rovin RA, Kasper EM. Clinical outcomes following early versus late pharmacologic thromboprophylaxis in patients with traumatic intracranial hemorrhage: A systematic review and meta-analysis. Neurosurg Rev. 2020 Jun;43(3):861–872. doi: 10.1007/s10143-018- 1045-y.
13.Phelan HA, Wolf SE, Norwood SH, et al. A randomized, double-blinded, placebo-controlled pilot trial of anticoagulation in low-risk traumatic brain injury: The Delayed Versus Early Enoxaparin Prophylaxis I (DEEP I) study. J Trauma Acute Care Surg. 2012 Dec;73(6):1434–1441. doi: 10.1097/TA.0b013e31825ac49e.
14.Saadeh Y, Gohil K, Bill C, et al. Chemical venous thromboembolic prophylaxis is safe and effective for patients with traumatic brain injury when started 24 hours after the absence of hemorrhage progression on head CT. J Trauma Acute Care Surg. 2012 Aug;73(2):426–430. doi:
10.1097/TA.0b013e31825a758b.
15.Levy AS, Salottolo K, Bar-Or R, et al. Pharmacologic thromboprophy laxis is a risk factor for hemorrhage progression in a subset of patients with traumatic brain injury. J Trauma. 2010 Apr;68(4):886–894. doi: 10.1097/TA.0b013e3181d27dd5.
16.Maragkos GA, Cho LD, Legome E, Wedderburn R, Margetis K. Delayed cranial decompression rates after initiation of unfractionated heparin versus low-molecular-weight heparin in traumatic brain injury. World Neurosurg. 2022 Aug;164:e1251–e1261. doi: 10.1016/j.
wneu.2022.06.008.
17.van Erp IA, Gaitanidis A, El Moheb M, et al. Low-molecular-weight heparin versus unfractionated heparin in pediatric traumatic brain injury. J Neurosurg Pediatr. 2021 Feb 12;27(4):469–474. doi: 10.3171/2020.9.PEDS20615.
18.Benjamin E, Recinos G, Aiolfi A, Inaba K, Demetriades D. Pharmacological thromboembolic prophylaxis in traumatic brain injuries: Low molecular weight heparin is superior to unfractionated heparin. Ann Surg. 2017 Sep;266(3):463–469. doi: 10.1097/ SLA.0000000000002359.
19.Abdel-Aziz H, Dunham CM, Malik RJ, Hileman BM. Timing for deep vein thrombosis chemoprophylaxis in traumatic brain injury: An evidence-based review. Crit Care. 2015 Mar 24;19(1):96. doi: 10.1186/ s13054-015-0814-z.
20.Chelladurai Y, Stevens KA, Haut ER, et al. Venous thromboembolism prophylaxis in patients with traumatic brain injury: A systematic review. F1000Res. 2013 May 29;2:132. doi: 10.12688/f1000research.2-132.v1.
21.Minshall CT, Eriksson EA, Leon SM, Doben AR, McKinzie BP, Fakhry SM. Safety and efficacy of heparin or enoxaparin prophylaxis in blunt trauma patients with a head abbreviated injury severity score >2. J Trauma. 2011 Aug;71(2):396–399. doi: 10.1097/TA.0b013e31822734c9.
22.Rodier SG, Kim M, Moore S, et al. Early anti-Xa assay-guided low molecular weight heparin prophylaxis is safe in adult patients with acute traumatic brain injury. Am Surg. 2020 Apr 1;86(4):369–376. PMID: 32391762.
23.Yen J, Van Arendonk KJ, Streiff MB, et al. Risk factors for venous thromboembolism in pediatric trauma patients and validation of a novel scoring system: The risk of clots in kids with trauma score. Pediatr Crit Care Med. 2016 May;17(5):391–399. doi: 10.1097/ PCC.0000000000000699.
24.Leeper CM, Vissa M, Cooper JD, Malec LM, Gaines BA. Venous thromboembolism in pediatric trauma patients: Ten-year experience and long-term follow-up in a tertiary care center. Pediatr Blood Cancer. 2017 Aug;64(8). doi: 10.1002/pbc.26415.
25.Vavilala MS, Nathens AB, Jurkovich GJ, Mackenzie E, Rivara FP. Risk factors for venous thromboembolism in pediatric trauma. J Trauma. 2002 May;52(5):922–927. doi: 10.1097/00005373-200205000-00017.
26.Georgeades C, Van Arendonk K, Gourlay D. Venous thromboembolism prophylaxis after pediatric trauma. Pediatr Surg Int. 2021 Jun;37(6):679–694. doi: 10.1007/s00383-020-04855-1.
译者:新疆医科大学第一附属医院神经外科 汪永新、范国锋、艾尔帕提·买买提
● 与未接受任何抗癫痫药物(ASM)治疗的TBI患者相比,具有早期创伤后癫痫发作(PTS)高危险因素的TBI患者在接受苯妥英钠或左乙拉西坦治疗后,PTS的发生率更低。
● 如果存在危险因素,可考虑在严重TBI后7天内使用ASM预防早期PTS;然而,不推荐使用超过7天来预防晚期PTS。
● 仔细评估接受华法林或口服抗凝药(DOACs)治疗的患者,对发生致命性出血需要紧急手术治疗的患者应启动特异性药物逆转疗法。
● 考虑重新启动抗凝治疗不迟于TBI后14-90天,这取决于患者的血栓和出血(发生)风险。
● 不建议常规输注血小板来逆转抗血小板药物的作用。根据临床判断决定对于接受抗血小板药物治疗且血小板计数低的TBI患者在接受手术或侵入性操作时,是否需要输血小板来止血。
● 根据对患者发生血栓形成和出血特定风险的评估,最早可在创伤后4天内重启抗血小板药物治疗。
● β受体阻滞剂(如,普萘洛尔)可用于治疗伴有肾上腺素能应激或阵发性交感神经过度兴奋综合征(“交感风暴”)的TBI患者,但也必须考虑其不良反应。
● 抗生素预防使用应根据发表的指南,同时结合药剂师的意见和对ICU抗生素图谱的评估。
● 不建议对置入EVD或脑实质型ICP、颅底骨折、脑脊液漏、气颅患者预防性使用抗生素。因为预防可能促进耐药菌的生长。
PTS的发生率:早期PTS(<7天)与TBI损伤的严重程度有关,其中穿透伤患者早期PTS发生率最高1,2。其他高危患者包括:伤后即刻发生PTS的患者,或合并凹陷性骨折、硬膜下血肿、脑内血肿、GCS<10分、脑挫伤的患者3。早期PTS也与TBI的致残率和致死率以及发生创伤后癫痫(PTE)的风险增加有关4,5。一项随机对照试验结果显示,安慰剂组的早期PTS发生率为14.2%,而苯妥英组为3.6%3。然而,早期癫痫预防并不能预防PTE,这突出了同期随机临床研究的必要性。
PTS预防:如果存在危险因素,可考虑在TBI后7天内使用ASM预防早期PTS。然而,不建议使用超过7天来预防晚期PTS。对于没有颅内出血或仅有孤立性创伤性蛛网膜下腔出血的TBI患者不推荐进行癫痫预防6,7。
目前对PTS研究最多的ASM是苯妥英钠、左乙拉西坦和丙戊酸。其中,苯妥英钠和左乙拉西坦在早期PTS高风险患者中的安全性和有效性方面相似。8 然而,在这些研究中,早期PTS的发生率很低,并且无法确定一种药物优于另一种药物。
● 苯妥英钠是一种较老的ASM,需要治疗药物监测以确保达到治疗浓度。通常在初始给药后24小时监测,并在TBI患者预防的7天内再次监测。然而,苯妥英钠与许多药物间存在相互作用,以及潜在的严重不良药物反应(ADR)。苯妥英钠与血清白蛋白高度结合,因此监测白蛋白和游离苯妥英钠浓度对于调整苯妥英钠剂量至关重要。如果实验室无法进行游离苯妥英钠的检测,可以计算总苯妥英钠浓度并进行校正9,10。
● 左乙拉西坦是一种相对于苯妥英钠具有更好的药代动力学特征和最小的不良药物反应的ASM。然而,在儿童和成人患者中,特别是那些TBI的患者,能观察到相关的行为不良反应11-15。每天补充50-100 mg吡哆醇可能减少这些行为不良反应16。
● 丙戊酸钠由于与苯妥英相比增加了死亡风险,故不推荐用于预防早期PTS17。
对没有临床或脑电图癫痫发作的患者以及仅在伤后第一个24小时内有癫痫发生的患者,不要继续使用PTS预防超过7天。如果癫痫发作超过24小时,或患者之前因已知的癫痫疾病接受过药物治疗,可继续进行癫痫预防。
抗凝逆转:对入院前服用抗凝药物的TBI患者要考虑进行抗凝逆转治疗,以使他们能够安全地接受急诊手术和/或帮助防止血肿扩大。对于每种可用的口服抗凝药物,通常推荐使用一种特定的逆转剂。如果DOAC的最后一次剂量是在过去的8-12小时内(或接受华法林的患者INR升高≥1.5),逆转剂的益处很可能大于风险。
当给予IV因子凝血酶原复合物浓缩剂(4PCCs)进行抗凝逆转时,一些医生选择使用1500至2500 U的固定剂量,而不是使用基于体重的给药剂量来抗凝逆转。对于INR为1.5-1.9的患者,建议使用较低剂量的4PCC(10-20 U/kg),因为较高剂量(>2000至3000 U)与非创伤性ICH患者的VTE风险增加相关18,19。
注:如果没有4PCC,可使用新鲜冰冻血浆(FFP),大约8-16U的FFP相当于20-50U/kg的4PCC。单用FFP可使INR最低达到1.5-1.7;FFP的平均内在INR为1.1,但其可在0.9-1.3之间变化。
神经危重症监护学会/危重症医学学会、美国心脏协会和美国血液学会发表了针对危及生命的出血(所有病因)患者的特定抗凝逆转建议20-22。接受口服抗凝药物治疗的TBI患者的急性期临床管理包括:
● 停用抗凝药物
● 确定DOAC的类型,剂量,最后用药时间
● 可能的情况下确定DOAC对手术干预和逆转策略的影响
目前,实验室检测尚无法方便地进行DOAC特异性抗Xa活性或DOAC浓度的定量测定,也没有明确的DOAC浓度治疗范围23。然而,如果近期服用了DOAC,一些常见的临床实验室测量值可能会升高,并达到临床检测的相关浓度,包括:
● 服用达比加群(凝血酶抑制剂)患者的活化部分凝血活酶时间的升高
● Xa抑制剂患者凝血酶原时间和活化部分凝血活酶时间的升高
正常检测值并不能排除潜在的治疗性DOAC浓度20,22-24。
注:在患者有出血高风险的紧急情况下,不要因为等待化验结果而推迟逆转治疗。
病史非常有助于确定合并症是否会增加DOAC浓度或延长DOAC暴露时间(例如,高龄、肾功能不全、肾功能衰竭或透析依赖以及药物相互作用)。血栓弹力图(TEG)可能有助于血凝块强度和纤溶状态的定性评估,但缺乏证据用于支持治疗性DOAC浓度的定量测定23,25,26。注:接受大量输血治疗的患者,TEG结果可能不准确。口服抗凝药物逆转策略的总结见表7。
表7.需要急诊手术的TBI患者抗凝逆转策略19,20-22,27
入院前即接受治疗性抗凝治疗的患者仍有血栓形成的潜在风险。因此,考虑使用皮下注射肝素或低分子肝素(LMWH)来进行VTE预防,以防止急性期停用抗凝药物后血栓形成的风险。同时,还需根据出血风险和基础疾病导致的血栓风险来权衡抗凝逆转的利弊。
重新启动抗凝治疗:现有证据不足以推荐有血栓栓塞中高风险(例如,有机械瓣膜或左心室辅助装置患者,3个月内有VTE病史患者)但再出血风险不高的患者重启抗凝治疗的最佳时机。然而,可以考虑比低危患者(如房颤患者,低CHA2 DS2-VASc评分,自发性脑出血,3个月前发生VTE)更早重启抗凝治疗。现有的指南建议高危患者等待2周或更短时间,低危患者等待7-8周但不超过出血事件后90天重启抗凝。然而,安全重启抗凝治疗应该更早进行,特别是当创伤性ICH不严重和/或复查CT成像显示出血稳定时22,28。这一指导方针基于现有临床证据,并依赖于患者特定的血栓和出血风险因素。
注:接受大剂量维生素K(>2.5mg)逆转的高危华法林患者似乎具有相似的INR降低时间和幅度。但维生素K(一种脂溶性维生素)可能会在重新开始华法林治疗后延迟其治疗效果达数周29。在这种情况下,需要使用LMWH或普通肝素进行抗凝,直到维生素K的作用消失。
抗血小板药物作用的逆转:对于创伤性颅内出血(ICH)患者,抗血小板药物作用的逆转仍具有争议。相关的随机对照试验(RCT)较少,已报道的关于血肿扩大或对神经功能预后影响的数据相互矛盾30-34。最近的一项低质量数据的荟萃分析显示,与未接受治疗的患者相比,接受单一抗血小板药物治疗的患者血肿扩张或需要神经外科干预的情况没有差异35。此外,逆转抗血小板作用的最常见治疗方法(输注血小板和去氨加压素)与不良反应相关,可能导致进一步的并发症和更差的预后。最近一项关于创伤性ICH患者的研究发现,输血组与非输血组在出血进展或神经外科干预率方面无组间差异36。然而,接受血小板输注的患者入住ICU的时间(LOS)(校正后比值比为1.59,95% CI 0.74-3.40)和住院死亡率(校正后比值比为3.23,95% CI 0.48-21.74)有增加的趋势36。有研究表明去氨加压素联合输血对血肿进展或死亡率没有益处37。值得注意的是,接受抗血小板药物治疗且血小板计数低并需要进行侵入性操作(如开颅手术、脑室引流管置入或脑实质型ICP置入)的患者可能受益于手术前输注血小板,以达到一定的功能性血小板循环水平,从而促进手术止血。术后常规血小板输注并不推荐,因为抗血小板药物可能继续影响输注血小板的功能。对于没有额外危险因素的伤前使用抗血小板药物的患者,不推荐仅因这种原因接受血小板输注。
在决定是否实施治疗以逆转伤前抗血小板药物作用时,需要考虑的重要因素包括抗血小板药物的特性和抗血小板活性监测的结果。抗血小板药物分为可逆和不可逆两类。不可逆药物的作用贯穿血小板的整个生命周期(约8-20天)。输注的血小板也会被这些药物抑制,直到不可逆药物从血液中清除,大约是药物半衰期的3-5倍20,38,39。有活性代谢物的抗血小板药物(例如氯吡格雷和替格瑞洛)具有较长的抗血小板活性。对于因伤前抗血小板治疗而怀疑血小板功能障碍的患者,推荐使用床旁血小板功能检测作为标准实验室和/或凝血监测的辅助手段。血小板功能检测有助于识别可能受益于逆转治疗的患者,并降低不必要治疗导致血栓形成的潜在风险38-40。
目前的指南建议所有患者在创伤后急性期停用抗血小板药物。对于需要进行神经外科手术的患者,可考虑单一供体的单采血小板输注(相当于每10公斤体重6个联合单位或1个随机供体单位)20,40。对于接受阿司匹林、氯吡格雷或替格瑞洛治疗的神经外科患者,去氨加压素(0.4 mcg/kg IV)也被建议单独或除血小板输注外考虑使用。如果给予去氨加压素,应监测低钠血症并根据需要进行治疗以达到治疗性钠浓度。建议在输血前尽可能进行血小板功能检测。对于血小板功能正常或有耐药记录的患者,不推荐逆转治疗。对于创伤前接受抗血小板治疗的患者需要进一步的研究来证实这些策略的益处。在获得更多的数据之前,不建议对不适合进行侵入性干预的TBI患者输注血小板和去氨加压素。
重新启动抗血小板药物:在决定创伤性ICH患者是否以及何时重新启动抗血小板治疗时,应考虑抗血小板治疗的原因。研究支持最早在创伤后4天重新开始抗血小板治疗,因为大多数创伤后出血发生在3天内41。重新启动抗血小板药物治疗时,必须权衡重新用药后发生急性和迟发性ICH的风险与可能导致严重临床后果的血栓性并发症的发病率。必须对重新启动抗血小板治疗的风险与获益进行个体化评估。
阵发性交感神经过度兴奋综合征(“自主神经功能障碍","交感神经风暴")
创伤性脑损伤后,患者可能出现交感反馈回路抑制性输入的丧失,导致高血压、心动过速、高热、呼吸急促或出汗等症状。这些症状可以用多种药物治疗,包括β受体阻滞剂(BBKs)、苯二氮卓类药物、阿片类药物、α-2激动剂、加巴喷丁、肌肉松弛剂和巴氯芬。低质量证据表明,BBK的使用与出现阵发性交感神经过度兴奋综合征的重型颅脑创伤患者的死亡率降低有关42-44。到目前为止,大多数较大规模的研究是观察性或回顾性的,存在以下问题:在剂量、BBK的选择以及损伤后的使用时机上不一致;患者特征和不良事件监测的多样性;以及BBK是开始或继续治疗其他合并症还是仅用于TBI肾上腺素能应激42-44。非选择性β受体阻滞剂普萘洛尔在这些适应症中有最多的支持证据。监测BBK的不良反应(如心动过缓、低血压、充血性心力衰竭和支气管痉挛)至关重要,因为这些不良反应可能在TBI后急性期产生不利影响。
意识障碍患者的意识改变持续时间较长,临床检查表现为昏迷、植物状态/无反应觉醒综合征或最小意识状态。在评估和治疗任何混杂因素后,建议对具有植物状态/无反应觉醒综合征或最小意识状态(损伤后4-16周)的成年患者使用金刚烷胺(100-200mg,每日两次),以加速恢复和减少残疾45,46。
接受颅内压(ICP)监测的患者报告的感染率差异很大。脑实质型光纤ICP监护感染率极低,但脑室外引流(EVD)的感染率可能明显升高。制定并遵循医疗机构的脑室外引流和脑实质型ICP(需颅骨螺钉固定)置入及管理方案对降低感染并发症风险至关重要47。在放置脑实质ICP监护器和使用脑实质或脑室外引流期间,应避免使用全身性抗生素预防,以减少耐药菌的风险47,48。最新的脑创伤基金会(BTF)和神经危重症护理学会指南建议在EVD监测期间使用抗菌浸润导管以预防脑室相关感染,但并不是所有医疗机构都能提供这类导管47,49。最近的一项荟萃分析表明,与标准导管组相比,使用抗菌浸润导管可显著降低脑脊液感染率(从13.7%降至3.6%)50。其他降低感染风险的策略包括47:
● 在临床允许的情况下尽早拔除颅内压监护器和引流管
● 避免常规EVD封闭系统操作
● 除非临床需要,否则避免脑脊液采样
● 使用无菌技术
制定EVD管理方案,包括插入检查表、维护工作表、换药程序以及脑脊液取样方案和技术,是降低脑室导管相关感染的另一种策略51。
避免对伴有脑脊液漏或气颅的创伤性颅底骨折患者使用抗生素预防,以减少耐药菌生长的风险。对于开放性或穿透性颅骨骨折患者,可考虑使用血脑屏障渗透性高的广谱抗生素治疗,疗程最多为3天。手术清创和冲洗是推荐的标准治疗方法,围手术期抗生素的使用时间不应超过24小时。
对于手术预防,头孢唑林是非甲氧西林耐药金黄色葡萄球菌感染患者的首选用药,除非患者有严重的β-内酰胺类药物过敏记录。对于那些对β-内酰胺类药物严重过敏的患者,克林霉素或万古霉素是合适的替代选择。考虑到头孢唑林优于其他选择,术前尽可能明确任何抗生素过敏情况。应根据已发表的指南,并结合药剂师的建议,选择合适的抗菌药物及其剂量,以优化治疗效果。
抗凝/抗血小板药物的逆转和重启:尽管老年患者在受伤前因合并症可能使用抗凝和抗血小板药物,但现有证据并不表明使用抗凝或抗血小板药物的老年TBI患者在接受神经外科手术时会有更差预后的风险53-55。然而,使用的抗凝药物类型和抗血小板药物的数量可能会影响预后。无论年龄大小,所有患者重新开始使用抗凝和抗血小板药物的时间是相似的。
抗生素预防:在选择用于外科预防或治疗的抗生素和剂量时,必须考虑老年人的生理、药代动力学和药效学变化,以帮助避免不必要的不良反应或毒性。
PTS预防:儿童数据与成人PTS预防数据一致。PTS可能更容易发生在24个月以下儿童、严重创伤儿童(GCS<8)和遭受非意外创伤的儿童中56-60。尽管左乙拉西坦在儿童TBI的PTS预防中应用越来越普遍,但其疗效证据仍有限,最近的一项观察性试验表明,在TBI后接受左乙拉西坦预防的儿童中,有17%出现了癫痫发作61。因此,在推荐的7天预防疗程中,左乙拉西坦或苯妥英都是合适的。左乙拉西坦副作用易于观察,不需要治疗药物监测。左乙拉西坦最常用的剂量为20-40 mg/kg/天,一天两次。鼓励各机构制定包含基于体重剂量的多学科指南,用于儿童PTS预防。
抗凝/抗血小板药物的逆转和重启:与成人患者一样,在儿科患者中考虑抗凝和抗血小板药物的逆转和重启,需要在做出临床决定之前对每位患者进行彻底的风险-收益分析。
抗生素预防:关于在EVD置入的围手术期以外使用抗生素预防感染的儿童特异性数据有限。对上述成人数据的推断和先前在类似情况下的研究(如脑积水、脑室-腹腔分流失败)仅支持围手术期使用抗菌药物。
1.Salazar AM, Jabbari B, Vance SC, Grafman J, Amin D, Dillon JD. Epi- lepsy after penetrating head injury. I. Clinical correlates: a report of the Vietnam Head Injury Study. Neurology. 1985 Oct;35(10):1406-14. doi: 10.1212/wnl.35.10.1406. PMID: 3929158.
2.Annegers JF, Hauser WA, Coan SP, Rocca WA. A population-based study of seizures after traumatic brain injuries. N Engl J Med. 1998;338:20–24. doi: 10.1056/NEJM199801013380104.
3.Temkin NR, Dikmen SS, Wilensky AJ, Keihm J, Chabal S, Winn HR.
A randomized, double-blind study of phenytoin for the prevention of post-traumatic seizures. N Engl J Med. 1990 Aug 23;323(8):497–502. doi: 10.1056/NEJM199008233230801. PMID: 2115976.
4.Ritter AC, Wagner AK, Fabio A, Pugh MJ, Walker WC, et al. Incidence and risk factors of posttraumatic seizures following traumatic brain injury: A Traumatic Brain Injury Model Systems Study. Epilepsia. 2016 Dec;57(12):1968-1977. doi: 10.1111/epi.13582. Epub 2016 Oct 14. PMID: 27739577.
5.Englander J, Bushnik T, Wright JM, Jamison L, Duong TT. Mortality in late post-traumatic seizures. J Neurotrauma. 2009 Sep;26(9):1471-7. doi: 10.1089/neu.2008.0729. PMID: 19508123; PMCID: PMC2864464.
6.Gilad R, Boaz M, Sadeh M, Eilam A, Dabby R, Lampl Y. Seizures after very mild head or spine trauma. J Neurotrauma. 2013 Mar 15;30(6):469–472. doi: 10.1089/neu.2012.2625.
7.DJohn J, Ibrahim R, Patel P, DeHoff K, Kolbe N. Administration of leve- tiracetam in traumatic brain injury: Is it warranted? Cureus. 2020 Jul 10;12(7):e9117. doi: 10.7759/cureus.9117.
8.Yang Y, Zheng F, Xu X, Wang X. Levetiracetam versus phenytoin for sei- zure prophylaxis following traumatic brain injury: A systematic review and meta-analysis. CNS Drugs. 2016 Aug;30(8):677–688. doi: 10.1007/ s40263-016-0365-0.
9.Kane SP, Bress AP, Tesoro EP. Characterization of unbound phenytoin concentrations in neurointensive care unit patients using a revised Winter-Tozer equation. Ann Pharmacother. 2013 May;47(5):628–636. doi: 10.1345/aph.1R651.
10.von Winckelmann SL, Spriet I, Willems L. Therapeutic drug moni- toring of phenytoin in critically ill patients. Pharmacotherapy. 2008 Nov;28(11):1391–1400. doi: 10.1592/phco.28.11.1391.
11.Yates SL, Fakhoury T, Liang W, Eckhardt K, Borghs S, D’Souza J. An open-label, prospective, exploratory study of patients with epilepsy switching from levetiracetam to brivaracetam. Epilepsy Behav. 2015 Nov;52(Pt A):165–168. doi: 10.1016/j.yebeh.2015.09.005.
12.Cheraghmakani H, Rezapour M, Asghari F, Alizadeh-Navaei, Ghaz- aeian M, Tabrizi N. Pyridoxine for treatment of levetiracetam-induced behavioral adverse events: A randomized double-blind placebo-con- trolled trial. Epilepsy Behav. 2022 Nov;136:108938. doi: 10.1016/j. yebeh.2022.108938.
13.Halma E, de Louw AJ, Klinkenberg S, Aldenkamp AP, IJff DM, Majoie M. Behavioral side-effects of levetiracetam in children with epilepsy: A systematic review. Seizure. 2014 Oct;23(9):685–691. doi: 10.1016/j. seizure.2014.06.004.
14.Strein M, Holton-Burke JP, Stilianoudakis S, Moses C, Almohaish S, Brophy GM. Levetiracetam-associated behavioral adverse events in neurocritical care patients. Pharmacotherapy. 2023 Feb;43(2):122–128. doi: 10.1002/phar.2760.
15.Kowski AB, Weissinger F, Gaus V, Fidzinksi P, Losch F, Holtkamp M. Specific adverse effects of antiepileptic drugs—A true-to-life mono- therapy study. Epilepsy Behav. 2016 Jan;54:150–157. doi: 10.1016/j. yebeh.2015.11.009.
16.Romoli M, Perucca E, Sen A. Pyridoxine supplementation for leve- tiracetam-related neuropsychiatric adverse events: A systematic review. Epilepsy Behav. 2020 Feb;103(Pt A):106861. doi: 10.1016/j. yebeh.2019.106861. Epub 2020 Jan 6. PMID: 31917143.
17.Temkin NR, Dikmen SS, Anderson GD, et al. Valproate therapy for pre- vention of posttraumatic seizures: A randomized trial. J Neurosurg. 1999 Oct;91(4):593–600. doi: 10.3171/jns.1999.91.4.0593.
18.Laible M, Jenetzky E, Beynon C, et al. Adverse events following interna- tional normalized ratio reversal in intracerebral hemorrhage. Cerebro- vasc Dis. 2016;42(5–6):446–454. doi: 10.1159/000448815.
19.Zemrak WR, Smith KE, Rolfe SS, et al. Low-dose prothrombin complex concentrate for warfarin-associated intracranial hemorrhage with INR less than 2.0. Neurocrit Care. 2017 Dec;27(3):334–340. doi: 10.1007/ s12028-017-0422-7.
20.Frontera JA, Lewin JJ III, Rabinstein AA, et al. Guideline for reversal of antithrombotics in intracranial hemorrhage: A statement for healthcare professionals from the Neurocritical Care Society and Society of Critical Care Medicine. Neurocrit Care. 2016 Feb;24(1):6–46. doi: 10.1007/ s12028-015-0222-x.
21.Raval AN, Cigarroa JE, Chung MK, et al. Management of patients on non-vitamin K antagonist oral anticoagulants in the acute care and periprocedural setting: A scientific statement from the American Heart Association. Circulation. 2017 Mar 7;135(10):e604–e633. doi: 10.1161/ CIR.0000000000000477.
22.Witt DM, Nieuwlaat R, Clark NP, et al. American Society of Hematol- ogy 2018 guidelines for management of venous thromboembolism: Optimal management of anticoagulation therapy. Blood Adv. 2018 Nov 27;2(22):3257–3291. doi: 10.1182/bloodadvances.2018024893.
23.Gosselin RC, Adcock DM, Bates SM, et al. International Council for Standardization in Haematology (ICSH) recommendations for labora- tory measurement of direct oral anticoagulants. Thromb Haemost. 2018 Mar;118(3):437–450. doi: 10.1055/s-0038-1627480.
24.Douxfils J, Adcock DM, Bates SM, et al. 2021 update of the Internation- al Council for Standardization in Haematology recommendations for laboratory measurement of direct oral anticoagulants. Thromb Haemost. 2021 Aug;121(8):1008–1020. doi: 10.1055/a-1450-8178.
25.Yee J, Kaide CG. Emergency reversal of anticoagulation. West J Emerg Med. 2019 Aug 6;20(5):770–783. doi: 10.5811/westjem.2018.5.38235.
26.Webb AJ, Brown CS, Naylor RM, Rabinstein AA, Mara KC, Nei AM. Thromboelastography is a marker for clinically significant progressive hemorrhagic injury in severe traumatic brain injury. Neurocrit Care. 2021 Dec;35(3):738–746. doi: 10.1007/s12028-021-01217-0.
27.Cuker A, Burnett A, Triller D, et al. Reversal of direct oral anticoagu- lants: Guidance from the Anticoagulation Forum. Am J Hematol. 2019 Jun;94(6):697–709. doi: 10.1002/ajh.25475.
28.Greenberg SM, Ziai WC, Cordonnier C, et al. 2022 guideline for the management of patients with spontaneous intracerebral hemor- rhage: A guideline from the American Heart Association/American Stroke Association. Stroke. 2022 Jul;53(7):e282–e361. doi: 10.1161/ STR.0000000000000407.
29.Tsu LV, Dienes JE, Dager WE. Vitamin K dosing to reverse warfarin based on INR, route of administration, and home warfarin dose in the acute/critical care setting. Ann Pharmacother. 2012 Dec;46(12):1617– 1626. doi: 10.1345/aph.1R497.
30.Washington CW, Schuerer DJ, Grubb RL Jr. Platelet transfusion: An unnecessary risk for mild traumatic brain injury patients on anti- platelet therapy. J Trauma. 2011 Aug;71(2):358–363. doi: 10.1097/ TA.0b013e318220ad7e.
31.Joseph B, Pandit V, Sadoun M, et al. A prospective evaluation of platelet function in patients on antiplatelet therapy with traumatic intracranial hemorrhage. J Trauma Acute Care Surg. 2013 Dec;75(6):990–994. doi: 10.1097/TA.0b013e3182a96591.
32.Alvikas J, Myers SP, Wessel CB, et al. A systematic review and me- ta-analysis of traumatic intracranial hemorrhage in patients taking prehospital antiplatelet therapy: Is there a role for platelet transfusions? J Trauma Acute Care Surg. 2020 Jun;88(6):847–854. doi: 10.1097/ TA.0000000000002640.
33.Nishijima DK, Zehtabchi S, Berrong J, Legome E. Utility of platelet transfusion in adult patients with traumatic intracranial hemorrhage and preinjury antiplatelet use: A systematic review. J Trauma Acute Care Surg. 2012 Jun;72(6):1658–1663. doi: 10.1097/TA.0b013e318256dfc5.
34.Ogunlade J, Wiginton JG IV, Ghanchi H, et al. Efficacy of platelet trans- fusion in the management of acute subdural hematoma. Clin Neurol Neurosurg. 2018 Nov;174:163–166. doi: 10.1016/j.clineuro.2018.09.021.
35.Mathieu F, Malhotra AK, Ku JC, et al. Pre-injury antiplatelet therapy and risk of adverse outcomes after traumatic brain injury: A systematic review and meta-analysis. Neurotrauma Rep. 2022 Aug;3(1):308–320. doi: 10.1089/neur.2022.0042.
36.Wolff C, Muakkassa F, Marley R, et al. Routine platelet transfusion in patients with traumatic intracranial hemorrhage taking antiplatelet medication: Is it warranted? Can J Surg. 2022 Mar 15;65(2):E206–E211. doi: 10.1503/cjs.018120.
37.Kim DY, O’Leary M, Nguyen A, et al. The effect of platelet and desmo- pressin administration on early radiographic progression of traumatic intracranial hemorrhage. J Neurotrauma. 2015 Nov 15;32(22):1815–1821. doi: 10.1089/neu.2014.3728.
38.Choi PA, Parry PV, Bauer JS, et al. Use of aspirin and P2Y12 response as- says in detecting reversal of platelet inhibition with platelet transfusion in patients with traumatic brain injury on antiplatelet therapy. Neurosur- gery. 2017 Jan 1;80(1):98–104. doi: 10.1227/NEU.0000000000001401.
39.Parry PV, Choi PA, Bauer JS, Panczykowski DM, Puccio AM, Okonkwo DO. Utility of the aspirin and P2Y12 response assays to determine the effect of antiplatelet agents on platelet reactivity in traumat-ic brain injury. Neurosurgery. 2017 Jan 1;80(1):92–96. doi: 10.1227/ NEU.0000000000001406.
40.Spahn DR, Bouillon B, Cerny V, et al. The European guideline on management of major bleeding and coagulopathy following trauma: Fifth edition. Crit Care. 2019 Mar 27;23(1):98. doi: 10.1186/s13054-019- 2347-3.
41.Kerr K, Wilkerson C, Shepard S, Choi HM, Kitagawa. Use of anti-platelet agents after traumatic intracranial hemorrhage. Clin Neurol Neurosurg. 2016 Jan;140:85–90. doi: 10.1016/j.clineuro.2015.11.012.
42.Ding H, Liao L, Zheng X, et al. β-Blockers for traumatic brain injury: A systematic review and meta-analysis. J Trauma Acute Care Surg. 2021 Jun 1;90(6):1077-1085. doi: 10.1097/TA.0000000000003094.
43.Alali A, Mukherjee K, McCredie VA, et al. Beta-blockers and trau- matic brain Injury: A systematic review, meta-analysis, and Eastern Association for the Surgery of Trauma guideline. Ann Surg. 2017 Dec;266(6):952–961. doi: 10.1097/SLA.0000000000002286.
44.Ley EJ, Leonard SD, Barmparas G, et al. Beta blockers in critically ill pa- tients with traumatic brain injury: Results from a multicenter, prospec- tive, observational American Association for the Surgery of Trauma study. J Trauma Acute Care Surg. 2018 Feb;84(2):234–244. doi: 10.1097/ TA.0000000000001747.
45.Giacino JT, Katz DI, Schiff ND, et al. Practice guideline update rec- ommendations summary: Disorders of consciousness: Report of the Guideline Development, Dissemination, and Implementation Sub- committee of the American Academy of Neurology; the American Congress of Rehabilitation Medicine; and the National Institute on Disability, Independent Living, and Rehabilitation Research. Neurology. 2018 Sep 4;91(10):450–460. doi: 10.1212/WNL.0000000000005926. Epub 2018 Aug 8. Erratum in: Neurology. 2019 Jul 16;93(3):135. PMID: 30089618; PMCID: PMC6139814.
46.Giacino JT, Whyte J, Bagiella E, et al. Placebo-controlled trial of amantadine for severe traumatic brain injury. N Engl J Med. 2012 Mar 1;366(9):819–826. doi: 10.1056/NEJMoa1102609. PMID: 22375973.
47.Fried HI, Nathan BR, Rowe AS, et al. The insertion and management of external ventricular drains: An evidence-based consensus statement: [sic] A statement for healthcare professionals from the Neurocritical Care Society. Neurocrit Care. 2016 Feb;24(1):61–81. doi: 10.1007/s12028- 015-0224-8.
48.May AK, Fleming SB, Carpenter RO, et al. Influence of broad-spectrum antibiotic prophylaxis on intracranial pressure monitor infections and subsequent infectious complications in head-injured patients. Surg Infect (Larchmt). 2006 Oct;7(5):409–417. doi: 10.1089/sur.2006.7.409.
49.Carney N, Totten AM, O’Reilly C, et al. Guidelines for the management of severe traumatic brain injury, fourth edition. Neurosurgery. 2017 Jan 1;80(1):6–15. doi: 10.1227/NEU.0000000000001432. PMID: 27654000.
50.Wang X, Dong Y, Qi XQ, Li YM, Huang CG, Hou LJ. Clinical review: Efficacy of antimicrobial-impregnated catheters in external ventricular drainage—a systematic review and meta-analysis. Crit Care. 2013 Jul 25;17(4):234. doi: 10.1186/cc12608.
51.Whyte C, Alhasani H, Caplan R, Tully AP. Impact of an external ventricular drain bundle and limited duration antibiotic prophylaxis on drain-related infections and antibiotic resistance. Clin Neurol Neurosurg. 2020 Mar;190:105641. doi: 10.1016/j.clineuro.2019.105641.
52.Wang HP, Reif RJ, Kalkwarf KJ, Jensen HK, Jenkins AK, Bhavaraju A. Prophylactic antibiotics in patients with traumatic pneumocephalus or cerebrospinal fluid leak. Am Surg. 2023 Jul;89(7):3037–3042. doi: 10.1177/00031348221117041.
53.O’Donohoe RB, Lee HQ, Tan T, et al. The impact of preinjury antiplatelet and anticoagulant use on elderly patients with moderate or severe trau- matic brain injury following traumatic acute subdural hematoma. World Neurosurg. 2022 Oct;166:e521–e527. doi: 10.1016/j.wneu.2022.07.042.
54.Greuter L, Ullmann M, Mariani L, Guzman R, Soleman J. Effect of preoperative antiplatelet or anticoagulation therapy on hemorrhag-ic complications in patients with traumatic brain injury undergoing craniotomy or craniectomy. Neurosurg Focus. 2019 Nov 1;47(5):E3. doi: 10.3171/2019.8.FOCUS19546.
55.Rønning P, Helseth E, Skaansar O, et al. Impact of preinjury antithrom- botic therapy on 30-day mortality in older patients hospitalized with traumatic brain injury (TBI). Front Neurol. 2021 May 13;12:650695. doi: 10.3389/fneur.2021.650695.
56.Liesemer K, Bratton SL, Zebrack CM, Brockmeyer D, Statler KD. Early post-traumatic seizures in moderate to severe pediatric traumatic brain injury: Rates, risk factors, and clinical features. J Neurotrauma. 2011 May;28(5):755–762. doi: 10.1089/neu.2010.1518. PMID: 21381863.
57.Yoon SY, Choi YJ, Park SH, Hwang JH, Hwang SK. Traumatic brain injury in children under age 24 months: Analysis of demographic data, risk factors, and outcomes of post-traumatic seizure. J Korean Neurosurg Soc. 2017 Sep;60(5):584–590. doi: 10.3340/jkns.2016.0707.008.
58.Bansal S, Kebede T, Dean NP, Carpenter JL. Predictors of acute symptomatic seizures after intracranial hemorrhage in infants. Pediatr Crit Care Med. 2014 Oct;15(8):750–755. doi: 10.1097/ PCC.0000000000000221.
59.Ates O, Ondul S, Onal C, et al. Post-traumatic early epilepsy in pediatric age group with emphasis on influential factors. Childs Nerv Syst. 2006 Mar;22(3):279–284. doi: 10.1007/s00381-005-1177-6.
60.Arango JI, Deibert CP, Brown D, Bell M, Dvorchik I, Adelson PD. Post- traumatic seizures in children with severe traumatic brain injury. Childs Nerv Syst. 2012 Nov;28(11):1925–1929. doi: 10.1007/s00381-012-1863- 0.
61.Chung MG, O’Brien NF. Prevalence of early posttraumatic seizures in children with moderate to severe traumatic brain injury despite leveti- racetam prophylaxis. Pediatr Crit Care Med. 2016 Feb;17(2):150–156. doi: 10.1097/PCC.0000000000000588.
译者:中国人民解放军联勤保障部队第九〇四医院神经外科 王玉海、杨理坤● 脑外伤患者伤后即使存在4周甚至更长时间的意识障碍,或伤后持续数周精神状态低迷,其脑功能仍可实现有意义的恢复(即,生活自理)。
● 共同决策以及承认预后的不确定性,是与家属或代理人沟通时推荐采用的方法。
● 过早停止维持生命的治疗可能会导致不良预后的自我应验。
● 为重型创伤性脑损伤患者提供积极治疗,包括必要的手术程序,直至临床团队与患者家属或代理人一致认为进一步此类治疗不符合患者的价值观和偏好。
● 最佳做法是每个创伤中心都应根据公认的标准制定脑死亡判定政策,并与当地法律和政策保持一致。
重型创伤性脑损伤(TBI)患者死亡和长期残疾的风险很高。目前没有足够精确的预后指标能够准确预测不良结果(如死亡、永久性无意识、永久性丧失独立性),尤其是在受伤后的最初几周内。值得注意的是,多达20%的患者在受伤后的前4周内没有恢复意识,但最终脑功能恢复的结果对患方来说是可以接受的1。统计模型包括在初始评估时可用的因素(如年龄、神经功能包括格拉斯哥昏迷量表评分和/或瞳孔反应性、神经影像学结果),并在大量中重度TBI患者中进行了开发和验证。这些模型提供了一些关于预测结果的一般指导。IMPACT和CRASH TBI统计模型是经过最广泛验证的,并且能够产生带有置信区间(CI)的点估计2,3。不建议使用这些结局模型对个体患者进行精准预测。然而,临床医生可以使用这些模型来将预测结果的概率描述为“仅为估计,具有相当大的不确定性”。临床医生与家属沟通方面的专家建议,使用能涵盖患者可能出现的各种结果的语言,同时描述“最好情况”和“最差情况”以及“最有可能”的情况,以此来表达任何预后中固有的不确定性。
众多研究报告称,包括各种神经重症治疗状况(例如脑出血、心脏骤停后的全脑缺血以及创伤性脑损伤)在内,患者不良预后与早期擅自限制治疗有关,包括下达“不要复苏”指令或撤掉维持生命的治疗,这与患者其他因素无关4-6。其他研究发现,在严重颅脑外伤患者病程的早期精准预测长期预后的能力非常有限,且经常不准确,尤其是在受伤后的最初几天7。临床医生对恢复可能性的看法以及医院特定的运行模式等因素,有时被认为与早期治疗限制的广泛差异有关。这些发现加剧了人们的担忧,即严重颅脑外伤患者未予以积极治疗5,6,8。
鉴于这些担忧,对于严重颅脑外伤(TBI)患者,最佳做法是:尽可能提供符合患方预期目标的治疗措施(例如手术、重症监护以及有指征情况下放置颅内压监测)。曾经提倡的积极治疗至少72小时是武断的,没有医学证据。最近的研究报告表明,意识丧失持续4周或更长时间的患者有可能获得良好的预后1,9。这些情况包括:被宣告脑死亡的患者、那些在受伤前有预先声明不希望积极干预的患者,以及当家属或代理人希望只采取基于安慰的措施等。因此,通常需要更长时间的治疗和观察来增加对神经功能恢复预后的确定性10。
年龄通常在预后决策中占很大比重。但是不要孤立地使用这一因素,也不要将其视为做出限制治疗决策的唯一有效理由。除了年龄和颅脑外伤的严重程度外,患者体质虚弱、内科合并症、双瞳孔持续无对光反射以及无神经功能改善也是需要考虑的因素。要确保瞳孔对光反射检查的准确,不受药物或外部损伤(如眼眶创伤)的影响。在进行预后评估时,要确保排除那些会混淆神经系统检查的情况(如镇静或止痛药物,或临床和非惊厥性癫痫发作)。据报道,标准化神经行为评分量表,如昏迷恢复量表修订版,在检测意识状态方面的效果优于床旁定性检查,因此在评估预后时应考虑使用它们11。
最近的一些研究强调了在重症监护病房(ICU)中,以患者为中心的临床医生与患方沟通的重要性,包括重型颅脑外伤(TBI)患者12。这些研究表明,大多数临床医生沟通的方式无法满足代理决策者的需求。代理决策者必须代表患者做出符合个人价值观的决策,然而,突发意外颅脑外伤造成的冲击往往让代理决策者对决策毫无准备。共同决策是一个以患者为中心的过程,在此过程中,临床医生和家属共同努力,以达成患者自己意愿的决策13。它尊重临床医生的专业知识,同时也整合了患者的价值观和偏好。这一过程通常需要双方得到有专门时间并长期持续参与这些对话的各方的帮助(如姑息治疗提供者)。虽然仍在临床试验中进行评估,但正式的共同决策工具(决策辅助)正在开发中,并且已被家属认为非常有帮助。未来可能会将这些工具用来支持临床医生与重型颅脑外伤家属进行沟通。
治疗临床医生与代理决策者之间的沟通需要包括有关病情、治疗和预后的信息,以及如果患者和/或代理人需要并希望进行长期护理,未来可能面临的信息14。让具有姑息治疗和症状缓解专业知识以及社会服务方面的提供者参与进来往往是有帮助的。承认与财务、家庭动态、疼痛和残疾相关的问题是家庭和患者沟通中适当的方面。
脑死亡的判定受州法律管辖。判定脑死亡的规范化标准,应当加以利用15。这些标准具体包括以下内容:
● 患者符合先决条件,包括心肺稳定且无镇静效果。
● 患者对中枢性疼痛无反应,脑干反射缺失,且无自主呼吸。
● 除非无法满足临床检查的前提条件,否则临床检查应优先于诸如脑血流量(CBF)评估之类的辅助性检测。
每家医院都需要根据公认的标准制定明确的脑死亡判定政策。在相关情况下,与当地的器官获取组织合作是合适的,这能为家庭和患者提供器官捐献的机会。
目前还没有针对老年创伤患者(TBI)的最佳预后模型,而且IMPACT和CRASH TBI统计模型中纳入的患者平均年龄在30多岁16。多项研究表明,老年人在受伤前的虚弱状态是导致其预后不良的主要预测因素17-20。美国癌症协会(ACS)的TQIP姑息治疗最佳实践指南建议,对于查出虚弱的患者,应考虑进行姑息治疗咨询,以促进预先治疗计划和目标治疗讨论21。
对于儿童创伤性脑损伤(TBI),预后考虑因素和家庭沟通可能尤其具有挑战性。针对儿童的预测工具不能充分发挥作用,在临床护理中也不被推荐使用。尽管与成人TBI进行直接比较具有挑战性,但由于儿童合并症较少且大脑可塑性能力更强,儿童在遭受类似损伤的情况下可能比成人恢复得更好。事实上,最近的一项研究发现,在严重TBI的儿童中,44%的儿童以及59%的青少年观察到了良好的恢复(格拉斯哥预后量表扩展版评分7或8分)22。因此,在绝大多数严重TBI的儿童中,在儿科重症监护病房进行积极治疗是必要的。
在儿童严重创伤性脑损伤的早期急救治疗中,与家长讨论预后的指导很少。需要注意的是,虐待性头部创伤后的预后可能不同于意外的头部创伤。无论机制如何,医疗人员在塑造家长对预后信息的接受和综合方面发挥着重要作用,这影响着家庭参与共同决策的能力23。在儿童脑损伤的急性阶段评估和支持家长的需求,可能会通过提高家长参与医院护理的能力和减少心理困扰来改善家长和孩子的结局。在怀疑脑死亡的情况下,应使用针对儿童的指南24。
1.Lefering R, Paffrath T, Linker R, et al. Head injury and outcome—McCrea MA, Giacino JT, Barber J, et al. Functional outcomes over the first year after moderate to severe traumatic brain injury in the prospective, lon- gitudinal TRACK-TBI study. JAMA Neurol. 2021 Aug 1;78(8):982–992. doi: 10.1001/jamaneurol.2021.2043.
2.MRC Crash Trial Collaborators, Perel P, Arango M, et al. Predicting outcome after traumatic brain injury: Practical prognostic mod- els based on large cohort of international patients. BMJ. 2008 Feb 23;336(7641):425–429. doi: 10.1136/bmj.39461.643438.25.
3.Steyerberg EW, Mushkudiani N, Perel P, et al. Predicting outcome after traumatic brain injury: Development and international validation of prognostic scores based on admission characteristics. PLoS Med. 2008 Aug 5;5(8):e165; discussion e165. doi: 10.1371/journal.pmed.0050165.
4.Hemphill JC III, Newman J, Zhao S, Johnston SC. Hospital usage of early do-not-resuscitate orders and outcome after intracerebral hemorrhage. Stroke. 2004 May;35(5):1130–1134. doi: 10.1161/01. STR.0000125858.71051.ca.
5.Turgeon AF, Lauzier F, Simard JF, et al. Mortality associated with withdrawal of life-sustaining therapy for patients with severe traumatic brain injury: A Canadian multicentre cohort study. CMAJ. 2011 Oct 4;183(14):1581–1588. doi: 10.1503/cmaj.101786.
6.Williamson T, Ryser MD, Ubel PA, et al. Withdrawal of life-support- ing treatment in severe traumatic brain injury. JAMA Surg. 2020 Aug 1;155(8):723–731. doi: 10.1001/jamasurg.2020.1790.
7.Kaufmann MA, Buchmann B, Scheidegger D, Gratzl O, Radü EW. Severe head injury: Should expected outcome influence resuscitation and first-day decisions? Resuscitation. 1992 Jun–Jul;23(3):199–206. doi: 10.1016/0300-9572(92)90003-u.
8.van Veen E, van der Jagt M, Citerio G, et al. End-of-life practices in traumatic brain injury patients: Report of a questionnaire from the CENTER-TBI study. J Crit Care. 2020 Aug;58:78–88. doi: 10.1016/j. jcrc.2020.04.001.
8.Kowalski RG, Hammond FM, Weintraub AH, et al. Recovery of con- sciousness and functional outcome in moderate and severe traumatic brain injury. JAMA Neurol. 2021 May 1;78(5):548–557. doi: 10.1001/ jamaneurol.2021.0084.
9.Giacino JT, Katz DI, Schiff ND, et al. Comprehensive systematic review update summary: Disorders of consciousness: Report of the Guideline Development, Dissemination, and Implementation Subcommittee of the American Academy of Neurology; the American Congress of Rehabilitation Medicine; and the National Institute on Disability, Independent Living, and Rehabilitation Research. Neurology. 2018 Sep 4;91(10):461–470. doi: 10.1212/WNL.0000000000005928.
11.Schnakers C, Vanhaudenhuyse A, Giacino J, et al. Diagnostic accuracy of the vegetative and minimally conscious state: Clinical consensus versus standardized neurobehavioral assessment. BMC Neurol. 2009 Jul 21;9:35. doi: 10.1186/1471-2377-9-35.
12.Jones K, Quinn T, Mazor KM, Muehlschlegel S. Prognostic uncertain- ty in critically ill patients with traumatic brain injury: A multicenter qualitative study. Neurocrit Care. 2021 Oct;35(2):311–321. doi: 10.1007/ s12028-021-01230-3.
13.Goostrey K, Muehlschlegel S. Prognostication and shared decision mak- ing in neurocritical care. BMJ. 2022 Apr 7;377:e060154. doi: 10.1136/ bmj-2021-060154.
14.Wilson JE, Shinall MC Jr., Leath TC, et al. Worse than death: Survey of public perceptions of disability outcomes after hypothetical traumat- ic brain injury. Ann Surg. 2021 Mar 1;273(3):500–506. doi: 10.1097/ SLA.0000000000003389.
15.Greer DM, Kirsche MP, Lewis A, et al. Pediatric and adult brain death/ death by neurologic criteria consensus guideline: Report of the AAN guidelines subcommittee, AAP, CNS, and SCCM. Neurology. 2023;101(24):1112-1132. doi: 10.1212/WNL.0000000000207740.
16.Chow J, Kuza CM. Predicting mortality in elderly trauma patients: A review of the current literature. Curr Opin Anaesthesiol. 2022 Apr 1;35(2):160–165. doi: 10.1097/ACO.0000000000001092.
17.Cubitt M, Downie E, Shakerian R, Lange PW, Cole E. Timing and methods of frailty assessments in geriatric trauma patients: A systematic review. Injury. 2019 Nov;50(11):1795–1808. doi: 10.1016/j. injury.2019.07.026.
18.Maxwell CA, Mion LC, Mukherjee K, et al. Preinjury physical frailty and cognitive impairment among geriatric trauma patients determine post- injury functional recovery and survival. J Trauma Acute Care Surg. 2016 Feb;80(2):195–203. doi: 10.1097/TA.0000000000000929.
19.Joseph B, Pandit V, Zangbar B, et al. Superiority of frailty over age in predicting outcomes among geriatric trauma patients: A prospective analysis. JAMA Surgery. 2014 Aug;149(8):766–772. doi: 10.1001/jama- surg.2014.296.
20.Hashmi A, Ibrahim-Zada I, Rhee P, et al. Predictors of mortality in geri- atric trauma patients: A systematic review and meta-analysis. J Trauma Acute Care Surg. 2014 Mar;76(3):894–901. doi: 10.1097/TA.0b013e- 3182ab0763.
21.American College of Surgeons Committee on Trauma. ACS TQIP Palli- ative Care Best Practices Guidelines. 2017. https://www.facs.org/media/ g3rfegcn/palliative_guidelines.pdf. Accessed May 26, 2024.
22.Olsen M, Vik A, Lien E, et al. A population-based study of global outcome after moderate to severe traumatic brain injury in children and adolescents. J Neurosurg Pediatr. 2022 Jan 21;29(4):397–406. doi: 10.3171/2021.11.PEDS21285. PMID: 35061977.
23.Roscigno CI, Grant G, Savage TA, Philipsen G. Parent perceptions of early prognostic encounters following children’s severe traumatic brain injury: ‘Locked up in this cage of absolute horror.’ Brain Inj. 2013;27(13– 14):1536–1548. doi: 10.3109/02699052.2013.831122. PMID: 24087991; PMCID: PMC3840124.
24.Nakagawa TA, Ashwal S, Mathur M, et al. Clinical report–Guide- lines for the determination of brain death in infants and children: An update of the 1987 task force recommendations. Pediatrics. 2011 Sep;128(3):e720–e740. doi: org/10.1542/peds.2011-1511.
译者:中国科学技术大学附属第一医院重症医学科 周敏、王天风
● 综合日常治疗和紧急治疗情况后,建议在住院首日即进行多学科联合早期康复治疗。
● 对病情尚未稳定或仍需机械通气支持的TBI患者,早期多学科康复治疗是安全可行且经济的,能够有效减轻因活动受限引发的并发症、重症疾病、谵妄以及认知和心理障碍。
● 建议将物理医学与康复(PM&R)团队纳入TBI患者的治疗小组,以便跟进患者入院后的康复治疗。
● 康复团队应包含物理治疗(PT)、作业治疗(OT)、言语病理(SLP)、心理/神经心理、社会工作及护理等领域的专业人员。
● TBI患者病情稳定后出院时,应转至专业康复机构进一步康复治疗。
● GCS评分在13至15分且伴有长期身体、认知及心理不适主诉/症状的患者,需进行持续的随访观察,并适时转诊至多学科康复中心进行综合治疗。
TBI患者经常面临着由复杂的神经系统损伤、内科并发症及多处外伤构成的严峻挑战,迫切需要专业的创伤管理团队进行全面而协调的干预。为了促进TBI患者尽早并有效地开展康复进程,创伤治疗与康复领域的专家们必须建立起紧密且高效的合作关系。TBI的严重程度各异,其症状范围广泛,从轻微的意识障碍、身体机能受限,到严重的认知障碍、情绪问题、行为异常及功能障碍等均有可能出现。特别是GCS评分在13至15分之间的患者,他们可能会经历急性或持续性的身体不适、认知功能下降以及神经心理学方面的困扰。若未能得到妥善的治疗与持续的关怀,这些症状将严重阻碍患者的日常功能恢复,极大地影响他们参与学校学习、工作等社会活动的能力。
中度至重度TBI患者经历危重病情后,往往会陷入长期的机能丧失状态并需依赖机械通气,这显著提升了罹患各类并发症的风险,并对人体的各大系统均会产生负面影响1。合并症可能包括静脉血栓栓塞、皮肤破损、关节挛缩、谵妄以及ICU获得性虚弱等全身性综合症2,3。值得注意的是,这些不良后果可能会长期存在,甚至持续影响患者多年3,4。在ICU内,采用基于证据的ABCDEF集束化治疗策略,通过有效管理疼痛、躁动、谵妄、机能丧失及睡眠问题,不仅能够显著降低患者的死亡率,还能有效减少并发症的发生,促进功能恢复,进而提升患者的生活质量5,6。此外,最新的研究强调了早期康复干预对TBI患者的重要性。通过及时的康复措施,可以减轻机能丧失的程度,预防继发性并发症的发生,并显著改善患者的功能状态7。
2022年发布的《ACS优化治疗资源》标准旨在指导创伤救治中合理配置人员与资源,以支持中度至重度TBI患者接受多学科联合早期康复运动与治疗。这些早期干预措施对于加速康复进程至关重要8,9。实施多学科康复不仅有助于缩短住院天数(LOS),降低医疗成本及资源消耗,还能最大化患者的长期功能恢复4。康复专家凭借丰富的经验,能够在早期阶段提供精准的评估与高效的治疗干预,客观评估干预效果,密切监控患者的生理反应,并循序渐进地调整治疗强度。这些措施不仅有助于稳定病情,还能促进日常功能活动的恢复,准确量化患者的康复进展。此外,康复专家还能为创伤救治团队提供基于证据的专业建议,指导治疗决策与出院规划,从而全面提升患者的康复效果。
当康复专家加入创伤团队治疗时,早期康复的益处尤为显著。这一多学科创伤治疗团队应包含PM&R医生、护士、PT、OT、SLP、心理学家/神经心理学家以及社会工作者等角色。其中,PM&R医生作为团队的核心成员,建议自患者入院首日即开始参与患者的临床管理。早期PM&R咨询不仅与患者活动能力和认知独立性的提升密切相关,还能有效缩短急性治疗阶段的住院时间10。此外,PM&R医生还能提供对康复预期结果的深刻洞察,并协助团队进行预后沟通。
在早期阶段,通过PT、OT、SLP及专业护理团队的协同介入,实施多学科康复干预,这些干预措施能够在患者病床边高效执行,从而确保医疗安全。对于遭遇严重TBI并伴有意识障碍的患者,PT、OT及SLP的治疗策略应聚焦于意识水平(LOC)的系统性评估、运用多元化刺激策略以优化唤醒状态、环境适应性训练及早期功能性活动促进,以加速患者的全面康复进程11。
早期活动:是指在受伤后的48小时内,或在神经系统状态、血流动力学及呼吸功能稳定之后立即开始的被动活动。大量证据已证实了早期活动的有效性1,4,9,12。关于早期活动的具体内容,请参见方框6。
• 关节被动活动
• 关节主动活动
• 床上移动
• 下肢功率车
• 神经肌肉电刺激
• 体位适应性训练
• 坐位训练
• 体位转移
• 离床活动
• 步行训练
• 抗阻运动及日常生活活动
这些干预措施构成了ICU早期康复的核心,旨在缓解因缺乏活动所带来的不良影响,并且这些措施安全可行12,13。简单的干预手段,例如被动运动和使用夹板,可以在患者入院后不久即开始实施,以保持关节的活动度,预防挛缩,并减轻日后可能出现的残疾程度。这些措施同样适用于那些需要持续治疗以控制颅内压或应对突发性交感神经亢进症状的患者14,15。注:对于伤势较重的患者,需谨慎采取干预措施,因为只有在确保患者达到血液动力学和通气稳定状态,且颅内高压不再是显著问题之后,有些措施(如床外活动)才适宜实施。
创伤后意识模糊和躁动的处理:中度至重度TBI患者常展现出创伤后意识模糊状态与躁动的临床表现,其中躁动症状在约40%的病例中颇为显著16。鉴于有证据表明苯二氮卓类药物和典型抗精神病药物可能会延长神经认知恢复,因此不建议在急性期使用这些药物。相反,非典型抗精神病药物及β受体阻滞剂如普萘洛尔等,可作为急性期躁动管理的替代方案,以确保患者和工作人员的安全17。多学科团队对创伤后意识模糊状态和躁动进行的康复评估与治疗,有助于探索并实施行为矫正方法。这些方法旨在促进患者对康复过程的积极参与,最大程度降低依赖性,提升整体安全性,并限制对药物干预的依赖需求18。
提升自理能力和日常生活活动(ADLs)的干预措施:通过SLP和OT的评估与治疗,可以有效改善吞咽困难及其他口腔运动功能障碍,进而优化营养摄入并使饮食习惯回归正常。此外,SLP和OT专业人员还能评估患者对替代及辅助沟通系统的需求,以增强人际互动并提升患者自主能力19。一项随机对照试验的证据显示,在创伤后意识模糊期间即可开始自我护理与生活自理能力的再培训,此举能够加速功能独立性的恢复并缩短住院时长20。
高达90%的TBI患者的GCS评分处于13至15分之间21。若未能及时接受治疗,这些症状可能会持续数月乃至数年,进而可能导致残疾。对于GCS评分在13至15分之间的TBI且症状持续存在的患者,可以转诊至门诊或社区的多学科康复团队继续进行治疗。助力患者顺利回归原有的生活方式和重返工作岗位,由运动医学专家、PM&R、PT、OT、SLP以及神经心理学家组成的多学科康复团队,能够综合运用多学科的知识与技能,提供全面深入的评估与个性化的治疗建议,有效应对并解决患者持续存在的症状。
建议完善从急诊科、ICU及急症治疗延伸至出院后的持续且个性化的康复服务链,特别关注出院后治疗的协调与连续性。对于住院患者,一旦进入创伤病房,应尽早规划下一阶段的出院护理计划。急性期之后的护理选择涵盖了多种途径,包括长期急性治疗医院、住院式康复机构、专业护理设施、门诊康复项目,以及家庭和社区服务等多种灵活选择8。
许多中度或重度TBI患者面临复杂且持久的医疗需求,这促使他们在住院康复环境中接受不持续不断的医疗与护理管理。核心目标是制定周密的出院治疗计划,确保为患者提供充分的支持与专业指导,全面满足患者的医疗、功能恢复及神经行为需求,进而推动其康复治疗的持续进行。现有研究表明,接受专业急性后康复服务的中度或重度TBI患者,在实现功能独立及改善长期预后方面展现出更高的成功率23,24。因此,规划从住院治疗平稳过渡到门诊及社区服务至关重要,这不仅能为患者及其家属提供必要的支持,还能帮助他们有效的应对医疗保健系统,确保顺利的管理患者的康复治疗过程25。
针对老年TBI患者的康复,现有指导证据较为匮乏。然而,老年人急性治疗(ACE)单位模式为康复提供了良好的急性护理环境。大量研究证实,ACE模式能改善老年急性患者的预后,尤其是早期活动对老年髋部骨折患者的康复具有积极影响2,7。此外,多数关注成人重症监护早期活动的研究也纳入了60岁以上的患者7,9。综上所述,这些证据均支持老年TBI患者应接受早期康复与活动。鉴于老年人医疗并发症风险高、护理负担重、出院后可能面临的康复机构环境适应及生活质量下降等问题,建议与具备老年医学专业知识在内的多学科团队共同制定急性治疗康复计划26。大多数ACE单元模型的关键要素需涵盖全面的康复策略,包括活动、谵妄预防、减少不当用药/多重用药,以及根据个人治疗目标,着重于功能改善或维持。
TBI患儿有发生镇静、制动和谵妄相关危重症及并发症的风险。近期一项综述报道,47%患儿在ICU出院时伴有整体功能障碍,76%患儿出院后6个月仍存在残疾27。对需要重症监护的患儿进行多学科联合康复治疗能安全有效地减少不良事件发生;缩短机械通气、卧床及ICU监护天数,减少并发症和降低谵妄28,29。研究还发现多学科联合的早期康复治疗可改善儿童和青少年TBI患者的功能结局,减轻家庭和照顾者的负担30。同时,我们也应重视患者受伤前的人格特征或精神状态。行为健康医学作为多学科联合康复体系的重要补充,能够为患者提供包括非药理学与药理学在内的综合建议。
1.Timmerman RA. A mobility protocol for critically ill adults. Dimens Crit Care Nurs. 2007 Sep-Oct;26(5):175-179. doi: 10.1097/01. DCC.0000286816.40570.da.
2.Banerjee A, Girard TD, Pandharipande P. The complex interplay between delirium, sedation, and early mobility during critical ill-ness: Applications in the trauma unit. Curr Opin Anaesthesiol. 2011 Apr;24 (2): 195–201. doi: 10.1097/ ACO.0b013e3283445382.
3.Desai SV, Law TJ, Needham DM. Long-term complications of critical care. Crit Care Med. 2011 Feb;39(2):371–379. doi: 10.1097/CCM.0b013e3181fd66e5.
4.Hashem MD, Nelliot A, Needham DM. Early mobilization and rehabilitation in the ICU: Moving back to the future. Respir Care. 2016 Jul;61(7):971–979. doi: 10.4187/respcare.04741.
5.Devlin JW, Skrobik Y, Gélinas C, et al. Clinical practice guidelines for the prevention and management of pain, agitation/sedation, delirium, immobility, and sleep disruption in adult patients in the ICU. Crit Care Med. 2018 Sep;46(9):e825–e873. doi: 10.1097/CCM.0000000000003299.
6.Sosnowski K, Lin F, Chaboyer W, Ranse K, Heffernan A, Mitchell M. The effect of the ABCDE/ABCDEF bundle on delirium, functional outcomes, and quality of life in critically ill patients: A systematic review and meta-analysis. Int J Nurs Stud. 2023 Feb;138:104410. doi: 10.1016/j. ijnurstu.2022.104410.
7.Bartolo M, Bargellesi S, Castioni CA, et al. Mobilization in early rehabilitation in intensive care unit patients with severe acquired brain injury: An observational study. J Rehabil Med. 2017 Nov 21;49(9):715–722.doi: 10.2340/16501977-2269.
8.American College of Surgeons. Resources for Optimal Care of the Injured Patient. Chicago, IL. 2022. https://www.facs.org/quality-programs/trauma/quality/verification-review-and-consultation-program/standards/. Accessed May 29, 2024.
9.Naess HL, Vikane E, Wehling EI, Skouen JS, Bell RF, Johnsen LG. Effect of early interdisciplinary rehabilitation for trauma patients: A systematic review. Arch Rehabil Res Clin Transl. 2020 Jun 25;2(4):100070. doi: 10.1016/j.arrct.2020.100070.
10.Greiss C, Yonclas PP, Jasey N, et al. Presence of a dedicated trauma center physiatrist improves functional outcomes following traumatic brain injury. J Trauma Acute Care Surg. 2016 Jan;80(1):70–75. doi:10.1097/TA.0000000000000890.
11.Weaver JA, Watters K, Cogan AM. Interventions facilitating recovery of consciousness following traumatic brain injury: A systematic review. OTJR (Thorofare N J). 2023 Apr;43(2):322–336. doi:10.1177/15394492221117779.
12.Needham DM, Korupolu R, Zanni JM, et al. Early physical medicine and rehabilitation for patients with acute respiratory failure: A quality improvement project. Arch Phys Med Rehabil. 2010 Apr;91(4):536–542. doi: 10.1016/j.apmr.2010.01.002.
13.Schweickert WD, Pohlman MC, Pohlman AS, et al. Early physical and occupational therapy in mechanically ventilated, critically ill patients: A randomised controlled trial. Lancet. 2009 May;373(9678):1874–1882. doi: 10.1016/S0140-6736(09)60658-9.
14.Thomas A, Greenwald BD. Paroxysmal sympathetic hyperactivity and clinical considerations for patients with acquired brain injuries: A narrative review. Am J Phys Med Rehabil. 2019 Jan;98(1):65–72. doi: 10.1097/PHM.0000000000000990.
15.Roth C, Stitz H, Kalhout A, Kleffman J, Deinsberger W, Ferbert A. Effect of early physiotherapy on intracranial pressure and cerebral perfusion pressure. Neurocrit Care. 2013 Feb;18(1):33–38. doi: 10.1007/s12028-012-9799-5.
16.Phyland RK, Ponsford JL, Carrier SL, Hicks AJ, McKay A. Agitated behaviors following traumatic brain injury: A systematic review and meta-analysis of prevalence by post-traumatic amnesia status, hospital setting, and agitated behavior type. J Neurotrauma. 2021 Nov 15;38(22):3047–3067. doi: 10.1089/neu.2021.0257.
17.Rahmani E, Lemelle TM, Samarbafzadeh E, Kablinger AS. Pharmacological treatment of agitation and/or aggression in patients with traumatic brain injury: A systematic review of reviews. J Head Trauma Rehabil. 2021 Jul–Aug;36(4):E262–E283. doi: 10.1097/HTR.0000000000000656.
18.Mortimer DS, Berg W. Agitation in patients recovering from traumatic brain injury: Nursing management. J Neurosci Nurs. 2017 Feb;49(1):25-30. doi: 10.1097/JNN.0000000000000253.
19.Baumgartner CA, Bewyer E, Bruner D. Management of communication and swallowing in intensive care: The role of the speech pathologist. AACN Adv Crit Care. 2008 Oct–Dec;19(4):433–443. doi: 10.1097/01.AACN.0000340724.80280.31.
20.Trevena-Peters J, McKay A, Spitz G, Suda R, Renison B, Ponsford J. Efficacy of activities of daily living retraining during posttraumatic amnesia: A randomized controlled trial. Arch Phys Med Rehabil. 2018 Feb;99(2):329–337.e2. doi: 10.1016/j.apmr.2017.08.486.
21.Silverberg ND, Iaccarino MA, Panenka WJ, et al. Management of concussion and mild traumatic brain injury: A synthesis of practice guidelines. Arch Phys Med Rehabil. 2020 Feb;101(2):382–393. doi: 10.1016/j. apmr.2019.10.179. Epub 2019 Oct 23. PMID: 31654620.
22.Andelic N, Bautz-Holter E, Rønning P, et al. Does an early onset and continuous chain of rehabilitation improve the long-term functional outcome of patients with severe traumatic brain injury? J Neurotrauma. 2012 Jan;29(1):66–74. doi: 10.1089/neu.2011.1811.
23.Giacino JT, Katz DI, Schiff ND, et al. Practice Guideline Update Recommendations Summary: Disorders of Consciousness: Report of the Guideline Development, Dissemination, and Implementation Subcommittee of the American Academy of Neurology; the American Congress of Rehabilitation Medicine; and the National Institute on Disability, Independent Living, and Rehabilitation Research. Arch Phys Med Rehabil. 2018 Sep;99(9):1699–1709. doi: 10.1016/j.apmr.2018.07.001.
24.Kowalski RG, Hammond FM, Weintraub AH, et al. Recovery of consciousness and functional outcome in moderate and severe traumatic brain injury. JAMA Neurol. 2021 May 1;78(5):548–557. doi: 10.1001/jamaneurol.2021.0084.
25.Oyesanya TO, Loflin C, Harris G, Bettger JP. “Just tell me in a simple way”: A qualitative study on opportunities to improve the transition from acute hospital care to home from the perspectives of patients with traumatic brain injury, families, and providers. Clin Rehabil. 2021 Jul;35(7):1056–1072. doi: 10.1177/0269215520988679.
26.Laic RA, Bogaert L, Sloten JV, Depreitere B. Functional outcome, dependency and well-being after traumatic brain injury in the elderly population: A systematic review and meta-analysis. Brain Spine. 2021 Dec 2;1:100849. doi: 10.1016/j.bas.2021.100849.
27.Watson RS, Choong K, Colville G, et al. Life after critical illness in children-Toward an understanding of pediatric post-intensive care syndrome. J Pediatr. 2018 Jul;198:16–24. doi: 10.1016/j.jpeds.2017.12.084.
28.Wieczorek B, Burke C, Al-Harbi A, Kudchadkar SR. Early mobilization in the pediatric intensive care unit: A systematic review. J Pediatr Intensive Care. 2015;2015(4):129–170. doi: 10.1055/s-0035-1563386.
29.Smith HA, Besunder JB, Betters KA, et al. 2022 Society of Critical Care Medicine clinical practice guidelines on prevention and management of pain, agitation, neuromuscular blockade, and delirium in critically ill pediatric patients with consideration of the ICU environment and early mobility. Pediatr Crit Care Med. 2022 Feb 1;23(2):e74-e110. doi: 10.1097/PCC.0000000000002873.
30.Popernack ML, Gray N, Reuter-Rice K. Moderate-to-severe traumatic brain injury in children: Complications and rehabilitation strategies. J Pediatr Health Care. 2015 May–Jun;29(3):e1-7. doi: 10.1016/j.pedhc.2014.09.003.
● 在急重患者出院前,教育患者家属重视颅脑创伤后癫痫(PTE)的体征和症状,包括意识水平的微小改变。
● 随访期间筛查患者是否存在PTE,当患者存在癫痫发作的潜在风险时安排进一步的检查明确诊断。
● 合并PTE的患者需要使用抗癫痫发作药物(ASM),并转诊至具有PTE管理经验的临床医生。
● 根据患者PTE的临床特点,制定个体化的ASM疗法和持续时间,包括癫痫发作是否控制、药物的副作用和其他治疗方案,如饮食调整、神经调控和其他手术方法。
● PTE的发生率随着时间的推移而增加,应对有TBI病史的老年人进行持续随访筛查,特别是有PTE高危因素的患者。
在早期基于人群的研究中,TBI约占癫痫发作病因的4%1,2,其他研究的发病率高达20%3,4。晚期发作PTS被定义为在损伤7天后发生的癫痫。一般来说,不建议使用ASM预防晚期癫痫发作,因为对许多患者来说,其潜在的副作用超过了癫痫发作的风险5-7。很大一部分TBI患者合并PTE,导致更高的致死率和致残率,这些患者都需要及时有效的治疗3,8,9。框7中列出了PTE发作的危险因素。
框7.颅脑创伤后癫痫发作的高危因素
此外,TBI后PTE的累积风险(随着时间的推移发病率增加)更大,特别是中重型TBI2。研究指出合并脑出血和颅脑损伤严重程度更高的患者更易合并早期发作PTE2。鉴于PTE的累积发病率随时间增加,应仔细监测随访有TBI病史的老年患者,特别是合并PTE高危风险的患者。
一项基于人群的研究发现,与普通人群相比,轻度TBI患者在10年内癫痫发作的风险更高(相对风险为2.06-3.51,随年龄增加而增加)11。PTE更常见于颅脑损伤更严重的患者(相对风险为4.91-12.24,取决于年龄组)。对于轻度和重度TBI,年龄>15岁的患者发生PTE的风险最高,且癫痫多发生在受伤后早期。PTE高风险患者及其家庭需要接受PTE临床体征和症状的培训,对PTE的发作保持警惕,并由合格的专业人员进行长期随访13。
目前尚不清楚合并PTE患者的死亡率和预后是否更差,或者患者的预后是否主要与其损伤严重程度有关(这也与PTE发生相关)。最近的一些研究证明了患者预后与PTE相关。
在一项控制年龄、GCS评分和影像学结果的大型前瞻性队列研究中,PTE患者的GOS-E评分明显降低,并且在Rivermead行为记忆评估量表和18项简要症状量表的评分均低于对照组14。这项研究使用美国国立卫生研究院的卒中相关癫痫筛查工具来识别自我诊断的癫痫发作。TBI组自我报告的癫痫发作发生率与之前发表的报告一致,两个对照组没有自我报告的癫痫发作,这表明该种筛查工具对TBI人群的可靠性。重要的是,该研究确定了自我报告的癫痫发作与不良功能预后以及持续性创伤后癫痫的相关性14。其他研究报告指出,在控制其他因素后,合并PTE的TBI患者的死亡率高于无PTE的TBI患者4,15,16。这些最新的证据表明,PTE增加了TBI幸存者的致死率和致残率。
关于抗癫痫发作药物的选择和治疗时间超出了本次最佳实践指南的讨论范围。对TBI后首次出现癫痫的患者,应将患者转诊至在PTE管理方面专业性更强的临床医生,因为PTE首次发作后,2年内复发癫痫的可能性高达86%8。PTE患者抗癫痫发作药物的选择和持续时间必须根据患者的临床特点个体化制定,包括但不限于癫痫发作是否控制、副作用和其他类型治疗的选择(例如,饮食调整、神经调控或其他手术方法)。
老年人比年轻人具有更高的跌倒风险,无论TBI的严重程度如何,由于跌倒而导致的TBI具有最高的PTE风险17。由于合并造成癫痫发作的共病(如卒中和痴呆),老年人的PTE风险也会进一步增加。抗癫痫发作药物间的相互作用也会使这一问题进一步复杂化18,19。建议选择对认知影响最小和药物相互作用最少的抗癫痫发作药物治疗老年人群PTE。
虽然儿童在TBI后早期癫痫发作的风险高于成人20,但在儿童中发生PTE的情况较少,除非是在虐待性头部外伤的情况下21。抗癫痫发作药物对于预防儿童迟发型癫痫发作无效22。建议将TBI后出现晚期癫痫发作的儿童转诊至具有儿科和癫痫专业知识的医师,如小儿神经科医师。
1.Hauser WA, Annegers JF, Rocca WA. Descriptive epidemiology of epilepsy: Contributions of population-based studies from Rochester, Minnesota. Mayo Clin Proc. 1996 Jun;71(6):576–586. doi: 10.4065/71.6.576. PMID: 8642887.
2.Herman ST. Epilepsy after brain insult: Targeting epileptogenesis. Neurology. 2002 Nov 12;59(9 Suppl 5):S21–S26. doi: 10.1212/wnl.59.9_suppl_5.s21. PMID: 12428028.
3.Annegers JF, Hauser WA, Coan SP, Rocca WA. A population-based study of seizures after traumatic brain injuries. N Engl J Med. 1998;338:20–24. doi: 10.1056/NEJM199801013380104. PMID: 9414327.
4.Karlander M, Ljungqvist J, Sörbo A, Zelano J. Risk and cause of death in post-traumatic epilepsy: A register-based retrospective cohort study. J Neurol. 2022 Nov;269(11):6014–6020. doi: 10.1007/s00415-022-11279-
5.Epub 2022 Jul 19. PMID: 35852600; PMCID: PMC9553825. 5. Temkin NR, Dikmen SS, Wilensky AJ, Keihm J, Chabal S, Winn HR. A randomized, double-blind study of phenytoin for the prevention of post-traumatic seizures. N Engl J Med. 1990 Aug 23;323(8):497–502. doi: 10.1056/NEJM199008233230801. PMID: 2115976.
6.Carney N, Totten AM, O’Reilly C, et al. Guidelines for the management of severe traumatic brain injury, fourth edition. Neurosurgery. 2017 Jan 1;80(1):6–15. doi:10.1227/NEU.0000000000001432. PMID: 27654000.
7.Chang BS, Lowenstein DH, Quality Standards Subcommittee of the American Academy of Neurology. Practice parameter: Antiepileptic drug prophylaxis in severe traumatic brain injury: Report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology. 2003 Jan 14;60(1):10–16. doi: 10.1212/01. wnl.0000031432.05543.14. PMID: 12525711.
8.Haltiner AM, Temkin NR, Dikmen SS. Risk of seizure recurrence after the first late posttraumatic seizure. Arch Phys Med Rehabil. 1997 Aug;78(8):835–840. doi:10.1016/s0003-9993(97)90196-9. PMID: 9344302.
9.Pease M, Elmer J, Shahabadi AZ, et al. Predicting posttraumatic epilepsy using admission electroencephalography after severe traumatic brain injury. Epilepsia. 2023 Jul;64(7):1842–1852. doi: 10.1111/epi.17622. Epub 2023 May 6. PMID: 37073101. 10. Temkin NR. Risk factors for posttraumatic seizures in adults. Epilepsia. 2003;44(s10):18–20. doi: 10.1046/j.1528–1157.44.s10.6.x. PMID: 14511390.
11.Christensen J, Pedersen MG, Pedersen CB, Sidenius P, Olsen J, Vestergaard M. Long-term risk of epilepsy after traumatic brain injury in children and young adults: A population-based cohort study. Lancet. 2009 Mar 28;373(9669):1105–1110. doi: 10.1016/S0140-6736(09)60214-2. Epub 2009 Feb 21. PMID: 19233461.
12.Ferguson PL, Smith GM, Wannamaker BB, Thurman DJ, Pickelsimer EE, Selassie AW. A population-based study of risk of epilepsy after hospitalization for traumatic brain injury.Epilepsia. 2010 May;51(5):891–898. doi: 10.1111/j.1528-1167.2009.02384.x. Epub 2009 Oct 20. PMID:
19845734.
13.Englander J, Bushnik T, Wright JM, Jamison L, Duong TT. Mortality in late post-traumatic seizures. J Neurotrauma. 2009 Sep;26(9):1471–1477. doi: 10.1089/neu.2008.0729. PMID: 19508123; PMCID: PMC2864464.
14.Burke J, Gugger J, Ding K, et al. Association of posttraumatic epilepsy with 1-year outcomes after traumatic brain injury. JAMA Netw Open. 2021 Dec 1;4(12):e2140191. doi: 10.1001/jamanetworkopen.2021.40191. PMID: 34964854; PMCID: PMC8717106.
15.Uski J, Lamusuo S, Teperi S, Löyttyniemi E, Tenovuo O. Mortality after traumatic brain injury and the effect of posttraumatic epilepsy. Neurology. 2018 Aug 28;91(9):e878–e883. doi: 10.1212/
WNL.0000000000006077. Epub 2018 Aug 1. PMID: 30068629.
16.Lin WJ, Harnod T, Lin CL, Kao CH. Mortality risk and risk factors in patients with posttraumatic epilepsy: A population-based cohort study. Int J Environ Res Public Health. 2019 Feb 18;16(4):589. doi: 10.3390/ ijerph16040589. PMID: 30781634; PMCID: PMC6406809.
17.Karlander M, Ljungqvist J, Zelano J. Post-traumatic epilepsy in adults: A nationwide register-based study. J Neurol Neurosurg Psychiatry. 2021 Mar 9;92(6):617–621. doi: 10.1136/jnnp-2020-325382. PMID: 33687971; PMCID: PMC8142432.
18.Lee SK. Epilepsy in the elderly: Treatment and consideration of comorbid diseases. J Epilepsy Res. 2019 Jun 30;9(1):27–35. doi: 10.14581/ jer.19003. PMID: 31482054; PMCID: PMC6706648.
19.Keret O, Hoang TD, Xia F, Rosen HJ, Yaffe K. Association of late-onset unprovoked seizures of unknown etiology with the risk of developing dementia in older veterans. JAMA Neurol. 2020 Jun 1;77(6):710–715.doi: 10.1001/jamaneurol.2020.0187. PMID: 32150220; PMCID: PMC7063560.
20.Liesemer K, Bratton SL, Zebrack CM, Brockmeyer D, Statler KD. Early post-traumatic seizures in moderate to severe pediatric traumatic brain injury: Rates, risk factors, and clinical features. J Neurotrauma. 2011 May;28(5):755–762. doi: 10.1089/neu.2010.1518. PMID: 21381863.
21.Barlow KM, Spowart JJ, Minns RA. Early posttraumatic seizures in non-accidental head injury: Relation to outcome. Dev Med Child Neurol. 2000 Sep;42(9):591–594. doi:10.1017/s0012162200001110. PMID: 11034451.
22.Samara QA, Ifraitekh AS, Al Jayyousi O, Sawan S, Hazaimeh E, Jbarah OF. Use of antiepileptic drugs as prophylaxis against posttraumatic seizures in the pediatric population: A systematic review and meta-analysis. Neurosurg Rev. 2023 Feb 7;46(1):49. doi: 10.1007/s10143-
023-01963-z. PMID: 36746821.
格拉斯哥昏迷量表(GCS)评分为13-15分患者的管理
译者:空军军医大学唐都医院神经外科 葛顺楠、肖海明
● 尽管许多GCS评分为13-15分的创伤性脑损伤(TBI)患者经过相对较短的时间就可以完全康复,但仍有相当一部分患者其症状持续存在,对其日常活动能力造成不良影响。
● 据估计,在受伤后GCS评分为13-15分的急诊患者中,约有50%的患者未被发现并诊断为TBI。
● 建议将决策支持工具和临床实践指南纳入标准临床工作流程,以识别GCS评分为13-15分的TBI患者,以促进最佳的病情评估和治疗。
● 在对GCS评分为13-15分的TBI患者实施急性期管理时,应遵循本更新版最佳实践指南(BPG)中提出的更广泛的建议,包括诊断性检测、个体化治疗、出院指导、疗效评估。
● 对GCS评分为13-15分的患者进行伤情教育,并为存在持续症状的患者群体推荐后续治疗的途径。讨论恢复日常活动(如工作、学习和驾驶)的时机,并提供个性化治疗以最大程度恢复患者功能。
在美国医院急诊科每年接诊的近500万名疑似TBI患者中,约90%的患者GCS评分为13-15分,即一直被归类为轻型TBI的患者1,2。这一程度的损伤在发生TBI的美军服役人员中占比80%3,4,还发生于全球每年数百万受运动相关脑震荡影响的运动员5。实践指南和其他有益资源可帮助临床医生诊断和管理GCS评分为13-15分的TBI患者6,7。
针对GCS评分为13-15分TBI患者的急性期管理面临诸多挑战。最值得注意的是,在急诊单元的诊断主要依赖于患者对体征和症状的主观报告。然而,由于存在头部损伤,急诊患者的病史和症状报告经常不可靠,还经常受到头部损伤以外诸多因素的影响,例如:
● 药物或酒精中毒
● 合并骨科损伤
● 镇痛治疗
● 在收集准确受伤病史、症状以及受伤机制方面固有的不确定性8
即使是在GCS13-15分的连续范围内,患者脑部损伤的严重程度也有很大的差异。(例如,GCS评分为15分的患者神经影像正常,仅有轻微的损伤;而GCS评分为13分的患者影像上有广泛的病理改变,损伤更为严重)。医院急诊科工作量大、接待患者数量多,且以急诊救治为主,除了体格检查和头部CT外,可能无法进行更多更深入的临床检查(如神经心理学测试)来协助对GCS评分为13-15分TBI患者的诊断。这些挑战在一定程度上导致了每年估计有50%的GCS评分为13-15分TBI患者在医院急诊科未被发现和正确诊断9–11。
在急诊科急救环节,在治疗疑似颅脑外伤患者(包括GCS评分为13-15分的TBI患者)时,当务之急是识别有病情恶化风险且可能需要紧急神经外科手术干预的患者。大多数GCS评分为13-15分的TBI患者行头颅CT检查时未发现颅内创伤性病变。然而,有报道显示,在一级创伤中心接受治疗的GCS评分较低的轻型TBI患者,其头颅CT检查的异常率较高12。不管怎样,头颅CT仍是识别GCS评分为13-15分的TBI患者颅内血肿的标准。针对高危TBI患者使用CT影像的临床决策规则已经存在,可用于减少不必要的CT检查。使用神经影像检查和血液生物标记物检测对GCS评分为13-15分的TBI患者进行评估的具体内容,详见“血液生物标记物”章节。
GCS评分为13-15分的TBI患者的常见症状包括头痛、头晕、视觉-眼球运动障碍、认知功能障碍、睡眠问题、感觉功能障碍、心理健康问题等。通常情况下,症状在急性期(伤后最初几天内)最为严重,随着时间的推移会逐渐改善。相当一部分患者在相对较短的时间内(数天至数周)可以完全康复,但至少有一半患者在受伤后数月或数年内会持续经历认知、躯体和心理症状,对其正常日常活动能力造成不良影响12,13。在急诊科接受评估且诊断为GCS评分为13-15分的TBI患者中,约有50%的患者在伤后12个月时仍未完全康复12。损伤因素(如急性损伤的严重程度、CT病理改变等)和非损伤因素(如受伤前的精神疾病病史、神经系统易受损性、社会困境等)的综合作用会增加这些患者恢复期延长和/或功能预后不良的风险。
为患者提供有关其损伤、预期恢复和后续护理途径的健康教育资源。针对持续存在(超过伤后两周)症状或障碍的患者,可能需要针对其具体症状进行更特异的评估和治疗。支持性护理和康复疗法可有效治疗GCS评分为13-15分的TBI患者,最大程度的恢复患者的功能。在美国和全世界范围内的确都缺乏针对这些患者的后续护理体系。除了有数据显示在急诊科对GCS评分为13-15分的TBI患者检出率相对较低,最近的研究还表明,大多数患者在出院时也没有获得有用的信息和健康教育资源,更没有对其损伤进行进一步的评估和治疗,即使在患者症状持续存在时情况也是如此。14 在可能的情况下,这类患者需要由具备TBI治疗专业知识的临床医生进行诊治。多学科诊疗是解决患者各类后遗症的理想方案。应当鼓励医疗保健系统为TBI患者急性期之后的治疗制定同步方案。
美国康复医学会(ACRM)、美国疾病预防控制中心(CDC)、美国退伍军人事务部和国防部以及运动医学学会制定的共识指南,可以用于管理GCS评分为13-15分的受TBI影响的平民、军人和运动员(见表8)。负责评估和管理这些特定人群(GCS评分为13-15分的TBI患者)的专业人员需要熟悉现有共识指南,并将其用于具体临床实践过程。
表8.诊断、评估和管理GCS评分为13-15分TBI患者的现行指南和可用资源《美国康复医学会轻型TBI诊断标准》Arch Phys Med Rehabil.DOI: 10.1016/J.APMR.2023.03.036.
《脑震荡和轻型TBI的治疗:实践指南综述》2020 Feb;101(2):382–393. https://www.archives-pmr.org/article/S0003-9993(19)31305-X/fulltext. Accessed May 31, 2024.
《儿童轻型TBI的临床治疗指南》美国疾病控制和预防中心 2024. https://www.cdc. gov/traumatic-brain-injury/hcp/clinical guidance/?CDC_AAref_Val=https://www.cdc.gov/traumatic braininjury/ PediatricmTBIGuideline.html. Accessed May 31, 2024.
《退伍军人事务部/美国国防部脑震荡-轻型TBI治疗管理临床实践指南》退伍军人事务部、美国国防部 https://www.healthquality.va.gov/guidelines/rehab/mtbi/ mtbicpgfullcpg50821816.pdf. Accessed May 31, 2024.
《体育运动相关脑震荡共识声明-柏林第5届国际体育运动相关脑震荡大会》2016年10月.British Journal of Sports Medicine. 2017;51(11):838–847. https://bjsm.bmj.com/content/51/11 /838.long.
《创伤性脑损伤:预防、临床护理和研究的进展与挑战》 Lancet Neurology. 2022 Nov;21(11):1004–1060. doi: 10.1016/S1474-4422(22)00309-X
《医疗保健提供者资源》 美国疾病控制和预防中心 https://www.cdc.gov/heads-up/ index.html. Accessed September 13, 2024.
轻型TBI,或GCS评分为13-15分的TBI,在老年人群中发生率较高,且通常由跌倒引起。研究报告显示,多数老年患者(60%-80%)发生TBI时GCS评分为13-15分15–17。不幸的是,少有证据可用于指导老年患者发生此类损伤的诊断或治疗决策18,19。对患有轻型TBI的老年患者进行评估时,患者受伤前的认知状况可能会对评估结果产生明显干扰。此外,对具有相似头部解剖学病损的年轻患者和老年患者进行GCS评分比对时往往会有不一致的情况出现20,21。应用GCS评分和体格检查排除老年患者可能的颅内严重病变常常不可靠;因此,通常建议进行更多的影像学检查和更严密的病情观察22-24。虽然多数经历此类损伤的老年患者恢复良好,但报道仍显示GCS评分为13-15分的TBI是老年患者死亡的一项重要独立危险因素17。此外,这类损伤可能会导致自我认知和社会生活的长期改变,且这种改变可能在损伤后持续数年25。这些改变可能会导致患者丧失独立生活能力以及生活质量逐渐下降。如果老年患者的症状较为严重或持续存在且无改善,通常可将患者转诊至高度专业化的康复机构进行治疗26,27。
GCS评分为13-15分的儿童TBI患者中,大约有30%的患者伤后症状会持续1月以上28。最近的一项大规模观察性研究确定了与症状长期持续存在相关的危险因素(例如,医生诊断的偏头痛病史)和检查结果(例如,回答问题缓慢)28。源于观察性和干预性试验的研究证据表明,早期恢复体育活动和尽早重返校园可改善患者临床结局29–32。推荐将所有儿童TBI患者在其初级保健医生处就诊,以便帮助其重返校园和恢复日常活动。对于存在康复时间延长风险的儿童患者,可能需要在神经科或运动医学等亚专科门诊进行持续随访。症状持续存在(即症状持续超过伤后3个月)的儿童可能从神经心理测试中获益,这些测试有助于评估TBI损伤和非损伤因素对病情的影响,从而应用这些信息来帮助患者重返校园和恢复日常活动能力。
1.Centers for Disease Control and Prevention. Surveillance report of traumatic brain injury-related emergency department visits, hospitalizations, and deaths—United States 2014. 2019. https://www.cdc.gov/ traumaticbraininjury/pdf/TBI-Surveillance-Report-FINAL_508.pdf. Accessed May 30, 2024.2.Korley FK, Kelen GD, Jones CM, Diaz-Arrastia R. Emergency de partment evaluation of traumatic brain injury in the United States, 2009–2010. J Head Trauma Rehabil. 2016 Nov/Dec;31(6):379–387. doi: 10.1097/HTR.0000000000000187. PMID: 26360006; PMCID: PMC4786477.3.US Department of Defense. Traumatic Brain Injury (TBI): DoD Standard Surveillance Case Definition for TBI Adapted for AFHSB Use. 2019. https:// www.health.mil/Reference-Center/Publications/2015/12/01/Traumat ic-Brain-Injury. Accessed May 30, 2024.4.Department of Veterans Affairs, Department of Defense. VA/DoD Clin ical Practice Guideline for the Management of Concussion-Mild Traumatic Brain Injury. 2016. https://www.healthquality.va.gov/guidelines/rehab/ mtbi/mtbicpgfullcpg50821816.pdf. Accessed May 30, 2024.5.McCrory P, Meeuwisse W, Dvořák J, et al. Consensus statement on concussion in sport—the 5th international conference on concussion in sport held in Berlin, October 2016. Br J Sports Med. 2017 Jun;51(11):838 847. doi: 10.1136/bjsports-2017-097699. Epub 2017 Apr 26. PMID: 28446457.6.Silverberg ND, Iaccarino MA, Panenka WJ, et al. Management of con cussion and mild traumatic brain injury: A synthesis of practice guide lines. Arch Phys Med Rehabil. 2020 Feb;101(2):382–393. doi: 10.1016/j. apmr.2019.10.179. Epub 2019 Oct 23. PMID: 31654620.7.Silverberg ND, Iverson GL, ACRM Mild TBI Definition Expert Consensus Group, ACRM Brain Injury Special Interest Group Mild TBI Task Force. Expert panel survey to update the American Congress of Rehabilita tion Medicine definition of mild traumatic brain injury. Arch Phys Med Rehabil. 2021 Jan;102(1):76–86. doi: 10.1016/j.apmr.2020.08.022. Epub 2020 Oct 7. PMID: 33035515.8.Furger RE, Nelson LD, Lerner EB, McCrea MA. Frequency of factors that complicate the identification of mild traumatic brain injury in Level I trauma center patients. Concussion. 2016 Mar;1(2):CNC11. doi: 10.2217/ cnc.15.11. Epub 2015 Nov 16. PMID: 27134757; PMCID: PMC4847751.9.Powell JM, Ferraro JV, Dikmen SS, Temkin NR, Bell KR. Accuracy of mild traumatic brain injury diagnosis. Arch Phys Med Rehabil. 2008 Aug;89(8):1550–1555. doi: 10.1016/j.apmr.2007.12.035. Epub 2008 Jul 2. PMID: 18597735.10.Pozzato I, Meares S, Kifley A, et al. Challenges in the acute identifi cation of mild traumatic brain injuries: Results from an emergency department surveillance study. BMJ Open. 2020 Feb 3;10(2):e034494. doi: 10.1136/bmjopen-2019-034494. PMID: 32019818; PMCID: PMC7045153.11.Koval RR, Zalesky CC, Moran TP, et al. Concussion care in the emergency department: A prospective observational brief re port. Ann Emerg Med. 2020 Apr;75(4):483–490. doi: 10.1016/j. annemergmed.2019.08.419. Epub 2019 Nov 1. PMID: 31685254.12.Nelson LD, Temkin NR, Dikmen S, et al. Recovery after mild traumatic brain injury in patients presenting to US Level I trauma centers: A Transforming Research and Clinical Knowledge in Traumatic Brain Injury (TRACK-TBI) study. JAMA Neurol. 2019 Sep 1;76(9):1049–1059. doi: 10.1001/jamaneurol.2019.1313. Erratum in: JAMA Neurol. 2019 Dec 1;76(12):1520. doi: 10.1001/jamaneurol.2019.3698.13.Mikolić A, Polinder S, Steyerberg EW, et al. Prediction of global func tional outcome and post-concussive symptoms after mild traumatic brain injury: External validation of prognostic models in the Collabora tive European NeuroTrauma Effectiveness Research in Traumatic Brain Injury (CENTER-TBI) Study. J Neurotrauma. 2021 Jan 15;38(2):196–209. doi: 10.1089/neu.2020.7074. Epub 2020 Oct 19. PMID: 32977737.14.Seabury SA, Gaudette É, Goldman DP, et al. Assessment of follow-up care after emergency department presentation for mild traumatic brain injury and concussion: Results from the TRACK-TBI study. JAMA Netw Open. 2018 May 18;1(1):e180210. doi: 10.1001/jamanetworko pen.2018.0210. PMID: 30646055; PMCID: PMC6324305.15.de Guise E, LeBlanc J, Dagher J, et al. Traumatic brain injury in the el derly: A Level 1 trauma centre study. Brain Inj. 2015;29(5):558–564. doi: 10.3109/02699052.2014.976593.16.Cetty L, Abdin E, Vaingankar JA, et al. Prevalence and correlates of traumatic brain injury (TBI) in older adults: Results from the Well-be ing of the Singapore Elderly (WiSE) study. Int Psychogeriatr. 2017 Nov;29(11):1899–1907. doi: 10.1017/S104161021700134X. 17.17.Cheng PL, Lin HY, Lee YK, Hsu CY, Lee CC, Su YC. Higher mortality rates among the elderly with mild traumatic brain injury: A nationwide cohort study. Scand J Trauma Resusc Emerg Med. 2014 Jan;22:7. doi: 10.1186/1757-7241-22-7.18.Kozar RA, Arbabi S, Stein DM, et al. Injury in the aged: Geriatric trauma care at the crossroads. J Trauma Acute Care Surg. 2015 Jun;78(6):1197 1209. doi: 10.1097/TA.0000000000000656.19.Gaastra B, Longworth A, Matta B, et al. The ageing population is neglected in research studies of traumatic brain injury. Br J Neuro surg. 2016;30(2):221–226. doi: 10.3109/02688697.2015.1119240.20.Rau CS, Wu SC, Chen YC, et al. Effect of age on Glasgow Coma Scale in patients with moderate and severe traumatic brain injury: An approach with propensity score-matched population. Int J Environ Res Public Health. 2017 Nov;14(11):1378. doi: 10.3390/ijerph14111378.21.Salottolo K, Levy AS, Slone DS, Mains CW, Bar-Or D. The effect of age on Glasgow Coma Scale score in patients with traumatic brain inju ry. JAMA Surg. 2014 Jul;149(7):727–734. doi: 10.1001/jamasurg.2014.13.22.Jagoda AS, Bazarian JJ, Bruns JJ Sr, et al. Clinical policy: Neuroimaging and decisionmaking [sic] in adult mild traumatic brain injury in the acute setting. J Emerg Nurs. 2009 Apr;35(2):e5–e40. doi: 10.1016/j. jen.2008.12.010.23.Smits M, Dippel DW, de Haan GG, et al. External validation of the Canadian CT Head Rule and the New Orleans Criteria for CT scanning in patients with minor head injury. JAMA. 2005 Sep 28;294(12):1519 1525. doi: 10.1001/jama.294.12.1519.24.Vos PE, Alekseenko Y, Battistin L, et al. Mild traumatic brain injury. Eur J Neurol. 2012 Feb;19(2):191–198. doi: 10.1111/j.1468-1331.2011.03581.x.25.Laic RA, Vander Sloten JV, Depreitere B. In-depth assessment of quality of life and real life impact of mild traumatic brain injury in elderly by means of a focus group study. Brain Spine. 2023 Feb 25;3:101722. doi: 10.1016/j.bas.2023.101722.26.McCulloch KL, Osborne MB, Ramsey CR. Geriatric mild traumatic brain injury (mTBI). Curr Geri Rep. 2020 Sep;9(3):142–153 (2020). doi: 10.1007/s13670-020-00329-3.27.Pedersen AR, Severinsen K, Nielsen JF. The effect of age on rehabil itation outcome after traumatic brain injury assessed by the Func tional Independence Measure (FIM). Neurorehabil Neural Repair. 2015 May;29(4):299–307. doi: 10.1177/1545968314545171.28.Zemek R, Barrowman N, Freedman SB, et al. Clinical risk score for persistent postconcussion symptoms among children with acute con cussion in the ED. JAMA. 2016 Mar 8;315(10):1014–1025. doi: 10.1001/ jama.2016.1203. Erratum in: JAMA. 2016 Jun 21;315(23):2624. doi: 10.1001/jama.2016.6772. PMID: 26954410.29.Vaughan CG, Ledoux AA, Sady MD, et al. Association between early return to school following acute concussion and symptom burden at 2 weeks postinjury. JAMA Netw Open. 2023 Jan 3;6(1):e2251839. doi: 10.1001/jamanetworkopen.2022.51839. PMID: 36662524; PMCID: PMC9860528.30.Grool AM, Aglipay M, Momoli F, et al. Association between early par ticipation in physical activity following acute concussion and persistent postconcussive symptoms in children and adolescents. JAMA. 2016 Dec 20;316(23):2504–2514. doi: 10.1001/jama.2016.17396. PMID: 27997652.31.Leddy JJ, Haider MN, Ellis MJ, et al. Early subthreshold aerobic exercise for sport-related concussion: A randomized clinical trial. JAMA Pediatr. 2019 Apr 1;173(4):319–325. doi: 10.1001/jamapediatrics.2018.4397. PMID: 30715132; PMCID: PMC6450274.32.Leddy JJ, Master CL, Mannix R, et al. Early targeted heart rate aerobic exercise versus placebo stretching for sport-related concussion in adolescents: A randomised controlled trial. Lancet Child Adolesc Health. 2021 Nov;5(11):792–799. doi: 10.1016/S2352-4642(21)00267-4. Epub 2021 Oct 1. PMID: 34600629.译者:同济大学附属上海市第十人民医院神经外科 高亮、李磊
● 使用包括身体、认知、沟通、行为、心理和健康幸福感在内的整体和多维度指标对创伤性脑损伤(TBI)患者预后进行评估。
● 为确保制定优质的治疗基准,需要识别可指示临床症状恶化或趋于稳定的患者特定因素,这些因素与需要干预或治疗的病理情况有关;同时也需要识别可能可以通过康复或其他治疗而能够获得的临床症状改善。
● 在损伤后的多个时间点(理想情况下在1-3个月之间评估一次,随后再次在6-12个月之间评估一次)进行TBI患者预后评估,以确定损伤后的临床演变轨迹,并根据需要进行干预从而优化康复。
TBI会影响多个功能领域(如生理、认知、沟通交流、行为、心理和健康幸福感),是导致长期残疾的主要原因。损伤的表现和模式具有患者特异性。TBI后的预后轨迹也不尽相同,可能在伤后多年内出现改善或恶化。越来越多的证据表明,TBI后的显著功能恢复持续时间远远超过6个月,可能延续至伤后10年或更长的时间1。
因TBI住院的患者需要由具有TBI专业知识的医疗服务提供者进行临床随访。鉴于TBI后病程的动态性质,甚至在受伤数年后仍有可能发生变化,因此TBI后的特定护理需求可能跨越数月至数年。终生随访通过解决慢性脑损伤患者的筛查、监测和管理需求从而促进其大脑健康,进而优化患者结局,这种模式可能对许多患者有益2。
对TBI患者的综合管理需要采用多维度和纵向的方法进行预后评估。这有助于准确记录各个领域的功能变化范围,确定随时间推移的恢复趋势,并确定能最大限度地实现良好疗效所需的干预措施。
建议管理TBI患者的医护人员了解不同的预后评估措施及其相关的优势、局限性和适用性。医疗护理团队必须擅长解释预后评估的结果,并在需要时进行干预。例如,考虑到TBI、医疗和精神科并发症(例如,创伤后脑积水、隐匿性癫痫发作、内分泌功能障碍、医源性镇静、重度抑郁症、创伤后应激障碍和神经退行性疾病)之间的关系,应特别强调对临床症状恶化情况的监测3-6。
评估方法各有优缺点,很少有方法可适用于TBI严重程度的全部范围。一个全面的脑损伤结局评估需要涉及身体生理、认知、沟通交流、行为、心理和生活质量等领域。GOS-E被广泛用于全面评估TBI后的功能和结局。管理和解释GOS-E的医护人员需要熟悉其局限性(例如,地板效应和天花板效应以及离散类别所代表的广泛功能范围)7。此外,不同的评分方法(即TBI特异性与TBI合并外周损伤)可能产生不同的评分7。总体功能结局指标不具有表征TBI后遗症异质性所需的精确度。在可能的情况下,应采用多维度评估策略对整体评估进行补充,从而处理其他的功能领域,为TBI患者提供更敏感和更全面的治疗方法8。
有意义的结局评估需要在不同阶段进行评估以辨别个体的状况和康复路径。至少,所有严重程度的TBI患者需要进行一系列标准化结局评估,包括GOS-E评估,理想情况下在损伤后1-3个月之间评估一次,再次在伤后6-12个月之间评估一次。GOS-E不适合在住院期间使用。该建议的依据在于已有证据支持对TBI患者进行纵向监测,从而确定预后改善、长期停滞或恶化的临床轨迹,这些轨迹可能表明需要进行干预从而改善患者预后9。建议采用推荐的时间线,以平衡连续评估获得预后重要轨迹数据的需求与临床和操作的可行性。然而,可以选择在个体患者中进行更频繁的监测。
预后评估在个体患者水平和更广泛的系统水平上都很重要。跟踪个体患者的临床恢复轨迹有助于识别康复进展与预期不符的情况,从而表明需要进一步的评估和治疗。在多个时间点获得的数据有助于临床团队确定患者的病情是否已经趋于稳定或出现恶化。这些数据还能为进一步制定评估(如影像学、实验室检查评估、全面的神经心理学评估和驾驶员再评估)和治疗(如住院康复、门诊认知康复计划、脑震荡门诊和心理咨询)决策提供依据。出院后评估结果提示病情趋于稳定或出现恶化时,可能表明存在适合进行干预的医疗或精神状况,也可能表明存在不利于恢复的环境条件。从更广泛的系统层面来看,在创伤治疗项目内部或不同治疗项目之间,对出院后数周至数月内观察到的结果与预期的患者结局进行评估,有助于确定疾病管理过程中的可改进之处。
与年轻患者相比,老年TBI患者在受伤后出现并发症和不良结局的风险更高10-13。这些结局包括更长的住院时间10、更高的死亡率10,14,15,更严重的功能和认知能力下降12,14,15,更差的生活质量12、更多的再入院率11,更多的并发症11和更高的护理机构需求。即使损伤严重程度评分相对较低,老年患者在损伤后住院率、死亡率、功能下降率和医疗费用方面最高13。此外,老年患者发生继发性并发症的风险更高,包括静脉血栓栓塞(VTE)、出血13,17和神经退行性病变(全因痴呆、帕金森病)18。在损伤后的恢复和残疾演变轨迹方面,患者出院时的功能独立量表(FIM)运动评分是预测TBI后GOS-E评估的全身残疾程度的有力预测因素12,19。这些统计数据突显了在急症治疗期间和之后优先进行质量改进(QI)的重要性。
虚弱反映了生物学上的衰老20,它是高龄患者预后不良的主要预测因素11。这就强调了在入院时进行虚弱筛查的重要性,其应作为所有创伤中心一项重要的QI举措16,21,22。由于老年患者预后不良的范围很广泛,因此有必要对TBI后的结局进行QI监测,并根据患者的虚弱状态进行风险调整。虚弱筛查会导致高龄人群咨询服务增加23以及更高的姑息治疗转诊21。筛查还为患者/家庭提供了教育机会,让他们了解如何减轻和延缓功能衰退24。改善TBI后神经认知预后的生活方式改变包括运动、充足的睡眠和营养25。将康复策略的重点放在增强功能、平衡、协调和节能上12。
儿童TBI患者在伤后也需要接受持续的标准评估。儿科结局评估工具包括但不限于功能状态量表(FSS)和儿科生活质量量表(PQLI)。管理儿科TBI患者的专业医护人员需要接受培训,以实施、解释和执行针对儿科患者群体特定的结局评估。在住院儿童的所有创伤性损伤中,3%是由于非意外创伤造成的,其中一半以上包括TBI(无论是单独的创伤还是多发性损伤)26。准确的诊断和严密全面的结局评估对于患者的最佳治疗至关重要,因为患者的社会支持(包括其家庭环境和护理人员)可能会发生变化。
1.Tate RL, Fenelon B, Manning ML, Hunter M. Patterns of neuropsy- chological impairment after severe blunt head injury. J Nerv Ment Dis. 1991 Mar;179(3):117–126. doi: 10.1097/00005053-199103000-00001. PMID: 1997657.2.Corrigan JD, Hammond FM. Traumatic brain injury as a chronic health condition. Arch Phys Med Rehabil. 2013 Jun;94(6):1199–1201. doi: 10.1016/j.apmr.2013.01.023.3.Stein MB, Jain S, Giacino JT, et al. Risk of posttraumatic stress disorder and major depression in civilian patients after mild traumatic brain in- jury: A TRACK-TBI study. JAMA Psychiatry. 2019 Mar 1;76(3):249–258. doi: 10.1001/jamapsychiatry.2018.4288.4.Wilson L, Stewart W, Dams-O’Connor K, et al. The chronic and evolving neurological consequences of traumatic brain injury. Lancet Neurol. 2017 Oct;16(10):813–825. doi: 10.1016/S1474-4422(17)30279-X.5.Whyte J, Nordenbo AM, Kalmar K, et al. Medical complications during inpatient rehabilitation among patients with traumatic disorders of consciousness. Arch Phys Med Rehabil. 2013 Oct;94(10):1877–1883. doi: 10.1016/j.apmr.2012.12.027. Epub 2013 Jun 2.6.Hammond FM, Corrigan JD, Ketchum JM, et al. Prevalence of med- ical and psychiatric comorbidities following traumatic brain injury. J Head Trauma Rehabil. 2019 Jul/Aug;34(4):E1–E10. doi: 10.1097/ HTR.0000000000000465.7.Wilson L, Boase K, Nelson LD, et al. A manual for the Glasgow Outcome Scale-Extended interview. J Neurotrauma. 2021 Sep 1;38(17):2435–2446. doi: 10.1089/neu.2020.7527.8.Bodien YG, McCrea M, Dikmen S, et al. Optimizing outcome assess- ment in multicenter TBI trials: Perspectives from TRACK-TBI and the TBI Endpoints Development initiative. J Head Trauma Rehabil. 2018 May/Jun;33(3):147–157. doi: 10.1097/HTR.0000000000000367.9.Hammond FM, Malec JF, Corrigan JD, et al. Patterns of function- al change five to ten years after moderate-severe traumatic brain injury. J Neurotrauma. 2021 Jun 1;38(11):1526–1534. doi: 10.1089/ neu.2020.7499. PMID: 33779295; PMCID: PMC8126422.10.Ziegenhain F, Scherer J, Kalbas Y, et al. Age-dependent patient and trauma characteristics and hospital resource requirements—can improvement be made? An analysis from the German trauma registry. Medicina (Kaunas). 2021 Apr 1;57(4):330. doi: 10.3390/medici- na57040330.11.Zhao F, Tang B, Hu C, Wang B, Wang Y, Zhang L. The impact of frailty on posttraumatic outcomes in older trauma patients: A system-atic review and meta-analysis. J Trauma Acute Care Surg. 2020 Apr;88(4):546–554. doi: 10.1097/TA.0000000000002583.12.Thompson HJ, Rivara FP, Wang J. Effect of age on longitudinal changes in symptoms, function, and outcome in the first year after mild-moder- ate traumatic brain injury. J Neurosci Nurs. 2020 Apr;52(2):46–52. doi: 10.1097/JNN.0000000000000498.13.Abdelmalik PA, Draghic N, Ling GS. Management of moderate and severe traumatic brain injury. Transfusion. 2019 Apr;59(S2):1529–1538. doi: 10.1111/trf.15171.14.Maiden MJ, Cameron PA, Rosenfeld JV, Cooper DJ, McLellan S, Gabbe BJ. Long-term outcomes after severe traumatic brain injury in older adults: A registry-based cohort study. Am J Respir Crit Care Med. 2020 Jan 15;201(2). doi.org/10.1164/rccm.201903-0673OC.15.Maxwell CA, Mion LC, Mukherjee K, et al. Preinjury physical frailty and cognitive impairment among geriatric trauma patients determine post- injury functional recovery and survival. J Trauma Acute Care Surg. 2016 Feb;80(2):195–203. doi: 10.1097/TA.0000000000000929.16.Bellal J, Pandit V, Zangbar B, et al. Superiority of frailty over age in predicting outcomes among geriatric trauma patients: A prospective analysis. JAMA Surg. 2014 Aug;149(8):766–772. doi: 10.1001/jama- surg.2014.296.17.Kumar RG, Olsen J, Juengst SB, et al. Comorbid conditions among adults 50 years and older with traumatic brain injury: Examining asso- ciations with demographics, healthcare utilization, institutionalization, and 1-year outcomes. J Head Trauma Rehabil. 2019 Jul/Aug;34(4):224– 232. doi: 10.1097/HTR.0000000000000470.18.Brett BL, Gardner RC, Godbout J, Dams-O’Connor K, Keene CD. Trau- matic brain injury and risk of neurodegenerative disorder. Biol Psychiatry. 2022 Mar 1;91(5):498–507. doi: 10.1016/j.biopsych.2021.05.025.19.Hammond FM, Baker-Sparr CA, Dahdah MN, et al. Predictors of 1-year global outcomes after traumatic brain injury among older adults: A NIDILRR Traumatic Brain Injury Model Systems study. J Aging Health. 2019 Dec;31(10_suppl):68S–96S. doi: 10.1177/0898264318819197.20.Ji L, Jazwinski SM, Kim S. Frailty and biological age. Ann Geriatr Med Res. 2021 Sep;25(3):141. doi: 10.4235/agmr.21.0080.21.Karlekar MB, Maxwell CA, Dietrich MS, Miller RS. Creating new opportunities to educate families on the impact of frailty and cognitive impairment in a trauma intensive care unit: Results of a quality im- provement project. J Palliat Med. 2017 Feb;20(2):193–196. doi: 10.1089/ jpm.2016.0244.22.Cubitt M, Downie E, Shakerian R, Lange PW, Cole E. Timing and methods of frailty assessments in geriatric trauma patients: A systematic review. Injury. 2019 Nov;50(11):1795–1808. doi: 10.1016/j. injury.2019.07.026.23.Olufajo OA, Tulebaev S, Javedan H, et al. Integrating geriatric consults into routine care of older trauma patients: One-year experience of a Level I trauma center. J Am Coll Surg. 2016 Jun;222(6):1029–1035. doi: 10.1016/j.jamcollsurg.2015.12.058.24.Maxwell CA, Mixon AS, Conner E, Phillippi JC. Receptivity of hospi- talized older adults and family caregivers to prognostic information about aging, injury, and frailty: A qualitative study. Int J Nurs Stud. 2020 Sep;109:103602. doi: 10.1016/j.ijnurstu.2020.103602.25.Markovic SJ, Fitzgerald M, Peiffer JJ, et al. The impact of exercise, sleep, and diet on neurocognitive recovery from mild traumatic brain injury in older adults: A narrative review. Ageing Res Rev. 2021 Jul;68:101322. doi: 10.1016/j.arr.2021.101322.26.Rosenfeld EH, Johnson B, Wesson DE, Shah SS, Vogel AM, Naik-Mathu- ria B. Understanding non-accidental trauma in the United States: A na- tional trauma databank study. J Pediatr Surg. 2020 Apr;55(4):693–697. doi: 10.1016/j.jpedsurg.2019.03.024.译者:浙江大学医学院附属第一医院神经外科 杨小锋、王亚东、苏佳楠
● 把TBI既当作急性病,也当作慢性病来治疗。
● TBI患者和患方家属应接受脑损伤、康复、(医疗)资源以及随访的针对性宣教,来改善治疗安全性、疾病应对能力、随访和预后。
● 医疗保健专业人员可以从创伤性脑损伤宣教中获益,以改善患者的护理和预后。
● 从急诊治疗医院出院后,确保所有创伤性脑损伤患者都有机会由有治疗创伤性脑损伤经验的临床医生进行随访。这需要进行进一步的循证指导,以及根据病情需要进行更长期的筛查、监测和治疗。
在所有人群和经济阶层中,创伤性脑损伤(TBI)始终是全球范围内致残的主要原因之一1。对于许多患者而言,TBI是一种持续且动态发展的病症,而非一次性事件2。这种病症所带来的沉重负担可能会对患者、家庭以及所在社区产生深远的影响。那些出现昏迷和严重TBI的患者通常被认为需要接受康复治疗和长期的护理。然而,这些患者中有许多并未获得来自有TBI 治疗经验的临床医生的康复治疗或护理,并且很多患者由于医保资格和社会福利标准而从未接受任何后续护理。基于21世纪初美国的数据,据估计仅有13%-25% 因中重度或穿透性TBI而急诊住院的患者接受了住院康复治疗3。
在伤势较轻的患者当中,接受康复治疗或者与熟悉脑外伤(TBI)治疗的专业人员建立联系的人数甚至更少。越来越多的证据表明,在过去十年间,前往创伤中心接受轻度脑外伤(格拉斯哥昏迷评分13-15分)评估和治疗的患者,即便他们往往不需要强化的进一步的医疗处理或者住院治疗,仍会在急性和亚急性期过后的恢复期出现持续临床症状和功能障碍4。此外,接近50%的这类伤势较轻的患者群体在出院时未获得有关TBI的任何宣教,并且他们也未接受任何形式的急性期后的随访或医疗指导5。
尽管当前TBI相关的教育平台和资源得到了完善与拓展,目前已经存在众多平台(例如,疾控中心、模拟系统和BrainLine等)6-8。TBI宣教能够改善患者的预后,因此鼓励临床医生和患者利用这些现有的资源是至关重要的9。对于创伤中心而言,构建协调一致的患者宣教和随访系统是一项高优先级的重要任务。
医疗保健专业人员需要接受脑外伤(TBI)教育,以知晓来自大规模研究的最新数据,这些数据表明患者的长期预后可能与患者的临床表现并不相符。这突出了脑外伤后对患者进行随访和宣教的必要性。具体而言,许多重度TBI患者可能会有良好的预后,而许多所谓的轻伤患者可能会遭遇持续存在的问题而对其生活功能产生负面影响。医疗保健专业人员还需要接受关于运动相关性TBI患者与社区获得性TBI患者转移到创伤中心的相关指导。
在美国乃至全球范围内,TBI后的随访系统存在明显的短板。因此,绝大多数TBI患者未能获得充分的随访5。诸多TBI症状(例如,头痛、睡眠紊乱、各种形式的认知功能障碍、前庭功能障碍、痉挛、无力、感觉变化、耐力下降等)需要进行治疗,以预防残疾并改善TBI的预后。由具备TBI治疗经验的临床医生进行 TBI 随访和治疗指导能够明显改善预后10。应鼓励创伤中心和社区医疗保健系统推动建立针对TBI患者急性期后的协调管理系统,且该系统应由具备TBI治疗经验的专家组成。点对点的TBI支持,如TBI患者支持小组,对于个人和家庭来说,在治疗疾病、处理治疗和康复过程所面临的问题等方面都很重要。
1.Johnson WD, Griswold DP. Traumatic brain injury: A global challenge. Lancet Neurol. 2017 Dec;16(12):949–950. doi: 10.1016/S14744422(17)30362-9. PMID: 29122521.2.Corrigan JD, Hammond FM. Traumatic brain injury as a chronic health condition. Arch Phys Med Rehabil. 2013 Jun;94(6):1199–1201. doi: 10.1016/j.apmr.2013.01.023.3.Corrigan JD, Cuthbert JP, Whiteneck GG, et al. Representativeness of the Traumatic Brain Injury Model Systems National Database. J Head Trauma Rehabil. 2012 Nov–Dec;27(6):391–403. doi: 10.1097/HTR. 0b013e3182238cdd. PMID: 21897288; PMCID: PMC3410043.4.Nelson LD, Temkin NR, Dikmen S, et al. Recovery after mild traumatic brain injury in patients presenting to US Level I trauma centers: A Transforming Research and Clinical Knowledge in Traumatic Brain Injury (TRACK-TBI) study. JAMA Neurol. 2019 Sep 1;76(9):1049–1059. doi: 10.1001/jamaneurol.2019.1313. Erratum in: JAMA Neurol. 2019 Dec 1;76(12):1520. doi: 10.1001/jamaneurol.2019.3698. PMID: 31157856; PMCID: PMC6547159.5.Seabury SA, Gaudette É, Goldman DP, et al. Assessment of follow-up care after emergency department presentation for mild traumatic brain injury and concussion: Results from the TRACK-TBI study. JAMA Netw Open. 2018 May 18;1(1):e180210. doi: 10.1001/jamanetworkopen.2018.0210. PMID: 30646055; PMCID: PMC6324305. 6.Centers for Disease Control and Prevention. Traumatic Brain Injury & Concussion. 2023. www.cdc.gov/traumaticbraininjury. Accessed May 31, 2024. 7.Model Systems Knowledge Translation Center. Traumatic Brain Injury. 2023. https://msktc.org. Accessed May 31, 2024.8.BrainLine. TBI Basics: What you need to know about brain injury. 2023. https://www.brainline.org/. Accessed May 31, 2024. 9.Ponsford J, Willmott C, Rothwell A, et al. Impact of early intervention on outcome following mild head injury in adults. J Neurol Neurosurg Psychiatry. 2002 Sep;73(3):330–332. doi: 10.1136/jnnp.73.3.330. PMID: 12185174; PMCID: PMC1738009. 10.Wade DT, King NS, Wenden FJ, Crawford S, Caldwell FE. Routine follow up after head injury: A second randomised controlled trial. J Neurol Neurosurg Psychiatry. 1998 Aug;65(2):177–183. doi: 10.1136/jnnp.65.2.177. PMID: 9703167; PMCID: PMC2170203.
译者:空军军医大学第二附属医院急诊科 李立宏、杨阳
● 这些最佳实践推荐以证据和专家意见为基础,旨在为创伤中心中的创伤性脑损伤(TBI)患者的监护提供指导。
● 在实施美国外科医师学会(ACS)创伤质量改善计划(TQP)制定的“创伤性脑损伤管理最佳实践指南”,以及为TBI患者提供监护支持和监控指南遵从性方面,创伤医疗主任(TMD)、创伤项目主管(TPM)、创伤联络员、登记员和工作人员发挥着领导作用。
● 由参与TBI救治的相关人员组成的工作小组接受TMD和创伤执行委员会的指导并负责实施最佳的临床实践建议。
● 工作小组基于最佳实践建议,负责完成与本创伤中心目前TBI监护相关的差异分析。
TMD、TPM、创伤联络员和登记员是在创伤中心中实施最佳实践建议的领导者和改进医疗实践的推动者。无论创伤中心评定的级别如何,这些人员都承担着监督、管理以及持续改善创伤中心和创伤系统内监护治疗的责任。他们明确了最佳实践指南(BPG)的领导结构、文化和实施流程,以促进TBI救治人员的参与。该过程包括以下几个方面:
● 颅脑损伤指南跨学科工作小组有明确的领导和报告架构,负责审查TBI BPG,并确定是否需要完成差异分析,从而将当前创伤中心的实践与ACS TQP创伤性脑损伤管理最佳实践指南”中的建议进行比较。
● 制定培训计划,以推动TBI管理指南在创伤中心的实施并维持该实践。
● 将文件记录纳入电子病历,以促进报告的一致性并对预后进行跟踪随访。
颅脑损伤指南跨学科工作小组负责将目前的临床实践与BPG中推荐的实践进行比较,找出两者之间的差异。这一差异分析为创伤中心的TBI管理实践与ACS TQP“创伤性脑损伤管理最佳实践指南”保持一致提供了机会。如果该创伤中心是颅脑损伤的转诊中心,则可以对指南的建议进行回顾并完成部分差异分析,以明确潜在的改进之处。工作小组与创伤中心的执行委员会一起确定临床实践中需要进行改进的优先顺序,并将完成的改进进度报告提交给创伤执行委员会。有关差异评估建议的示例请参阅表8。
差异分析完成后,下一步就是修订或制定用于创伤中心各阶段监护的TBI管理指南,并由创伤执行委员会和TMD审查和批准。执行委员会负责向参与创伤救治的人员宣讲修订后的TBI管理指南。
下一步的优先事项是为指南制定一个跨学科的培训计划,以明确各单元和各监护治疗阶段的TBI管理需求。该培训计划概括了参与TBI评估和管理的各种医疗专业人员的目标,以及与评估、记录、干预和再评估相关的具体任务。整合TBI最佳实践建议的培训计划要素请参阅表9。
译者:福建医科大学附属第一医院神经外科 方文华、罗新群
● 跨学科工作组明确了《ACS TQP颅脑创伤救治最佳实践指南》中创伤质量改进与患者安全行动(PIPS)过程监测的各项要素。
● 经创伤PIPS委员会核准后的要素会被整合到现有的创伤PIPS计划中,用于合规性监测。
● 《ACS TQP颅脑创伤救治最佳实践指南》的质量改进(PI)要素已整合到PIPS计划的现有框架和流程中。
可建立一个用于发展区域协作的区域系统,以核查和调配整个地区的颅脑创伤(TBI)救治。这一协作方案是多学科的,且需同时包括康复治疗和社会心理服务。TBI协作确定了提供TBI及其预后相关区域数据的优先事项和关注重点。
制定区域TBI指南和相关区域共识的潜在优先事项包括以下几项:
● 院前处置、现场分诊和目的地选择——需要创伤中心共享与TBI损伤预后相关的数据。
● 尽早接受康复治疗——需要该地区明确不同级别和类型康复服务的开展情况。
● 所有TBI患者的急性期后随访——需该地区确定具有管理颅脑创伤经验的临床医生。
● 社会心理支持和点对点帮助——需该地区为TBI患者确定社区资源。
跨学科工作组定义并推荐了《ACS TQP颅脑创伤救治最佳实践指南》中关键要素,以便将其整合到PIPS的监测流程中。这些建议适用于医疗机构对TBI患者的入院收治,包括所有因创伤或神经外科诊疗需求而直接入院者。有关TBI管理的质量改进(PI)建议和结果指标,请参阅表10。
1.American College of Surgeons. Resources for Optimal Care of the Injured Patient. Chicago, IL. 2022.https://www.facs.org/quality-programs/trauma/quality/verification-review-and-consultation-program/standards/. Accessed May 31, 2024.
2.Newgard CD, Fischer PE, Gestring M, et al. National guideline for the field triage of injured patients: Recommendations of the National Expert Panel on Field Triage, 2021. J Trauma Acute Care Surg. 2022 Aug 1;93(2):e49–e60. doi: 10.1097/TA.0000000000003627.
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。
投稿邮箱:NAOYIHUI@163.com
未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。

























