最近,WHO发布了新版本的神经肿瘤分类体系,应用整合诊断的方法,汇总近年来神经肿瘤诊断和分类的新进展,将主旨思想发布在最新的Neuro-Oncology杂志上。为了更好地了解WHO神经肿瘤分类体系历史沿革的最新进展,我们结合历年来神经肿瘤分类体系的变化和近年来的最新进展综述本文,希望能为您更好地临床应用和实践提供帮助。如有理解不规范或表述不当之处,还请多谅解。
王樑
唐都医院
01

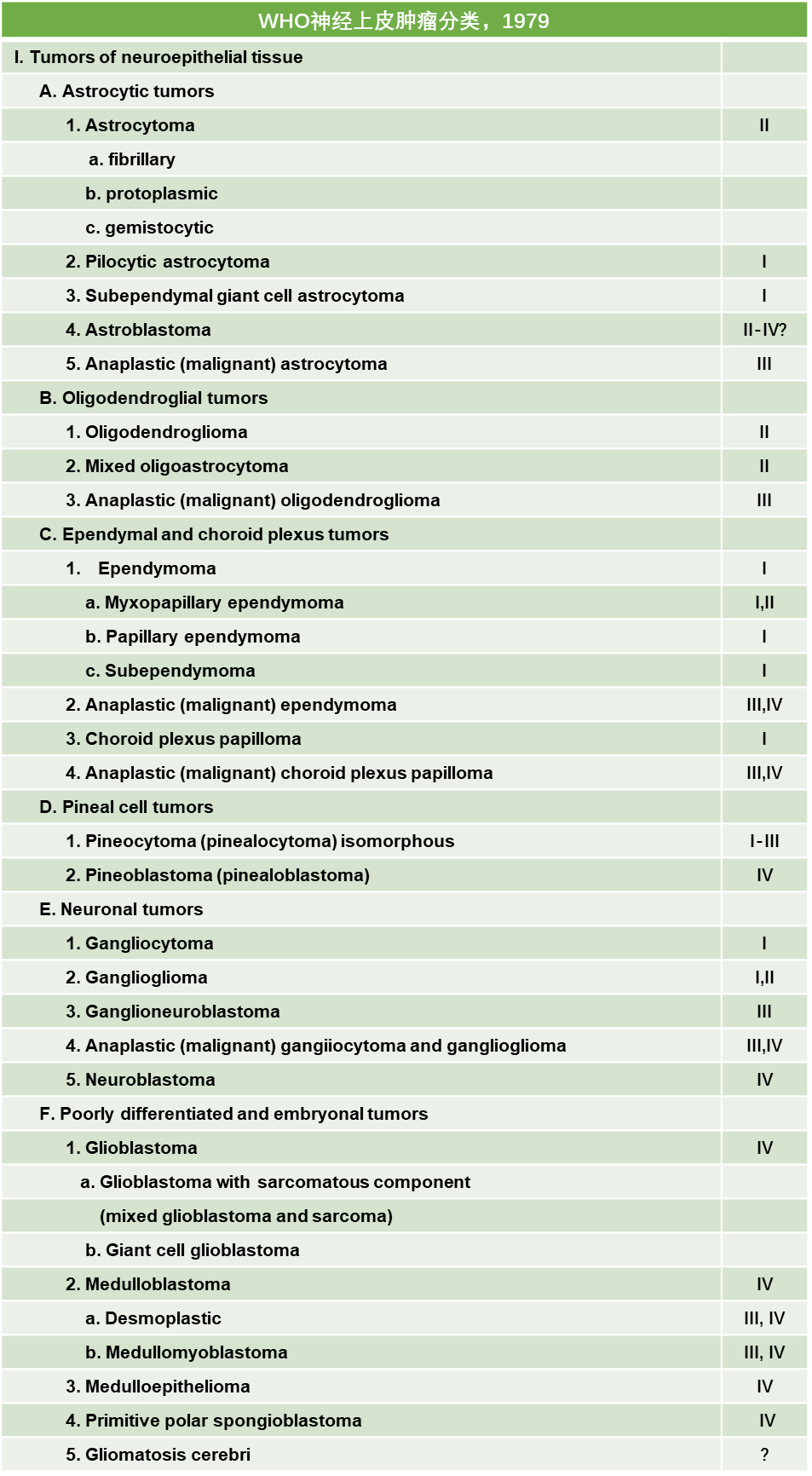
WHO CNS 1神经病理学诊断主要依赖组织学特征。肿瘤位置的重要性及其对脑脊液通路和生命中枢的影响与肿瘤的病理级别一并决定了临床恶性肿瘤的最终预后。
02
2.1 WHO CNS 2(1993年)
2.2 WHO CNS 3(2000年)
2.3 WHO CNS 4(2007年)
经2006年WHO在海德堡会议商定后,WHO CNS 4于2007年发布。第四版本的WHO分类系统,结合新更新的ICD-10版本部分更新了ICD-O系统,进一步明确不同分类肿瘤的ICD编码体系。新一版分类仍旧将肿瘤分为七大类,增加了血管中心性胶质瘤、非典型脉络丛乳头状瘤、脑室外神经细胞瘤、乳头状胶质神经元肿瘤、第四脑室伴菊形团形成型胶质性神经元肿瘤、松果体区乳头状肿瘤、垂体细胞瘤、腺垂体梭形细胞嗜酸细胞瘤等不同类型新鉴定的肿瘤。还增加了毛细胞黏液样星形细胞瘤、间变型髓母细胞瘤、伴广泛结节的髓母细胞瘤等不同的变异型。
WHO CNS 4再次明确了肿瘤的分级体系,肿瘤的组织学级别在于辅助临床预后和预测治疗效果的多种指标中的一种,还需要结合临床表现、影像学表现、手术切除范围和程度、增殖指数及基因改变等多方面进行评估。当然,肿瘤级别是非常重要的一环,对治疗方案的选择,特别是手术之后放疗、化疗的实施和具体方案都具有重要的指导价值。I级病变定义为增生倾向低,仅行手术全切即可能治愈;II级病变肿瘤增生倾向较小,但是通常会复发,部分II级肿瘤倾向于向高级别转化,III级肿瘤一般都有恶性的组织学证据,包括肿瘤细胞核不典型和活跃的核分裂,大多数情况下III级肿瘤都应辅以放疗和(或)化疗;IV级肿瘤为细胞学上恶性的、核分裂活跃的和有坏死倾向的肿瘤,术前、术后进展迅速,最终结局较差。弥漫浸润性星形细胞肿瘤主要分为3个级别,仅具有非典型表现的为II级(弥漫性星形细胞瘤),具有间变型和有丝分裂活跃的为III级(间变型星形细胞瘤),兼具有微血管增生和/或坏死的为IV级(胶质母细胞瘤),形态学改变中包括肾小球样微血管增生或任何形式的坏死,伴或不伴有栅栏样坏死改变。
2.4 WHO CNS 4+(2016年)
03
3.1 WHO CNS 5分类系统
WHO CNS 5汇集了近年来中枢神经系统肿瘤的分类诊断的新进展,尤其是强调了分子病理对诊断和分类的决定性作用。新分类的分级系统将原有的罗马数字改变为阿拉伯数字分级,充分结合临床因素进行分级,将原有的一个命名限定于一个分级的状态改为一个命名可以涵盖多个分级,取消了多数“anaplastic”分级的肿瘤命名,消除了原有同类名称但是级别相似但是恶性程度和临床预后不一致的弊端,减少了级别对治疗和预后判断的影响。新分类在分级体系中充分考虑了组织学分级和分子病理结果的整合,并且更倾向于用分子结果决定其分类和分级。并且进一步明确NOS和NES的使用,NOS表示无法建立组织形态学联合分子水平的整合诊断,进而提醒分子检测尚未进行或技术原因导致的分子检测的失败。NEC表示已成功进行了必要的诊断性检查,但鉴于临床、组织学、免疫组织化学和/或遗传特征不相匹配,无法做出WHO整合诊断。
WHO CNS 5充分结合传统光学显微镜、组织化学染色、电子显微镜、免疫组织化学、分子遗传学,以及各种组学分析方法在内的各种方法和技术,融合DNA和RNA测序、DNA荧光原位杂交、RNA表达谱等核酸检测的方法,以及新采用的甲基化分析、拷贝数改变等信息整合分析为整合分层分析提供充分的依据。新分类对多种常见肿瘤提供了关键基因、分子及信号通路改变的建议。在此基础上,新分类还建立了新的分层诊断建议格式,结合组织学诊断、WHO分级和分子检测结果的整合诊断格式为最优的组合。
3.2 胶质瘤、胶质神经元肿瘤和神经元肿瘤
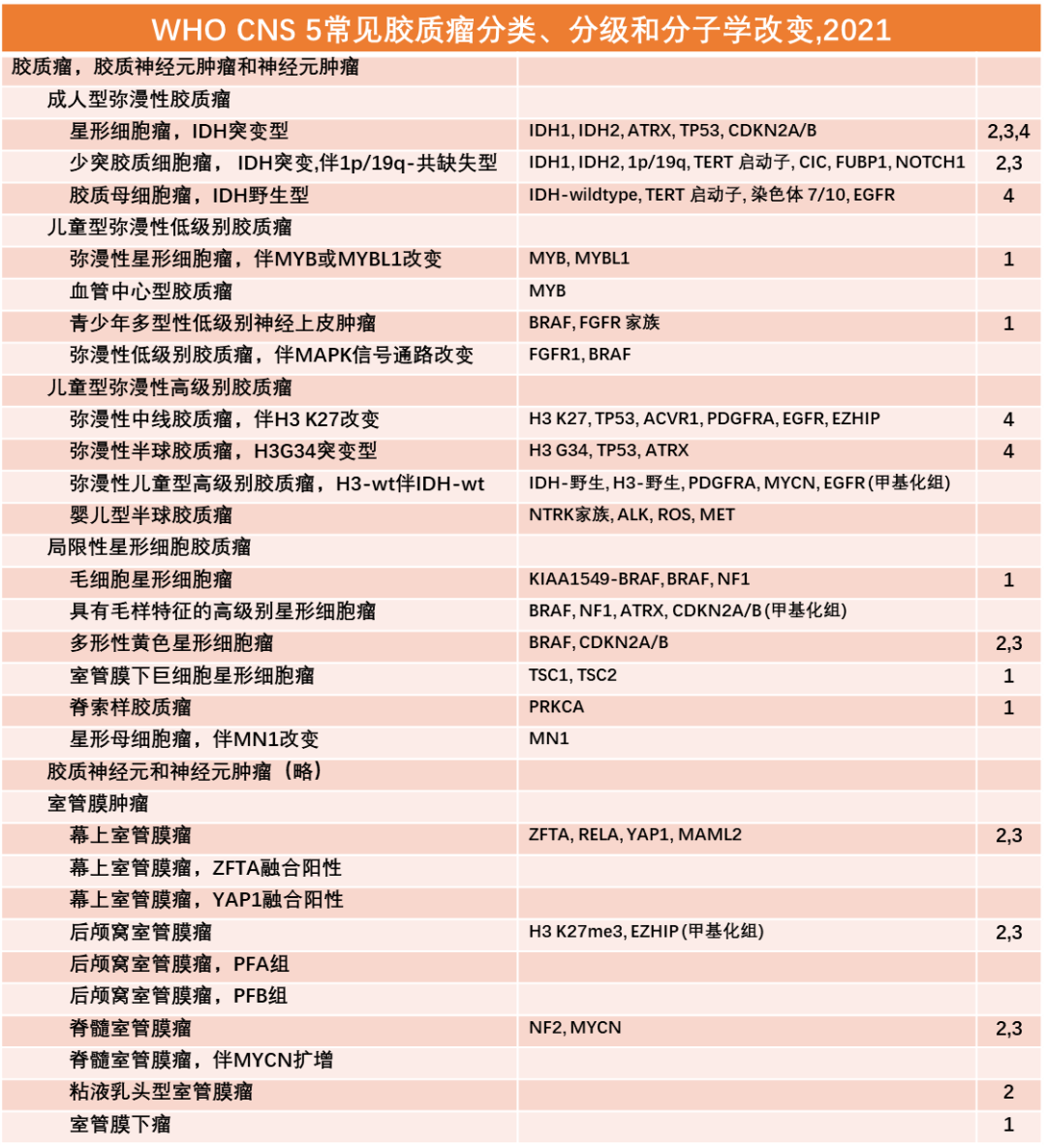
星形细胞瘤,IDH突变型,2级
星形细胞瘤,IDH突变型,3级
星形细胞瘤,IDH突变型,4级
IDH突变型弥漫性胶质瘤已经在前文分类,IDH野生型伴有H3 K27M突变的弥漫性胶质瘤在2016版WHO分类中已经将其定义为弥漫中线胶质瘤。IDH-wt/H3-wt弥漫性胶质瘤中,形态学级别为II-III级的胶质瘤如果伴有EGFR扩增、TERT启动子突变或者染色体+7/-10的部分,侵袭性较强,被分类为分子病理胶质母细胞瘤(cIMPACT NOW 3)。除此之外的IDH-wt/H3-wt弥漫性胶质瘤多可伴有BRAF V600E突变、FGFR改变或MYB/MYBL1改变,多发生在儿童和青少年,也可发生在成年人,多数伴有癫痫。这部分肿瘤界定为儿童型弥漫性胶质瘤。大部分类型已经在cIMPACT-NOW 4中详述。
WHO CNS 5中将儿童型弥漫性胶质瘤根据组织学级别不同分为两大类。儿童型弥漫性低级别胶质瘤包括弥漫性星形细胞瘤,MYB或MYBL1改变;血管中心型胶质瘤;青少年多型性低级别神经上皮肿瘤,弥漫性低级别胶质瘤,伴MAPK信号通路改变。儿童型弥漫性高级别胶质瘤包括弥漫性中线胶质瘤,H3 K27改变;弥漫性半球胶质瘤H3 G34突变;弥漫儿童型高级别胶质瘤,H3野生/IDH野生;和婴儿型半球胶质瘤,多数肿瘤均为新命名的肿瘤类型,具有相应的新的诊断要点。
3.3 胚胎来源肿瘤
04
WHO CNS 5是在分子病理时代神经系统肿瘤的新分类体系,在原有组织学和发生学的病理学方法基础上,应用多种新的分子病理手段辅助分类,有机联系了形态学改变、基因/蛋白/表观/信号转导调控等分子生物学改变和临床特征等,结合分级诊断体系逐步优化,结合临床预后信息进行分类,有效指导临床对疾病生物学行为和恶性程度的预测与判断,并对精准治疗提供一定的帮助。
①WHO CNS 5将弥漫性胶质瘤类型分为成人型和儿童型两大类。但是成人型并非只发生于成人,同样,儿童型也并非只发生于儿童。
②成人型弥漫性胶质瘤中,将IDH突变型弥漫性星形细胞瘤作为单独一类。WHO级别分为2-4级,并应用CDKN2A/B等辅助分级,同时取消了IDH突变型胶质母细胞瘤的诊断。
③少突胶质细胞瘤限定为IDH突变伴有1p/19q联合缺失的弥漫性胶质瘤,WHO级别分为2-3级。少突胶质细胞肿瘤即便其组织学表现上出现4级胶质母细胞瘤类似的血管增生和坏死等现象,也不将其列为4级肿瘤。
④新分类进一步明晰了胶质母细胞瘤定义,首先必须明确为IDH野生型的弥漫性胶质瘤,取消了原有的IDH突变型胶质母细胞瘤的概念。IDH野生型胶质瘤中,一部分为形态学上符合4级胶质瘤者可以直接可以给予诊断,另一部分为形态学属于2-3级胶质瘤,但是分子学具有EGFR扩增或联合出现+7/-10或TERT启动子突变等分子表现者也可以诊断。
⑤新分类根据组织学和恶性程度不同,儿童型弥漫性胶质瘤分为高级别和低级别。除前一版本已经表述的具有H3 K27改变的弥漫中线胶质瘤,又增加了具有H3 G34突变的弥漫半球胶质瘤、H3-wt/IDH-wt的儿童型高级别胶质瘤和婴儿型半球胶质瘤等多种新定义的胶质瘤类型。
⑥新分类将部分局限性生长的胶质瘤归类为局限性星形细胞瘤的大类。
⑦室管膜瘤的分类结合肿瘤的部位及不同的分子特征进行分类。
主要参考文献
王樑 副教授
空军军医大学唐都医院
空军军医大学唐都医院神经外科副主任
空军军医大学唐都医院脑胶质瘤中心主任
美国加州大学旧金山分校和约翰霍普金斯大学访问学者
王忠诚神经外科医师奖-青年医师奖
中国抗癌协会青年理事
中国抗癌协会脑胶质瘤专业委员会常务委员/青年委员会主任委员
陕西省医师协会神经外科分会常务委员
陕西省抗癌协会青年委员会常务委员
陕西省抗癌协会神经肿瘤专业委员会副主任委员/青年委员会主任委员





