提示
前言
神经肿瘤是颅内常见病,主要包括神经上皮肿瘤、脑膜瘤、转移瘤及淋巴瘤等。从483期开始将刊发“第二轮神经肿瘤系列”,与同道共享,欢迎大家批评指正和交流讨论。
病例简介
患者,女性,18岁,因“头晕2月”入院。
患者于2月前在家中无明显诱因下出现头晕,伴有恶心呕吐一次,呕吐胃内容物,当时无听力下降,无视物模糊等不适,至社区医院就诊,予对症支持治疗未好转,至当地医院查MR提示小脑占位,遂转至我院治疗。
患者既往身体健康,无高血压、糖尿病等慢性病史,无烟酒不良嗜好。
入院查体:神志清,精神可,对答切题,双侧瞳孔等大等圆,对光反射灵敏,直径3mm,颈软。四肢肌力5级,肌张力正常。
诊疗经过
患者入院完善术前检查,头颅CT提示:右侧小脑半球-枕叶混杂密度肿块,大小约71*37mm,内见钙化,邻近颅骨骨质破坏、变薄,第四脑室受压(图1、图2)。进一步完善头颅增强MRI提示右侧颞枕部占位,脑外起源考虑,软骨肉瘤可能,血管瘤型脑膜瘤或血管瘤待排(图3)。
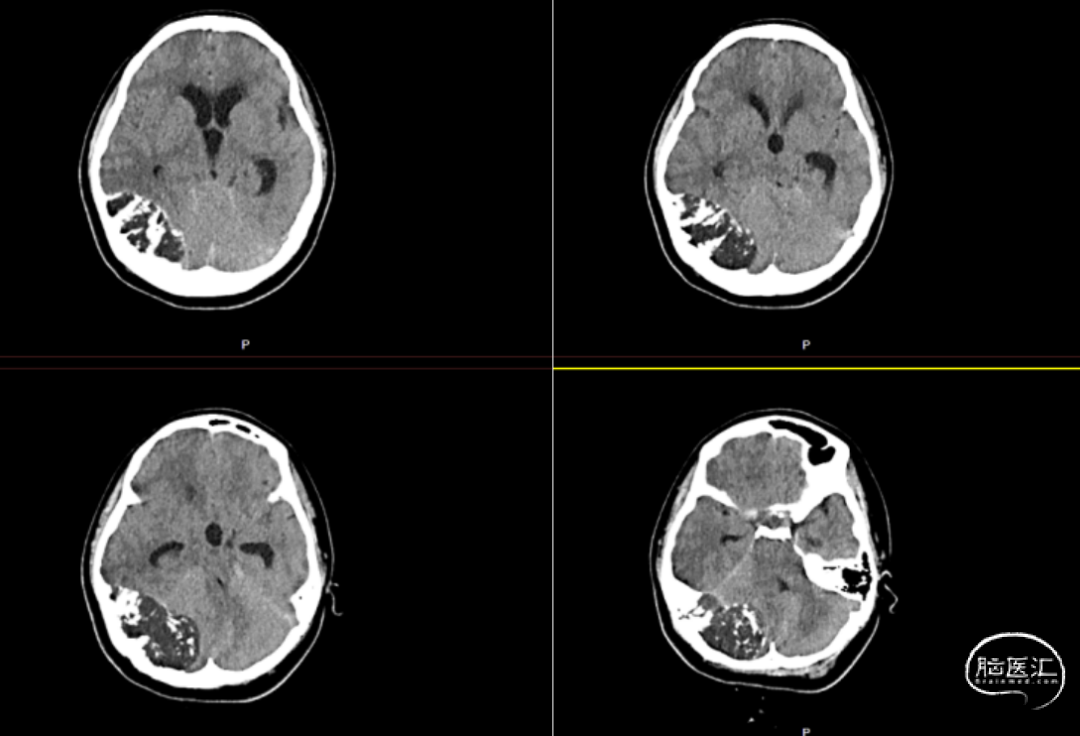
图1. 头颅CT影像,见右侧小脑半球-枕叶混杂密度肿块,大小约71*37mm,内见钙化。
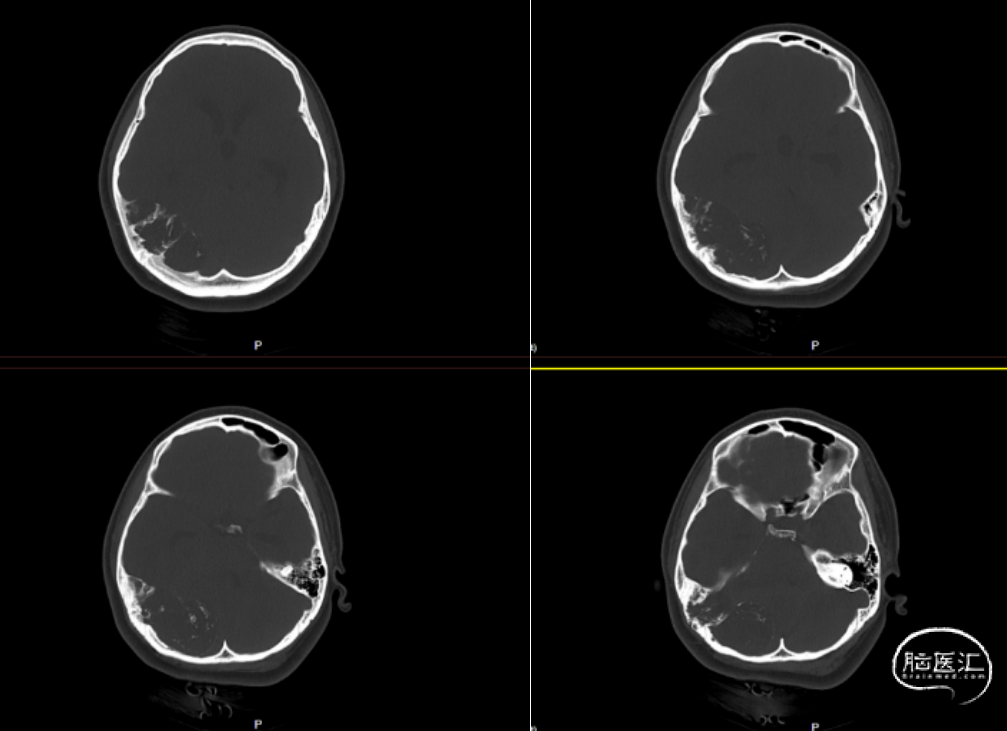
图2. 头颅CT骨窗像,见肿块邻近颅骨骨质破坏、变薄。
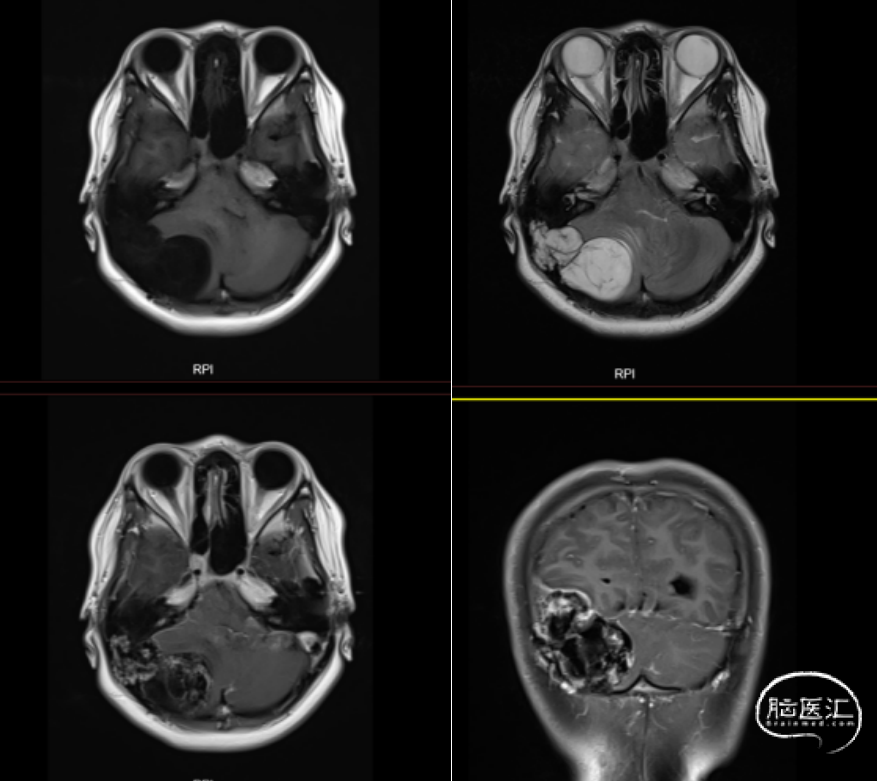
图3. 头颅增强MRI图像,见右侧颞枕部混杂长T1长T2信号肿块,大小约60*37mm,T1WI为低信号影,T2WI为高信号影,内见线样低信号影,增强后病变不均匀渐进性强化,临近脑实质及脑室系统受压,侧脑室和三脑室扩张积水。
经科室讨论后,建议手术切除肿瘤,解除占位效应,并明确肿瘤病理。在充分告知患者家属病情及治疗方案后,取右侧小脑“L型“入路行“右侧小脑病损切除术”。术中见:肿瘤灰白色,质地韧,内含骨片,侵犯颅骨及乳突,血供中等。肿瘤与小脑脑膜黏连,脑膜相对完整。术中冰冻见异型梭形细胞及粘液样背景,考虑为肿瘤。予全切,手术顺利。
病理结果
术后常规病理提示:肿瘤,良性或交界性可能性大,间叶源性或软骨源性肿瘤可能性大,难除外软骨粘液样纤维瘤(图4)。
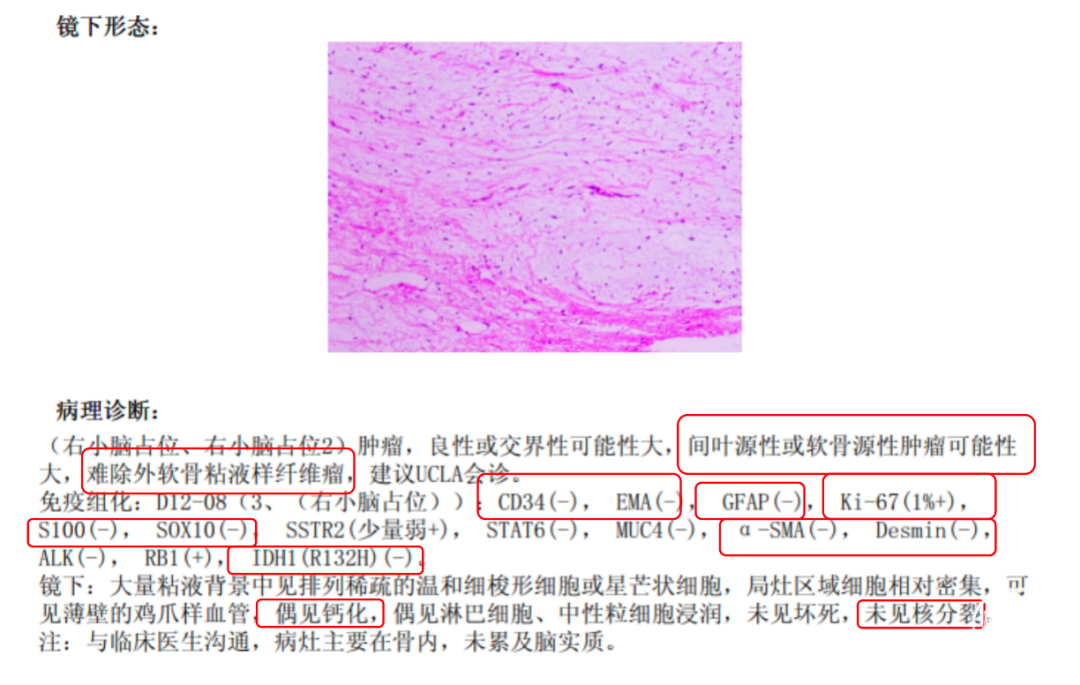
图4. 术后常规病理结果。
病理科讨论意见:结合该年轻患者的临床表现、影像特征及常规病理结果,得出如下鉴别诊断(图7):
1. 软骨粘液样纤维瘤(Chondromyxoid fibroma,CMF):青少年好发的良性骨内肿瘤,以黏液背景、鸡爪样血管及FOS/FOSB基因重排为特征。
2. 间叶源性肿瘤:源自间叶组织的异质性肿瘤群,涵盖良性至高度恶性亚型,免疫表型及分子变异多样(如平滑肌肉瘤、脂肪肉瘤等)。
3. 软骨源性肿瘤:以软骨分化为特征的肿瘤,如S100阳性的软骨母细胞瘤(青少年骨骺)或异型性明显的软骨肉瘤(中老年,IDH基因突变)。
本例患者为18岁女性,以头晕为主要症状,结合其年龄特征(10-30岁为颅内CMF高发年龄段)及影像学表现(边界清晰的溶骨性病变伴斑点状钙化),需优先考虑软骨源性或间叶源性肿瘤。病理学分析显示肿瘤呈分叶状结构,含丰富粘液样基质及温和的梭形细胞,核分裂象罕见,Ki-67增殖指数低(1%+),提示肿瘤恶性程度低。免疫组化结果中S-100阴性、缺乏典型组织学特征(格子样钙化、核沟、破骨巨细胞)及部位不典型排除了软骨母细胞瘤。同时,异型性缺乏及上皮膜抗原(Epithelial membrane antigen,EMA)阴性进一步排除了软骨肉瘤和间叶源性恶性肿瘤(如粘液纤维肉瘤)。尽管未检测FOS/FOSB基因重排,但结合“鸡爪样”血管模式及低侵袭性生物学行为,最终诊断为CMF。

图7. 颅内CMF与间叶及软骨源性肿瘤特征对比。
患者术后神清,反应可,对答尚可,GCS15分,四肢查体配合,术后复查头颅CT未见明显出血(图5),遂予预防感染、癫痫,降颅压等对症治疗。术后复查头颅MRI提示肿瘤全切(图6),于术后第7天康复出院。
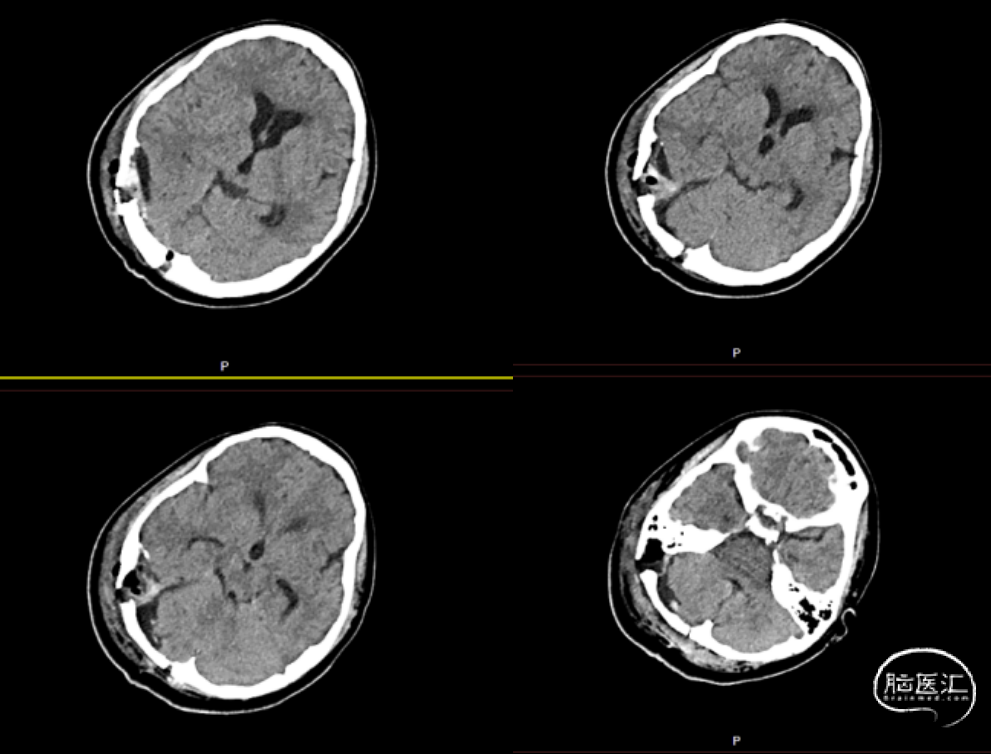
图5. 术后第1日复查头颅CT,显示肿瘤全切。
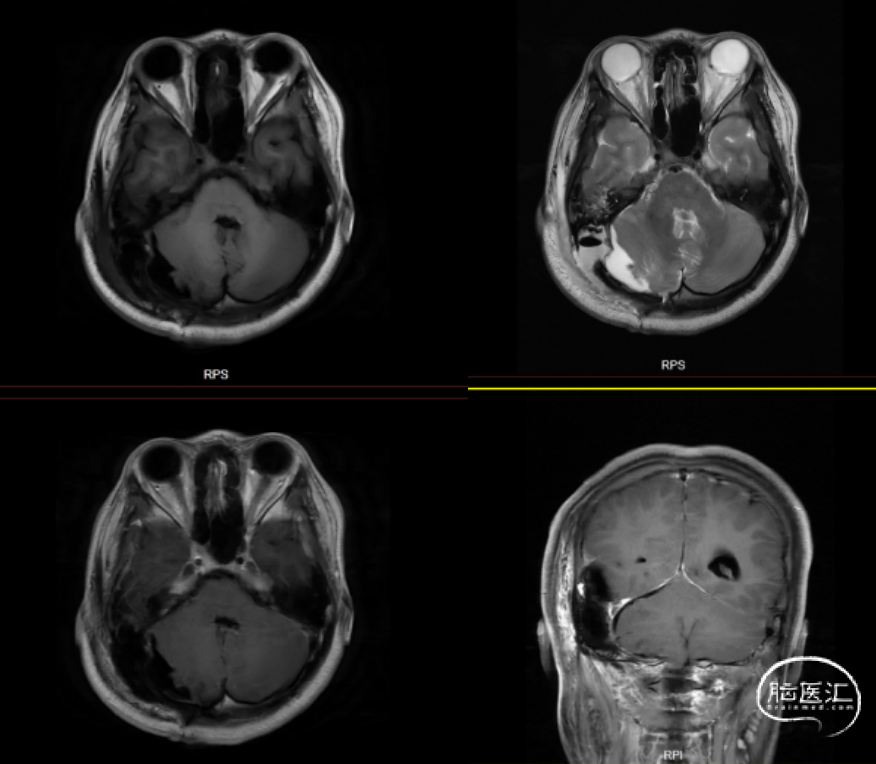
图6. 术后MRI检查,显示肿瘤全切。
讨论
一02
流行病学特征
软骨黏液样纤维瘤(Chondromyxoid fibroma,CMF)是一种罕见的良性软骨肿瘤,由Jaffe与Lichtenstein于1948年首次描述,约占骨肿瘤的0.5%,好发于长骨干骺端[1]。颅骨为CMF的非典型发病部位,仅2%的病例累及颅骨或面骨[2,3]。颅内CMF多见于额骨、蝶骨及颞骨,好发于骨骼发育活跃的青少年及青年人群,男性发病率稍高于女性[4]。全球报道的颅内CMF病例不足50例,累及前[5]、中[6]、后颅窝[7]者均有报道。其中颅顶骨通过膜内骨化形成,而颅底骨骼则依赖软骨内骨化发育。尽管二者的骨化机制存在差异,CMF在颅顶与颅底的发生率相似[5]。现有研究提示,CMF的起源可能与颅底连合骨(软骨内骨化区)、颅骨缝合线(膜内骨化区)或胚胎软骨残留组织相关[7]。由于颅面部CMF罕见且临床特征重叠,常误诊为软骨肉瘤或软骨母细胞瘤等软骨源性肿瘤,导致诊疗困难[8]。
二
临床表现
颅内软骨黏液样纤维瘤的临床表现因肿瘤位置而异,起病缓慢,症状轻微,病程较长,通常无明显全身症状。常见症状包括颅内压增高(如头痛、恶心)和局部神经功能缺损(如头晕、平衡失调、视力障碍)。例如,1997年的一篇病例报告描述了一名35岁女性,其额骨-蝶骨交界处的CMF导致额部头痛和眼眶浸润[4]。同年,另有一例颞骨CMF病例被报道,患者具有一年头痛病史,伴有进行性耳痛和轻度听力丧失[3]。此外,也有因精神症状及头痛伴鼻塞起病的额骨CMF病例的报道[2]。以睡眠期间惊厥发作伴弥漫性头痛为症状起病的青少年顶骨CMF病例也有文献记录[5]。此外,枕骨CMF侵犯横窦-乙状窦交界区并继发急性后颅窝出血的病例亦有报道[7]。类似地,本病例中的年轻女性因肿瘤侵犯小脑而出现头晕和恶心。
三
影像学特点
据文献报道,软骨黏液样纤维瘤的影像学特征包括界限清晰的局灶性骨病变,呈分叶状偏心性生长,伴皮质变薄/破坏、硬化边缘及内部骨小梁,受累骨骼可向软组织扩展边缘[9]。尽管肿瘤可侵袭周围骨质并压迫神经血管,但脑组织及硬脑膜通常不受累[9]。
本例颅内软骨黏液样纤维瘤的影像学表现典型,CT与MRI可辅助术前评估肿瘤边界及与周围结构的毗邻关系。CT可清晰显示边界清晰的溶骨性病变,伴边缘硬化及周围骨结构改变,但钙化检出率较低(约13%),多见于颅面部CMF或年轻患者[1]。组织学中钙化检出率更高(约35%),颅底CMF的细胞内钙化比例可达75%[2],本例患者CT与组织学均证实钙化存在(图1)。 MRI在确定病变范围方面比CT更有效。肿瘤在T1加权像上呈低信号,T2加权像上呈高信号,增强后显著强化,周围可能有软组织肿胀。通常由于纤维、软骨样和粘液样成分的组成不同,T2-STIR或T2加权脂肪抑制图像显示中等到高信号[5]。此外,MRI能清晰显示病变周围正常血管结构,对制定手术方案至关重要[2]。
四
病理学诊断
软骨黏液样纤维瘤的典型组织学表现为黏液样基质区、纤维区及软骨分化区共同构成的假小叶结构,其内可见星形或梭形细胞分布于黏液样或软骨样间质中[10]。肿瘤细胞表达Sox9及II型胶原蛋白等软骨分化标志物,小叶边缘常散在分布多核巨细胞。需注意的是,体积较大的CMF因局部细胞异型性及浸润性生长模式,需结合影像学及分子标志物与软骨肉瘤进行鉴别。
五
鉴别诊断
CMF的临床与病理诊断需与软骨肉瘤、软骨母细胞瘤及脊索瘤等病变进行鉴别。CMF早期症状隐匿且缺乏特异性,其影像学特征(如分叶状溶骨性破坏、边缘硬化)与多数软骨源性肿瘤存在重叠,组织学上亦因黏液样基质、假小叶结构及软骨分化区域与其他疾病存在交叉,需结合临床、影像及免疫组化特征综合判断[11]。
1
软骨肉瘤
CMF易与低级别软骨肉瘤混淆,但两者存在关键差异。软骨肉瘤好发于颅底,镜下以显著细胞异型性(核大深染、双核细胞)及浸润性生长模式为特征,而CMF细胞异型性较轻且边界相对清晰。IDH1/2突变在软骨肉瘤中常见,与肿瘤的罕见亚型或恶性转化相关[1]。黏液样软骨肉瘤是颅面部软骨肉瘤中最罕见的变异型,虽含黏液基质,但其细胞多形性低于CMF,且肿瘤细胞多分布于血管周围而非纤维带下方[12]。
2
软骨母细胞瘤
软骨母细胞瘤多起源于生长板附近的间充质细胞,与CMF的发病机制存在差异[10]。该疾病好发于骨骺,疼痛和局部肿胀一般较CMF剧烈,影像学特征为卵圆形、边界清晰的病变,伴骨质增生和钙化[13]。其组织学上缺乏CMF的假小叶结构及小叶周边纤维带。软骨母细胞瘤免疫组化中 S-100蛋白通常强阳性,并特征性表达H3F3B K36M突变,CMF无此突变[13]。且Sox9在CMF中阳性细胞比例更高,提示CMF处于更成熟的软骨分化阶段[10]。
3
脊索瘤
颅颌面CMF在影像学上也可能与脊索瘤混淆。一般脊索瘤好发于斜坡-骶尾轴,而颅颌面CMF更易累及额颞区[11]。脊索瘤的典型特征包括浸润性生长边界,镜下可见巢状或条索状排列的大上皮细胞,胞质呈嗜酸性或空泡状,且肿瘤细胞表达角蛋白及EMA,但不显示软骨分化标志物[5]。尽管二者存在表面相似性,但脊索瘤缺乏CMF的细胞多形性及假小叶结构等特征,可通过组织学细节及免疫表型进行区分[2]。
4
黏液纤维肉瘤
CMF的组织学鉴别诊断还需考虑黏液纤维肉瘤。黏液纤维肉瘤组织学上显示黏液样基质和纤维母细胞样细胞,具有更高的细胞密度和明显的核异型性[14]。其黏液样基质丰富,但缺乏软骨样分化。免疫组化分析通常表达波形蛋白和CD99,而不表达S-100和上皮标志物。
综上,CMF的诊断需重点排除具有侵袭性生物学行为的肿瘤(如软骨肉瘤、脊索瘤)[8]。对于疑难病例,建议联合影像特征(病变边界、钙化模式)、组织学细节(小叶结构、细胞异型性)及免疫组化(角蛋白、Sox9、II型胶原)进行综合分析。
六
治疗及预后
软骨黏液样纤维瘤(CMF)属于良性但具局部侵袭性的骨肿瘤,需警惕其侵袭性生长模式及复发倾向[10]。手术完全切除是首选治疗方式,全切可显著降低复发风险。对于术后残留病灶,可考虑辅助放疗,但放疗剂量(50-60Gy)的肿瘤控制效果仍需进一步验证[11]。文献报道未接受放疗者复发率为13%-22%,其中颅底CMF因解剖复杂难以全切,复发风险更高[7]。预后通常良好,恶性转化罕见,但仍需长期随访以监测复发[15]。目前尚无CMF转移病例的明确报道。
总结
参考文献
往期回顾
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。







