载脂蛋白E4(APOE4)是阿尔茨海默病(AD)最强的遗传危险因子。在APOE的三种等位基因APOE2、APOE3和APOE4中,APOE4可增加AD风险,降低疾病发作的年龄,并促进包括β-淀粉样蛋白(Aβ)和过度磷酸化tau(p-tau)蛋白的沉积等经典AD病理。虽然APOE4与AD密切相关,但其在AD发病机制中的作用是复杂的,仍需进一步深入探索。格拉德斯通神经病学研究所Yadong Huang团队近期在《Cell Stem Cell》期刊发表了题为“Microglia depletion reduces human neuronal APOE4-related pathologies in a chimeric Alzheimer’s disease model”的文章。该团队为了探究APOE4在AD中的作用,通过对小胶质细胞耗竭的诱导多能干细胞(iPSC)衍生的人类神经元移植小鼠嵌合模型(即将纯合APOE4、等位基因APOE3和APOE-knockout(APOE-KO)的iPSC衍生的人类神经元移植到人APOE3或APOE4敲入的小鼠海马中,然后应用PLX耗竭小鼠海马的小胶质细胞)进行研究,发现神经元APOE和小胶质细胞的存在对依赖于APOE(APOE4> APOE3)的Aβ和tau蛋白病理的形成至关重要。小胶质细胞RNA测序分析发现,在人类APOE4神经元移植的嵌合小鼠中,两种促炎小胶质细胞的MHC-II基因表达升高。这些发现强调了神经元APOE,特别是APOE4和小胶质细胞在AD发病中的协同作用。

结果一
移植的hiPSC来源的神经元在APOE-KI小鼠海马中存活
研究者构建并鉴定了三种不同的人诱导多能干细胞(hiPSC)系:(1)取自一位阿尔茨海默病(AD)患者的纯合人类 APOE4(hE4)hiPSC;(2)通过基因编辑从hE4 hiPSC 系获得的纯合人APOE3(hE3) hiPSC;(3)取自一位带有 APOE基因移码缺失突变(c.291del,p.E97fs)患者的纯合人APOE基因敲除(hEKO)hiPSC 。为构建嵌合型阿尔茨海默病(AD)模型,研究者采用已确立的神经元分化方案,将这三种hiPSC系分化为混合神经元培养物(包括兴奋性和抑制性神经元),并将其移植到4月龄E4KI和E3KI小鼠的海马体中。此前研究表明,APOE4可能对早期大脑发育产生影响,因此选择4月龄小鼠进行移植,以便更好地分离APOE亚型对与衰老和晚发性阿尔茨海默病(AD)相关生物学过程的影响。hE4和hE3神经元分别被移植到具有APOE基因型匹配的E4KI和 E3KI小鼠体内(hE4神经元移植到E4KI小鼠,hE3神经元移植到E3KI小鼠),而hEKO神经元则被移植到E4KI小鼠体内,以研究缺乏APOE的人类神经元与表达APOE4的小胶质细胞之间的相互作用。为提高移植细胞的存活率,在移植后的第 0、2、4 和 6 天,给小鼠使用免疫抑制剂混合物以阻断其免疫反应。随后,让嵌合小鼠生长8个月,全程喂食AIN - 76A对照饲料,或前4个月喂食对照饲料,后 4个月喂食含有400 mg/kg PLX 的 AIN - 76A - PLX 饲料(图 1A)。实验条件根据移植的人类细胞的APOE基因型(hE3 - 、hE4 - 、hEKO - )、宿主小鼠的APOE基因型(E3KI和 E4KI)以及嵌合小鼠所食用的饲料类型(对照饲料、PLX 饲料)进行标记(图 1A)。本研究共使用了六组小鼠:hE4 - E4KI、hE4 - E4KI - PLX、hE3 - E3KI、hE3 - E3KI - PLX、hEKO - E4KI 和 hEKO - E4KI - PLX(图 1A)。
移植 8 个月后,对嵌合小鼠进行心脏灌流,一侧大脑半球固定用于免疫组织化学分析,另一侧半球则用于分离海马体小胶质细胞进行单细胞 RNA 测序(scRNA - seq)。移植细胞对人类核抗原(HNA)和成熟神经元标记物 MAP2 染色呈阳性(图 1B 和图 S1D)。绝大多数 HNA + 细胞的星形胶质细胞标记物 GFAP 染色呈阴性(图 S1A),对少突胶质细胞标记物OLIG2染色同样呈阴性(图 S1B),这表明移植的人源细胞大多发育为神经元,而非星形胶质细胞或少突胶质细胞(图 S1C)。通过免疫组织化学分析,我们证实移植的所有人源细胞均存活,且各条件下的移植物在细胞数量或移植物大小方面无显著差异(图 1C 和图 1D)。与先前发表的嵌合小鼠研究类似,移植细胞并未从原始移植部位迁移太远。此外,移植的人源神经元对神经元核标记物NeuN染色呈阳性(图 1E),对人类突触标记物突触素染色呈阳性(图 1F)。对嵌合小鼠离体脑片中移植的人源神经元进行全细胞膜片钳记录,结果也显示这些神经元能够产生动作电位(图 1G),并以自发性突触后电流的形式接收突触输入(图 1H)。综上所述,这些数据表明移植的人源神经元在E3KI和E4KI小鼠海马体中成功存活、成熟,并实现了功能整合。本实验使用的MAP2抗体对人源神经元比对小鼠神经元具有更高的识别特异性,使得移植的人源神经元看起来比周围的小鼠神经元明显更亮(图 1B)。因此,在后续所有染色实验中,研究者都使用该MAP2抗体 染色来识别移植的人源神经元。

图 1. 移植的人源神经元祖细胞在嵌合小鼠海马体中存活并发育为神经元。
PLX处理有效地消耗了嵌合小鼠海马体中的小胶质细胞,而不是星形胶质细胞
研究者测量了PLX处理对海马中小胶质细胞的影响。在用小胶质细胞标志物Iba1对嵌合小鼠脑片染色后,发现在用PLX处理的所有三个组中显著的小胶质细胞耗竭(图2A和2B)。出乎意料的是,hE4-E4KI-PLX小鼠海马体中的小胶质细胞清除率(93%)比hEKO-E4KI-PLX(84%)和hE3-E3KI-PLX(67%)更有效。hE3-E3KI-PLX小鼠中小胶质细胞清除效果减弱,可能是因为 hE3-E3KI小鼠中小胶质细胞的基线数量比hE4-E4KI小鼠多(图 2B),但这种差异值得进一步研究。
为此,研究者试图检测E3KI和E4KI小鼠海马体中小胶质细胞的Csf1r表达的基线水平。为了与首次给予PLX的小鼠年龄相匹配,研究者选取8个月大的未移植E3KI和E4KI小鼠,使用荧光激活细胞分选术(FACS)分离海马CD 11b+/CD 45int小胶质细胞,并使用BD LSR FortessaeTM X-20细胞分析仪测量 Csf1r 水平(图S2 A)。比较每种条件下的6只小鼠(图S2 B),我们发现E4KI小胶质细胞显示出比E3KI小胶质细胞显著增加(38%)的Csf1r中值荧光强度(MFI)(图S2 C和S2 D)。这表明,较高的Csf1r 基线表达(这可能是小胶质细胞中APOE4驱动的效应)使E4KI小鼠的小胶质细胞对Csf1r拮抗剂PLX的作用更敏感。
为了检测人源神经元移植物是否会导致E4KI小鼠对PLX敏感性增加,研究者进行了一项小型队列研究,对未处理的E3KI和E4KI小鼠使用PLX处理约 2个月(图 S2E)。与嵌合小鼠类似,未处理的E4KI小鼠的小胶质细胞基线数量低于未处理的E3KI小鼠,并且接受PLX处理的E4KI小鼠的小胶质细胞数量相较于接受PLX处理的E3KI小鼠显著减少(图 S2F)。这些数据表明,E4KI小鼠中小胶质细胞的基线数量以及对PLX的特殊敏感性并非由移植的人源神经元所致。
研究者还检测了PLX处理是否会导致海马体中另一种主要的神经胶质细胞 —— 星形胶质细胞的减少。用星形胶质细胞标记物GFAP进行染色后发现,在所有嵌合小鼠的实验条件下,海马体中的星形胶质细胞数量并没有显著差异(图 2C 和图 2D)。这些研究表明,无论在体外还是体内,使用PLX处理都不会改变星形胶质细胞的整体活力。
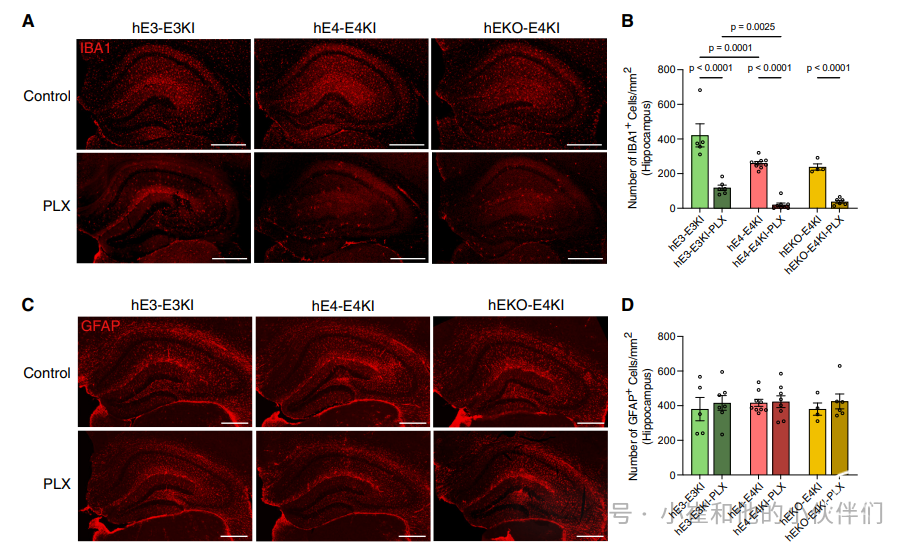
图2. PLX减少嵌合小鼠海马体中的小胶质细胞,但对星形胶质细胞无影响。
结果三
在神经元APOE4存在的情况下,小胶质细胞缺失会减少Aβ沉淀
研究者之前报道了移植的人源神经元在EKI小鼠中会产生Aβ沉淀和硫黄素-S+小斑块,APOE4会加剧这种表型。移植的人源神经元能产生Aβ沉淀,而这在人体外神经元模型以及没有APP家族性AD突变的小鼠体内模型中均不会形成。这为研究不同APOE基因型的小胶质细胞对人类神经元APOE驱动的Aβ病变的影响提供了独特的机会,这种模型能更好地模拟晚发性AD。用人类Aβ特异性单克隆抗体3D6+对嵌合小鼠海马体切片染色后,研究者发现,在所有条件下,3D6+Aβ沉淀都在MAP2标记的移植人源神经元内或紧邻其周围形成(图 3A)。与之前对嵌合小鼠模型的研究相似,绝大多数Aβ沉淀在距人源神经元移植物100μm范围内形成(图 S3A、S3C 和 S3E),在该边界之外的海马体区域则很少(图 S3F)。这些重复的结果再次证实,人源神经元移植物是这些Aβ沉淀的来源。
在后续所有的定量分析中,研究者进行了以下比较:(1)将hE4-E4KI小鼠与hE3-E3KI小鼠进行对比,以及将hE4-E4KI-PLX小鼠与hE3-E3KI-PLX小鼠进行对比,以此衡量APOE4与APOE3的作用差异;(2)把hEKO-E4KI小鼠与 hE4-E4KI小鼠进行比较,同时比较hEKO-E4KI-PLX小鼠与hE4-E4KI-PLX小鼠,专门评估神经元APOE基因敲除(APOE-KO)与APOE4的作用差异;(3)在每个APOE基因型组内,对比喂食对照饲料的小鼠和喂食含PLX饲料的小鼠,来测定小胶质细胞清除的影响。所有实验条件均以hE4-E4KI小鼠的实验结果为参照进行标准化处理,因为hE4-E4KI小鼠在与hE3-E3KI小鼠和hEKO-E4KI 鼠的比较中是共同的对照因素。当我们对移植物100μm范围内每平方微米的Aβ沉淀数量进行量化时,发现APOE对Aβ沉淀数量有显著影响。在喂食对照饲料的嵌合小鼠中,hE3-E3KI小鼠的Aβ沉淀数量明显少于hE4-E4KI小鼠(图 3B),这证实了先前的研究结果,即APOE4会加剧淀粉样病变。在小胶质细胞耗竭后,hE4-E4KI小鼠的平均Aβ沉淀数量减少了一半,调整后的p值(q值)略低于显著性水平(p=0.0559)(图 3B)。这些结果表明,小胶质细胞的存在促进了神经元APOE4相关的Aβ病变以及淀粉样斑块的形成。相比之下,在 hE3-E3KI-PLX 小鼠中,清除小胶质细胞对 Aβ沉淀数量没有显著影响。这些数据支持了这样的结论:人源APOE4神经元和APOE4小胶质细胞的存在均会促进Aβ沉淀的形成。
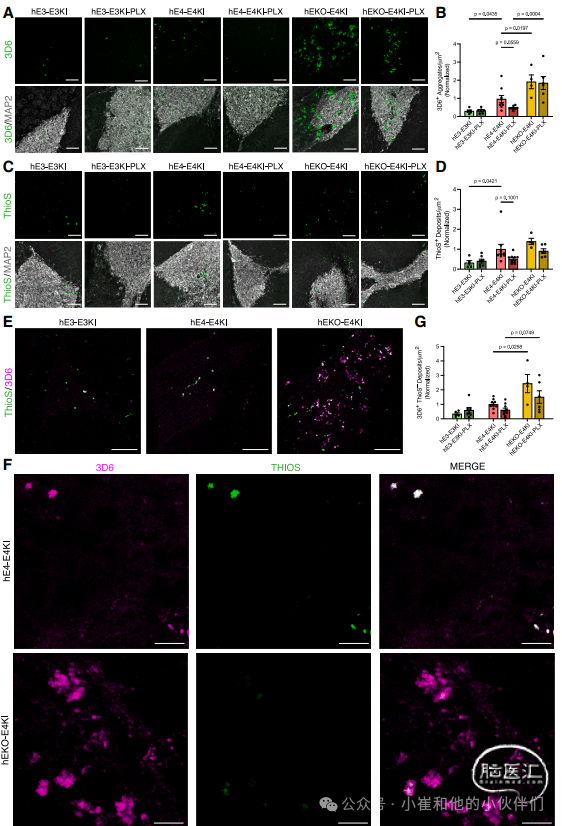
图3. 人源APOE神经元及小胶质细胞清除对嵌合小鼠海马体中Aβ病变的影响。
结果四
神经元APOE缺乏会增加弥漫性Aβ沉淀,且不受小胶质细胞影响
此外,研究发现,hEKO-E4KI小鼠的3D6+Aβ沉淀数量比hE4-E4KI小鼠更多(图 3B)。与hE4-E4KI-PLX小鼠海马体不同,在hEKO-E4KI-PLX小鼠海马体中,小胶质细胞清除对Aβ沉淀数量没有影响(图 3B)。为了进一步研究,研究者比较了hEKO-E4KI小鼠(有和没有PLX处理)与具有神经元APOE4的 hE4-E4KI小鼠的Aβ染色模式,并注意到hEKO-E4KI小鼠Aβ沉淀的明显形态差异,包括尺寸增加(图 S3I)和“弥漫性”羽毛结构(图 3A)。为了更好地了解这些沉积物的性质,研究者用致密核心斑块标记物硫黄素- S对嵌合小鼠海马体进行染色(图 3C)。与 Aβ情况类似,硫黄素- S染色显示,hE4-E4KI小鼠的致密核心沉积物数量明显多于hE3-E3KI小鼠(图 3D)。然而,hEKO-E4KI和hE4-E4KI组的致密核心沉积物在大小或数量上没有差异(图 3D 和图 S3J),在去除小胶质细胞后,致密核心沉积物数量也没有显著减少(尽管 hE4-E4KI-PLX小鼠中似乎有减少的趋势)。重要的是,虽然hE3-E3KI和 hE4-E4KI 鼠中的许多Aβ沉淀与硫黄素- S共定位,但hEKO-E4KI小鼠中的大多数Aβ沉淀对硫黄素- S染色呈阴性(图 3E 和图 3F)。研究者对这些 3D6+/硫黄素-S- Aβ沉淀(称为弥漫性Aβ沉淀)进行量化,发现hEKO-E4KI小鼠的弥漫性Aβ沉淀数量明显多于hE4-E4KI小鼠(图 3G)。这些结果表明,在体内去除人源神经元中的APOE会特异性地促进弥漫性Aβ沉淀的形成,且不受小胶质细胞清除的影响。有趣的是,这种表型是在hEKO-E4KI小鼠海马体中存在高水平星形胶质细胞分泌APOE4的情况下出现的,这表明移植的人源神经元产生的APOE4是致密核心Aβ斑块形成的关键驱动因素。
为了进一步研究APOE在Aβ发病机制中的作用,研究者检测了APOE蛋白染色呈阳性的致密核心和弥漫性Aβ沉淀的百分比(图 S4A)。先前的许多研究表明,APOE可以直接与Aβ相互作用以稳定聚集,在体内可在Aβ斑块中发现其沉积,并且可以引导Aβ诱导的小胶质细胞趋化。研究者发现,APOE主要存在于致密核心而非弥漫性Aβ沉淀中(图 S4B 和图 S4C)。有趣的是,具有APOE人源神经元(hE3-E3KI 和 hE4-E4KI)的嵌合小鼠中,APOE +致密核心Aβ沉淀的百分比也明显高 hEKO-E4KI小鼠,这突出了人源神经元APOE在致密核心Aβ沉淀病因学中的潜在作用。在小胶质细胞清除后,hE4-E4KI-PLX小鼠的APOE +致密核心Aβ沉淀百分比明显高于hE4-E4KI小鼠(图 S4B),这可能是由于小胶质细胞对APOE的清除减少所致。相比之下,hEKO-E4KI-PLX小鼠与hEKO-E4KI小鼠一样,APOE+致密核心Aβ沉淀的百分比很低,即使没有小胶质细胞清除星形胶质细胞来源的APOE也是如此。这些数据表明,神经元 APOE在致密核心Aβ沉淀的组成和发展中起着关键作用。
在神经元APOE4存在下,小胶质细胞缺失会减少p-tau沉积
研究者进一步检测了嵌合小鼠p-tau沉积物的形成。用p-tau特异性单克隆抗体AT8和PHF1染色后,在这些嵌合小鼠中发现了AT8+和PHF1+ p-tau 沉淀(图 4A 和 4D),让人想起之前在具有致病性 tau突变的移植人源神经元的嵌合小鼠模型中描述的p-tau 病理学。与Aβ聚集体一样,这些p-tau 沉淀中的绝大多数位于人源神经元移植的100 μm范围内(图 S3B、S3D 和 S3G)。在距离移植物超过100 μm 的海马区域,很少发现p-tau沉淀(图 S3H)。对p-tau 沉淀的详细检查表明其位于细胞内,聚集体周围被类似胞体的MAP2 +染色所包围(图 4B 和图 4E)。这些数据强烈表明p-tau沉积物起源于人源神经元移植物。对移植物100 μm 内每平方微米的p-tau 沉淀数量的定量显示,hE4-E4KI小鼠海马体中的平均沉积物数量高于hE3-E3KI和hEKO-E4KI小鼠(图 4C 和 4F)。hE3-E3KI和hEKO-E4KI小鼠中p-tau 沉淀计数的减少与最近发表的一项研究相匹配,该研究表明,与APOE4相比,APOE3和神经元APOE4-KO显着降低了 PS19/EKI小鼠的tau病理。在小胶质细胞缺失后,与对照hE4-E4KI小鼠海马体相比,hE4-E4KI-PLX小鼠海马体显示p-tau沉淀水平显着降低(图 4C 和 4F),尽管沉淀大小在所有条件下都不受影响(图 S3K)。小胶质细胞缺失对 hE3-E3KI-PLX或 hEKO-E4KI-PLX小鼠海马体中的p-tau 沉淀没有显着影响。这些结果进一步表明,在人源神经元APOE4存在下,E4KI小胶质细胞促进淀粉样蛋白和p-tau沉淀的形成。
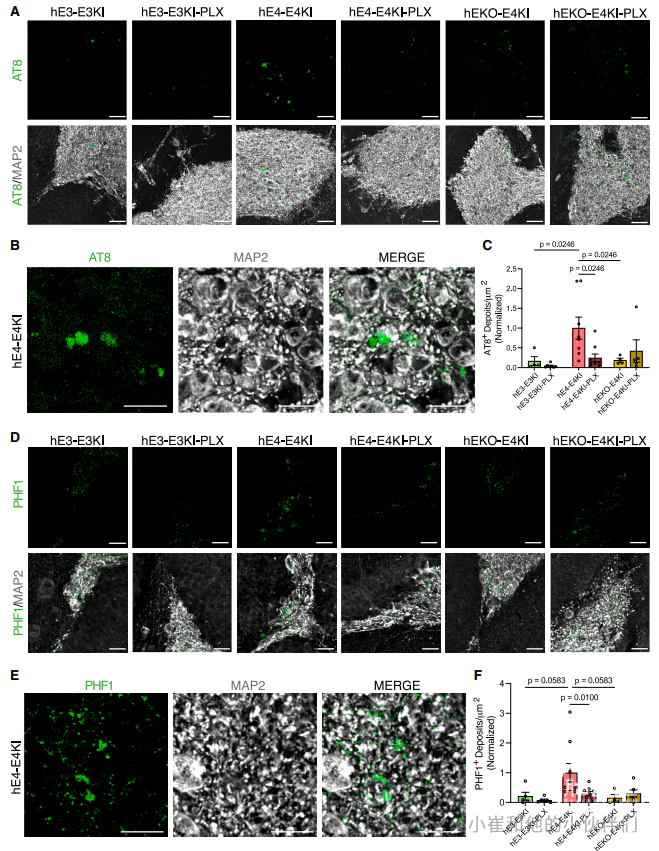
图4. 人源神经元APOE以及小胶质细胞清除对嵌合小鼠海马体中p-tau沉积物的影响。
小胶质细胞缺失会增加人类神经元移植物中的 APOE 水平
研究者研究了小胶质细胞缺失对不同APOE基因型的人源神经元移植物中 APOE水平的影响。通过对对照嵌合小鼠移植物进行免疫组织化学分析,发现 APOE蛋白表达相对较低,且大部分与GFAP+ 阳性的星形胶质细胞共定位(图 5A)。在小胶质细胞被清除后,hE3-E3KI-PLX和 hE4-E4KI-PLX小鼠移植物中的APOE染色显著增加(图 5B),这表明小胶质细胞可能参与清除移植的人源神经元附近的APOE。有趣的是,hEKO-E4KI-PLX小鼠移植物中的APOE染色强度约为hE4-E4KI-PLX小鼠的一半,这表明 hE4-E4KI小鼠移植部位中至少约 50% 的APOE4来自移植的人源神经元。先前的研究发现,在PS19/E4KI小鼠中,小胶质细胞清除后神经元的APOE水平会升高。同样,我们发现hE3-E3KI-PLX 和hE4-E4KI-PLX小鼠海马体移植物中的APOE染色与GFAP+阳性的星形胶质细胞和MAP2+阳性的人类神经元均有共定位(图 5A)。在hE4-E4KI-PLX小鼠中,APOE染色与人类神经元移植物面积显著相关(图 5G),在hE3-E3KI-PLX小鼠中呈中度相关(图 5F),但在hE3-E3KI、hE4-E4KI、hEKO-E4KI和 hEKO-E4KI-PLX小鼠中则无相关性(图 5C - 5E 和图 5H)。值得注意的是,在 hE4-E4KI-PLX小鼠海马体中,小胶质细胞数量与移植物内的APOE染色呈负相关(图 S4H),但在其他小鼠组中则不存在这种相关性(图 S4D - S4G 和图 S4I)。这些数据共同表明,小胶质细胞可能会清除移植的人类神经元和小鼠星形胶质细胞产生的APOE。

图5. 小胶质细胞清除会增加人类神经元移植物内的APOE水平。
嵌合小鼠海马体小胶质细胞的转录特征分析
为了研究在不同条件下小胶质细胞对人类神经元移植的反应,研究者对嵌合小鼠海马体中的小胶质细胞进行了单细胞RNA测序(scRNA-seq)。研究者解剖并解离了处于嵌合状态(hE3-E3KI、hE4-E4KI、hEKO-E4KI)的小鼠以及未移植的对照基因型(E3KI 和 E4KI)小鼠的海马体。随后通过荧光激活细胞分选术(FACS)纯化小胶质细胞(图 S5)。在流式细胞术分选过程中,首先通过设置门控去除碎片、非单细胞和死细胞,然后特异性分选 CD11b + /CD45 int 的小胶质细胞(图 S5A 和 S5B)。完成scRNA-seq(图 S6A)后,研究者对测序细胞进行聚类分析(图 S6B),进行质量控制检测(图 S6C - S6H;表 S1),并评估分选得到的小胶质细胞的纯度。利用Louvain 算法对细胞进行聚类,并通过均匀流形近似和投影(UMAP)进行可视化,结果显示存在16个不同的细胞簇(图 S6B)。几乎所有测序细胞都表达小胶质细胞特异性标记物Cx3cr1和Csf1r(图 S6I 和 S6J),证实了它们的小胶质细胞身份。有趣的是,Cd74作为反应性小胶质细胞的促炎主要组织相容性复合体 II 类(MHC-II)标记物,其表达突出显示了特定的小胶质细胞簇,包括第4、7、11 和 12 簇(图 S6K),值得进一步研究(见下文)。在检测非小胶质细胞类型的标记物时,测序细胞中Syn1(神经元)、Gfap(星形胶质细胞)、Slc17a7(兴奋性神经元)、Gad1/Gad2(抑制性神经元)和 Mbp(少突胶质细胞)的表达非常稀少或无表达(图 S6L - S6P),这进一步支持了分选得到的小胶质细胞具有高纯度的结论。

图 6. 在hE4 - E4KI小鼠海马体中富集的促炎性小胶质细胞亚群。
人源神经元APOE减少嵌合小鼠海马体中的稳态小胶质细胞
对这16个细胞簇的进一步分析揭示了几个值得关注的不同细胞簇,特别是第1、4和12簇。hEKO-E4KI小鼠中第1簇小胶质细胞(图 6A - 6E,粉色)的比例(37.6%)几乎是hE4-E4KI小鼠(21.9%)或 hE3-E3KI小鼠(23.6%)的两倍(图 6F;表 S2)。对差异表达基因(DEGs)的分析显示,与其他小胶质细胞簇相比,第1簇中稳态小胶质细胞标记物,包括 P2ry12、Cx3cr1、Fcrls、Cst3、Crybb1 和 Sparc 等基因的表达上调 (图 6G 和 6J;表 S2)。此外,第 1 簇中与促炎或活化小胶质细胞相关的基因,如 Cd52、APOE、Lyz2 和 Cd74 等的表达显著下调(图 6G)。基于这些转录组特征,第 1 簇代表了一个稳态小胶质细胞亚群,与 hEKO-E4KI 小鼠相比,hE4-E4KI和 hE3-E3KI小鼠中的这一亚群数量减少,这表明人类神经元APOE促使稳态小胶质细胞减少。
为了测量嵌合小鼠海马体中稳态小胶质细胞的水平,研究者用稳态小胶质细胞标记物P2ry12对脑切片进行染色(图 7A)。与转录组数据一致,hEKO-E4KI 小鼠海马体中P2ry12的覆盖面积显著高于hE3-E3KI和hE4-E4KI小鼠(图 7B)。由于hEKO-E4KI和hE4-E4KI小鼠的小胶质细胞和星形胶质细胞都能产生 APOE4,这一结果进一步支持了神经元APOE4的存在会促使小胶质细胞中 P2ry12等稳态标记物下调的结论。
进一步探究APOE亚型对这一稳态小胶质细胞簇的影响,通过对hE4-E4KI 小鼠小胶质细胞第1簇与hE3-E3KI小鼠小胶质细胞第1簇进行差异表达基因分析发现,hE4-E4KI小鼠小胶质细胞第1簇中促炎和与 AD 相关的基因表达上调,如 Cdk8(促进核因子κB(NF-κB)信号传导和趋化因子表达)、Cmss1(在 APOE4雄性小鼠中上调)、Marcks(与细胞运动和吞噬作用相关,在老年淀粉样斑块相关小胶质细胞中高表达)以及 Tmem176b(在淀粉样斑块相邻的小胶质细胞中上调,与溶酶体降解相关)(图 S7A;表 S3)。虽然我们无法确定这些影响是由小胶质细胞还是神经元中 APOE4 导致的,但与APOE3 相比,显然APOE4 即使在稳态小胶质细胞中也会诱导促炎转录组变化。
为了分离神经元APOE4对E4KI小鼠小胶质细胞的影响,我们检测了 hE4-E4KI小鼠小胶质细胞第 1 簇与hEKO-E4KI小鼠小胶质细胞第1簇的差异表达基因。值得注意的是,hE4-E4KI小鼠小胶质细胞第 1 簇中抗原呈递标记物(Cd74 和 H2-K1)、囊泡/内体运输标记物(Dynll1 和 Washc4)以及小胶质细胞趋化标记物P4ha1的表达增加(图 S7B;表 S3)。综上所述,这些发现表明神经元APOE4的存在可能使E4KI小鼠的稳态小胶质细胞转变为相对促炎的反应状态。对hE4-E4KI小鼠小胶质细胞第1簇与 hEKO-E4KI 小鼠小胶质细胞第 1 簇的差异通路调节进行基因本体(GO)分析发现,细胞质核糖体和蛋白质折叠通路显著富集(图 S7C;表 S3),这表明神经元APOE4可能改变稳态小胶质细胞中的蛋白质翻译和折叠过程。
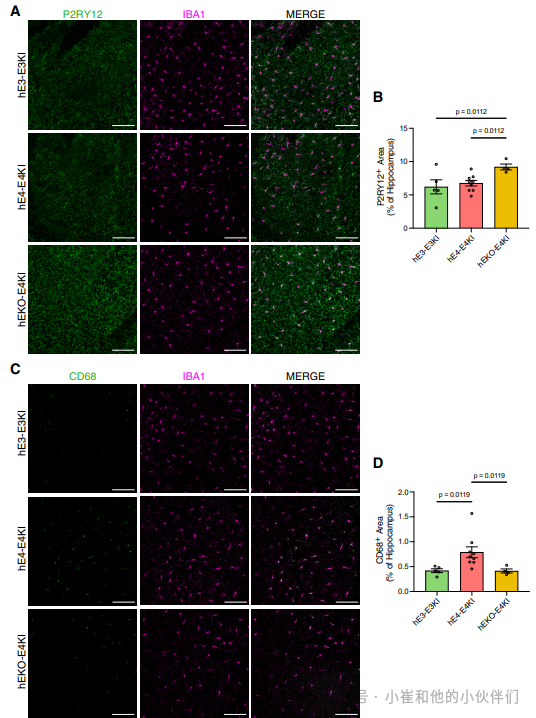
图7. hEKO-E4KI小鼠海马体中稳态小胶质细胞增多,hE4-E4KI小鼠海马体中促炎小胶质细胞增多。
hE4-E4KI嵌合小鼠中促炎小胶质细胞亚群更为丰富
与第 1 簇相反,第4簇(图 6A - 6E,金色)中小胶质细胞的比例在hE4-E4KI 小鼠(30.2%)和hE3-E3KI小鼠(19.9%)中显著高于hEKO-E4KI小鼠(7.6%)(图 6F;表 S2)。移植小鼠和未移植小鼠之间第 4 簇小胶质细胞比例的差异更为明显,未移植的E3KI和E4KI 小鼠中只有 0.4% 和 1.3% 的小胶质细胞属于第 4 簇(图 6F;表 S2)。这些数据表明,第 4 簇可能代表了一个特定的小胶质细胞亚群,该亚群对表达APOE,尤其是APOE4的移植人类神经元有特异性反应。对该簇进行更深入的差异表达基因检测发现,MHC-II抗原呈递基因(Cd74、H2-Ab1 和 Tap1)和趋化因子/干扰素(IFN)反应信号基因(Stat1、Irf1、B2m、Ccl5 和 Ccl12)显著上调(图 6H;表 S3)。每个基因子集分别代表 MHC-II 表达(MHC-II)小胶质细胞和 IFN反应(IFN-R)小胶质细胞的独特标记物,这两种活化的小胶质细胞亚群此前 AD小鼠模型中已有描述。有趣的是,这些第4簇小胶质细胞并不完全符合MHC-II或IFN-R小胶质细胞的特征,而是呈现出一种融合了两者特征的基因表达模式。第4簇小胶质细胞中稳态小胶质细胞标记物(Fcrls、Mertk、Elmo1 和 Nav2)的表达也显著下调(图 6H;表 S3),这表明这些细胞处于活化状态。此外,第4簇中几个下调的基因与反应性海马体小胶质细胞中特异性下调的基因(Plxna4、Maml3、Fchsd2 和 Slc8a1)一致 。
与hE3-E3KI小鼠的小胶质细胞相比,hE4-E4KI小鼠第4簇小胶质细胞中许多促炎标记物的表达上调(图 S7D;表 S3),包括来自MHC-II小胶质细胞(H2-Ab1、H2-Aa 和 Ly6e)和 IFN-R小胶质细胞(Stat1)的基因。hE4-E4KI小鼠第4簇小胶质细胞中还显示出Cdk8和Malat1水平的增加,这两种基因是强效的小胶质细胞炎症小体激活剂。对hE4-E4KI和hEKO-E4KI小鼠第4簇小胶质细胞进行比较,发现hE4-E4KI小鼠的MHC-II小胶质细胞基因(H2-Aa 和 H2-Eb1)和其他促炎标记物(Cd74、Stat1 和 Irf1)水平增加(图S7E;表S3)。Lamp1和Lyz2作为溶酶体基因和活化吞噬性小胶质细胞的标记物,在hE4-E4KI 小鼠的小胶质细胞中也上调,这表明人类神经元APOE4可能促进小胶质细胞的摄取/吞噬作用。对 hE4-E4KI和hEKO-E4KI小鼠小胶质细胞的差异通路调节进行GO分析发现,hE4-E4KI小鼠第4簇小胶质细胞在与MHC蛋白复合体、抗原加工/呈递、细胞对IFN的反应以及细胞因子反应相关的通路中发生了改变(图 S7F;表 S3)。有趣的是,细胞因子反应和其他促炎基因在体内对淀粉样蛋白有反应的嵌合小鼠模型的人类小胶质细胞中也上调,这表明嵌合小鼠中的促炎反应也与AD中人类小胶质细胞的反应相关。这些数据共同表明,人类神经元APOE,尤其是APOE4,诱导了促炎小胶质细胞亚群,如MHC-II小胶质细胞的产生。
小胶质细胞第12簇(图 6A - 6E,蓝色)虽然数量较少,但在hE4-E4KI小鼠中占比很高。hE4-E4KI小鼠中第12簇小胶质细胞的比例为 3.2%(图 6F;表 S2),是hE3-E3KI小鼠(0.9%)的3倍多,是hEKO-E4KI小鼠(0.09%)的 30 多倍(表 S2)。实际上,hEKO-E4KI小鼠中第12簇小胶质细胞的比例与未移植小鼠(E3KI:0.1%,E4KI:0.01%)相似(图 6F;表 S2)。hE4-E4KI和hEKO-E4KI 小鼠之间第12簇小胶质细胞比例的显著差异可能表明,第12簇代表了一个对表达APOE,特别是APOE4的移植人类神经元反应更为强烈的小胶质细胞亚群。对小胶质细胞第12簇的差异表达基因进行更仔细的检查发现,与第4簇相比,该簇中有更多的促炎基因上调。虽然第12簇小胶质细胞显示出一些疾病相关小胶质细胞(DAM)标记物,包括Trem2、Ctsl和Cd9的表达上调,但其表达谱并不完全符合DAM的特征。相反,第12簇小胶质细胞的基因表达谱与MHC-II 小胶质细胞最为相似,在MHC抗原呈递通路中有很高比例的上调差异表达基因:Cd74、H2-Ab1、H2-Aa、H2-Eb1、H2-K1和B2m 。另一项研究表明,在APP/PS1 AD模型小鼠中,MHC-II小胶质细胞相对于其他小胶质细胞具有更高的Aβ吞噬能力。与这些发现一致,第12簇小胶质细胞还表现出许多与小胶质细胞吞噬作用增加和AD风险相关的溶酶体基因(Lgals3bp、Ctsb、Ctsc、Ctss 和 Ctsd)上调。此外,小胶质细胞外泌体基因Cd9和Cd81在第12簇小胶质细胞中高度上调。由于外泌体此前被认为是病理性淀粉样蛋白和 tau 蛋白沉积的潜在机制,在hE4-E4KI小鼠中特别丰富的小胶质细胞簇中发现外泌体标记物的显著上调很有意思,因为hE4-E4KI小鼠具有高水平的淀粉样蛋白和 tau 蛋白病变。对差异表达基因富集通路的GO分析显示,小胶质细胞第4和第12簇有共同的通路(图 S7G;表 S3),如胞质核糖体通路、抗原加工和呈递通路以及免疫反应通路,此外每个簇还有独特的通路(图 S7G;表 S3)。
有趣的是,小胶质细胞第7和第11簇也显示出高Cd74 表达(图 S6J)。差异表达基因分析表明,与第4和第12簇一样,第7簇中用于抗原呈递的MHC蛋白表达增加,如 H2-Eb1、H2-Ab1 和 H2-Aa(图 S7H;表 S2)。第11簇细胞数量很少,Apo17c和Cd300e的表达增加,这两种基因都与抗原加工和呈递有关(图 S7I;表 S2)。虽然这些簇在具有不同APOE基因型的嵌合小鼠条件中并没有特别富集,但它们值得在未来进一步研究。
同样有趣的是Cd68的表达模式,Cd68 是一种在AD模型中活化吞噬性小胶质细胞中高度表达的溶酶体蛋白。多项研究表明,与其他小胶质细胞激活标记物不同,Cd68的表达在AD和APOE4 的尸检大脑中相对于对照组持续增加,并且与衰老过程中的神经退行性变和认知能力下降有关。在我们的scRNA-seq 数据集中,hE4-E4KI小鼠小胶质细胞的第4和第12簇与其他簇相比,表现出独特的高Cd68表达(图 S7J),而其他条件下的小胶质细胞簇中没有这种模式。恰如其分的是,第4和第12簇显示出MHC-II小胶质细胞标记物的上调,在炎症性AD模型小鼠中,MHC-II小胶质细胞也高度表达Cd68。这些数据支持这样的结论:在hE4-E4KI小鼠中富集的小胶质细胞第4和第12簇是高度反应性和促炎的小胶质细胞亚群。免疫组织化学证实(图 7C),hE4-E4KI小鼠海马体中Cd68 +小胶质细胞的覆盖面积显著高于hE3-E3KI和hEKO-E4KI小鼠(图 7D)。结合转录组数据,这一结果表明神经元APOE4促进了海马体小胶质细胞的促炎反应。
许多研究已经确定小胶质细胞介导的T细胞浸润是AD中神经元功能障碍和神经退行性变的促成因素 。我们在人类移植物附近检测到CD3 + T细胞,但发现不同条件下海马体T细胞计数没有显著差异。然而,hE4-E4KI-PLX小鼠的T细胞数量有减少的趋势,仅为hE4-E4KI小鼠的四分之一(图 S7K 和 S7L)。这一趋势与之前发表的结果一致,表明在 tau 蛋白病小鼠海马体中,小胶质细胞在APOE4背景下对 T 细胞的招募和激活起着关键作用 。
载脂蛋白E4(APOE4)是AD最强的遗传危险因子,但小胶质细胞对神经元APOE4 相关AD发病机制的影响仍不明确。为探究这些影响,研究者在小鼠海马体中构建嵌合模型,利用诱导多能干细胞(iPSC)衍生的人类神经元,并在模型中耗竭小胶质细胞。研究发现,神经元APOE和小胶质细胞的存在,对于Aβ和 tau 蛋白病理改变的形成至关重要,且这种影响具有APOE亚型依赖性(APOE4>APOE3)。单细胞 RNA 测序分析确定了两种促炎型小胶质细胞亚型,它们的MHC-II基因表达升高,在移植了人类APOE4神经元的嵌合小鼠中更为富集。这些研究结果突出了神经元APOE,尤其是 APOE4与小胶质细胞 AD发病机制中的协同作用。

Rao A, Chen N, Kim MJ, et al. Microglia depletion reduces human neuronal APOE4-related pathologies in a chimeric Alzheimer's disease model. Cell Stem Cell. 2025;32(1):86-104.e7.

编 译 / 罗绿
校 审 / 唐晓璐
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。




