
背景介绍:动物实验与临床不一致的谜团
研究设计:三种神经保护疗法的详细实验
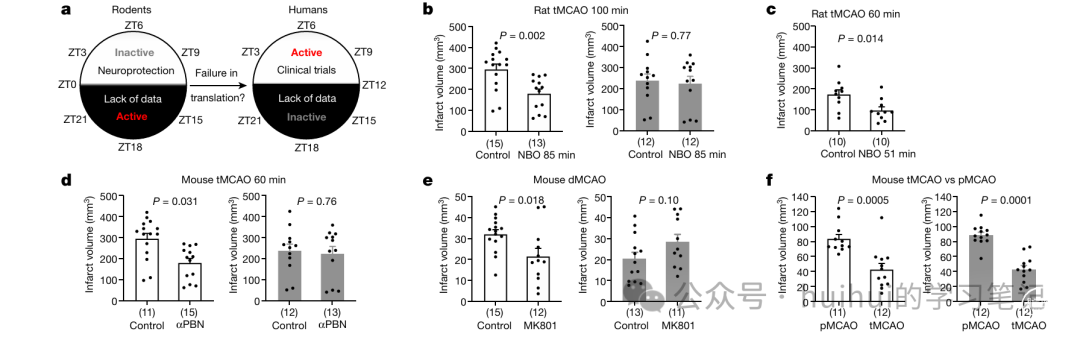
总结:图1展示了昼夜节律对神经保护疗法疗效的显著影响,无论是常压氧疗法(NBO)、自由基清除剂αPBN还是NMDA受体拮抗剂MK801,这些治疗都在啮齿类动物的“非活动期”(白天)有效,而在它们的“活动期”(夜晚)疗效不佳。这说明昼夜节律的不同是导致这些疗法从动物实验到临床试验转化失败的重要原因之一。
实验结果一:常压氧疗法的昼夜节律差异
实验结果二:αPBN和MK801的昼夜节律影响
实验结果三:激光斑点成像揭示半暗带变化
实验结果四:体外实验支持昼夜节律假设
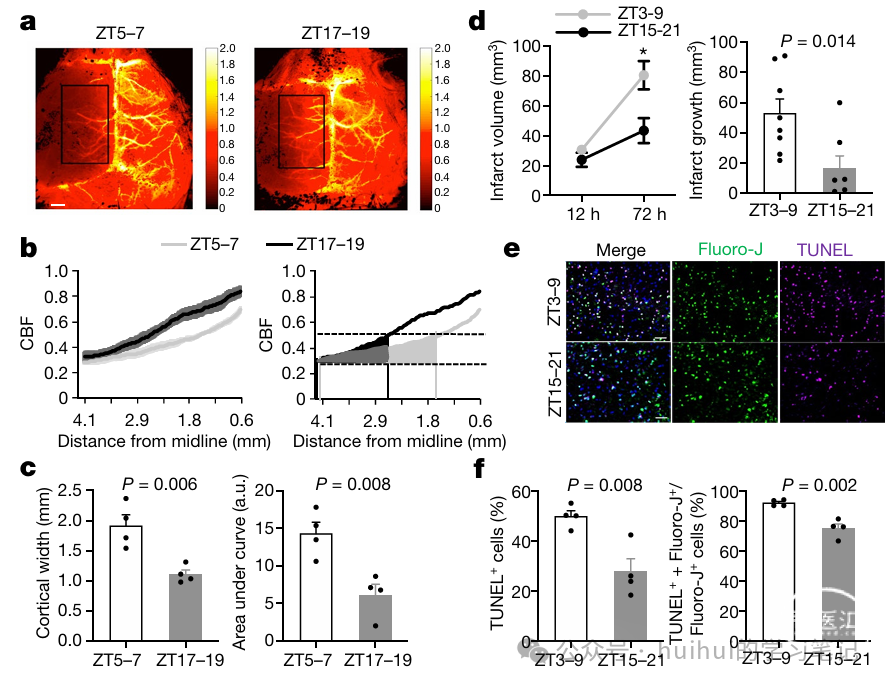
总结:
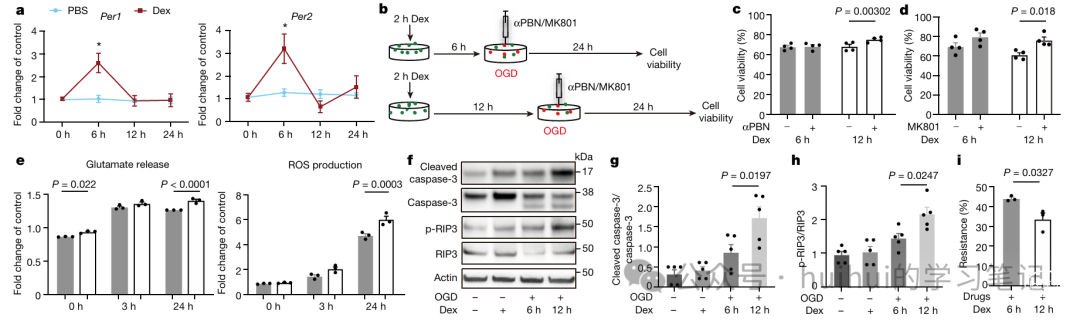
总结:
临床启示:重新思考昼夜节律在治疗中的作用
对未来的展望
声明:脑医汇旗下神外资讯、神介资讯、神内资讯、脑医咨询、Ai Brain 所发表内容之知识产权为脑医汇及主办方、原作者等相关权利人所有。



