外伤性视神经病变(traumatic optic neuropathy,TON)是颅脑损伤中罕见和严重的并发症之一,视神经损伤约占颅脑损伤的2%~5%,主要是由于交通事故、高处跌落及暴力打击等因素导致的个体颅底、筛窦及视神经骨管骨折,进而导致视神经受到一定能量的冲击,常造成视力减退甚至失明。视神经损伤所导致的视力损害是神经创伤中较为棘手的问题。上海长征医院侯立军教授团队率先提出,行视神经管减压联合嗅束移植手术有助于缓解视神经受损晚期患者的视力恢复。近日新疆医科大学第一附属医院颅脑创伤汪永新团队完成一例经颅视神经管减压联合带蒂嗅束移植手术,效果明显,特此报道。
患者一般情况:
>
01
患者男性,29岁,维吾尔族。3天前因车祸外伤伴左侧失明,当地医院因条件有限未能处理。患者转新疆医科大学第一附属医院神经外科就诊。
>
02
查体:意识清楚,言语流利,左侧瞳孔直径4mm,直接对光反射消失,间接对光反射存在,视力检查无光感,右侧瞳孔正常,四肢肌力肌张力正常。
>
03
影像学检查左侧面颊部肿胀积气,左侧上颌窦前壁、外侧壁、左侧眼眶外侧壁及左侧视神经管外侧壁多发骨折,左侧上颌窦积血,左侧外直肌损伤可能。

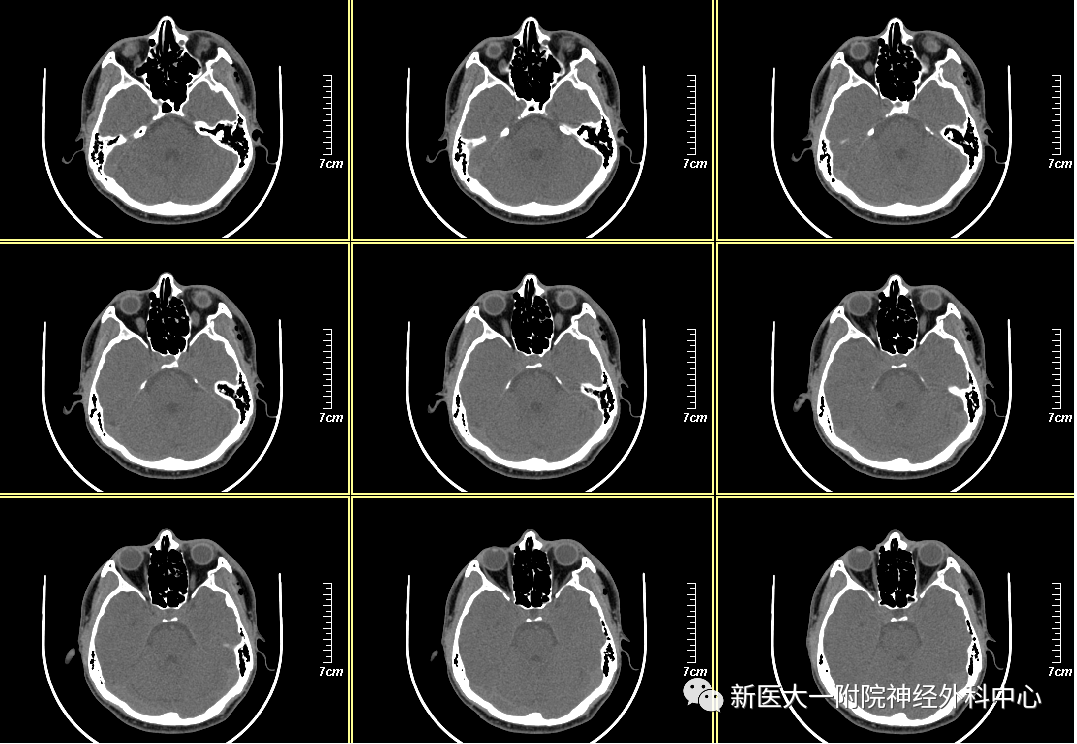
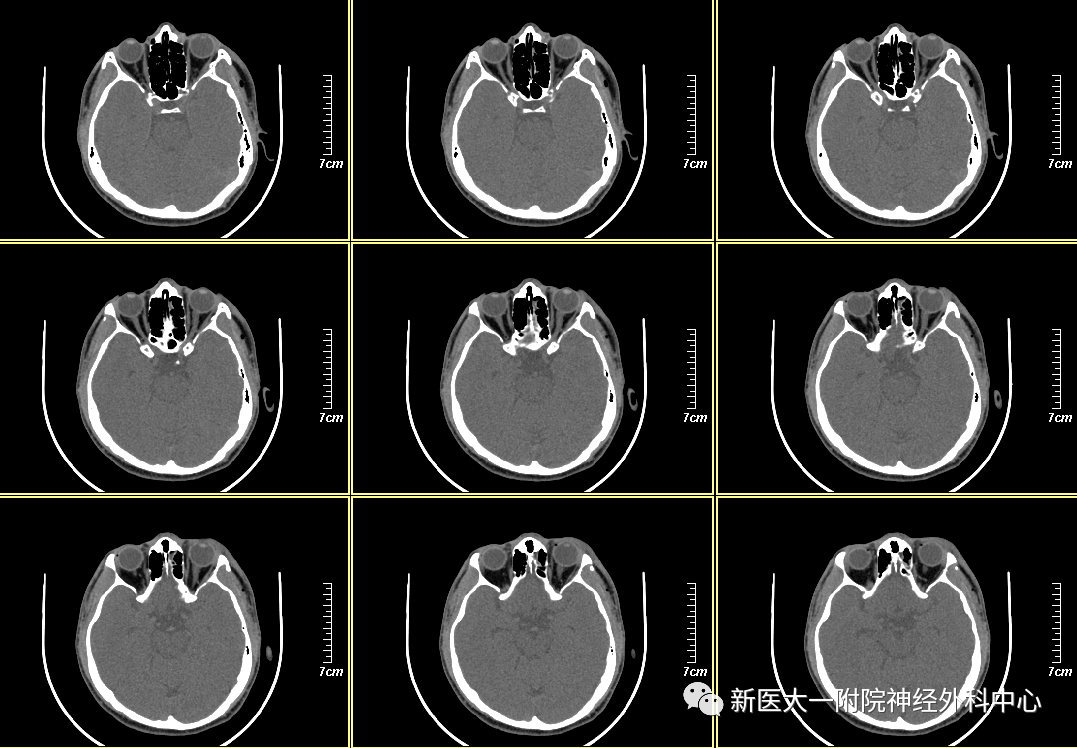
术前准备完善,详细谈话告知风险后,采用经翼点入路。
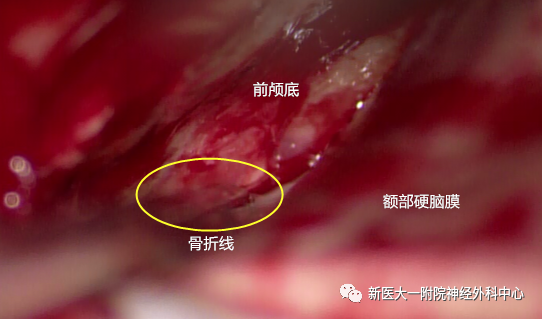
硬膜外探查,视神经管骨折处(黄色圆圈内)
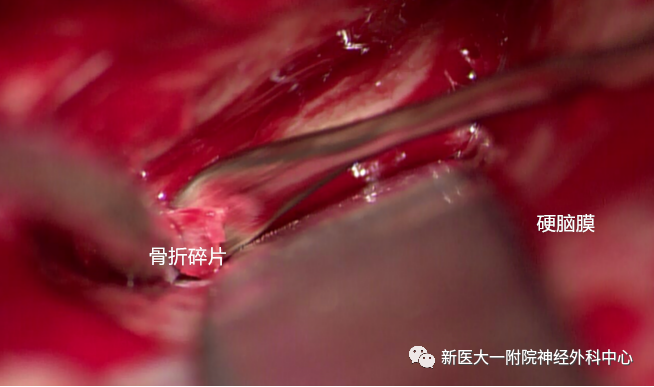
剥除骨折碎片
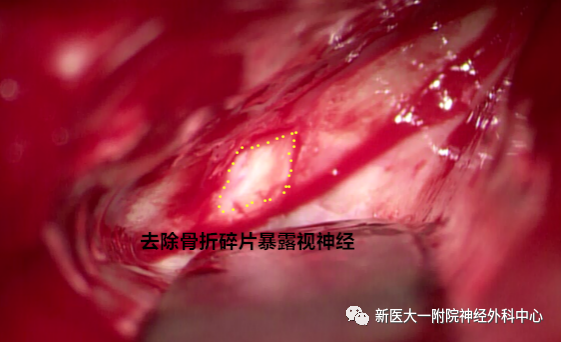
去除骨折碎片,暴露部分视神经
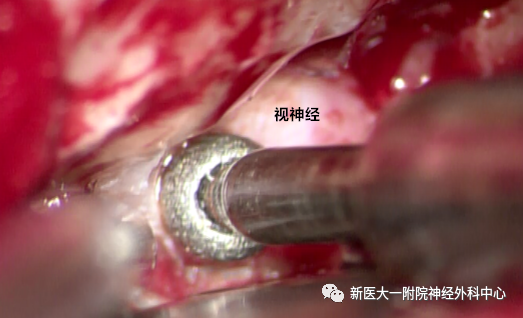
硬膜外,继续磨除视神经管骨质
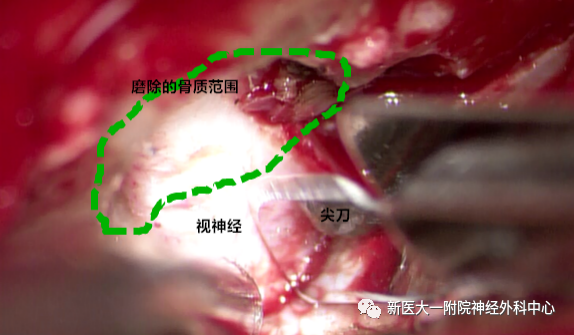
切开视神经鞘(绿色圆圈内为磨除的骨质范围)
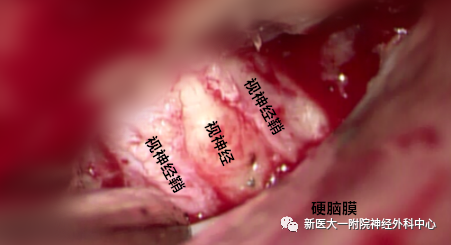
打开视神经鞘,充分减压
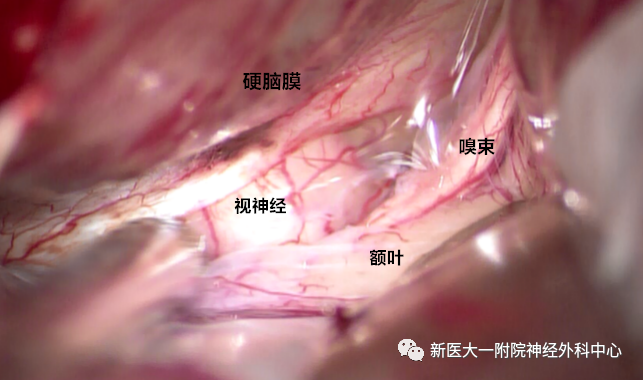
硬膜内探查,暴露视神经颅内段及嗅沟内的嗅束
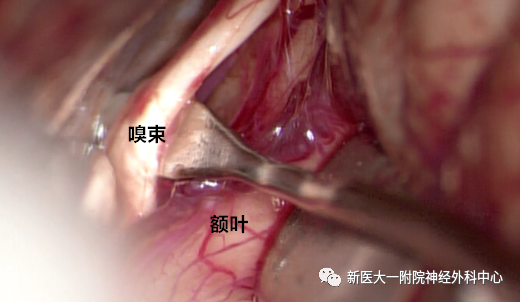
游离嗅束
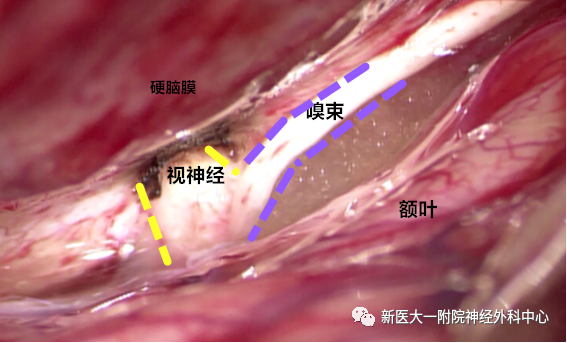
将游离嗅束贴附于视神经并明胶海绵予以固定

术后复查可见视神经管磨除(红色箭头处)
经手术治疗后,患者视力从无光感提升至指动。目前患者术后恢复情况好,正在积极治疗。
小结
外伤性视神经病变(traumatic optic neuropathy,TON)是颅脑损伤中罕见和严重的并发症之一,其发生率占颅脑外伤的2%~5%[1],如伴颌面部骨折,其发生率上升至10%。TON是指颅脑及额面部遭受外力引起视神经直接或间接损伤,从而导致患者同侧视力下降、视野缺损、色觉下降,甚至失明以及相对性传入性瞳孔障碍(relative afferent pupillary defect,RAPD)等其他严重并发症,严重影响患者的生活质量。
一、视神经损伤的机制
视神经损伤的机制可分为两类,即直接损伤和间接损伤。前者常由于眶外侧缘的直接暴力所致,主要为视神经撕裂伤、挫伤。后者是由于额面部特别是眉弓颞上部受到外力撞击,引起供应视神经的分支血管痉挛所致。此外,按损伤的性质,视神经损伤又可分为,原发性损伤,包括视神经断裂、视神经挫伤;继发性损伤,包括视神经水肿、局部血管受压或循环障碍[2]。Wu等[3]的动物模型研究结果表明,视神经受损后可引起蛋白激酶C局部蓄积,而活性蛋白激酶C可促进轴突生长;同时,受损细胞内蛋白激酶C同工酶的microRNA水平随之升高,这可能与提高受损轴突部位的蛋白激酶C的蛋白水平有关。该研究结果还显示,细胞内还产生其他因子,如环磷酸腺苷,可以激活细胞膜神经营养因子受体,在神经元的存活及促轴突生长等方面起着重要作用;凋亡相关基因蛋白Bcl-2,可以提高轴突至轴突电活动的兴奋性,发挥神经营养信号的作用[4-5]。另外,视神经细胞损伤使谷氨酸和一氧化氮过度释放,诱导细胞凋亡[6]。
人体视神经管段属于易遭受损伤的部位,视神经管主要是由蝶骨以及部分筛骨组成,距眶内眦较近。当个体颅脑受到高能量的撞击后,暴力可沿颅脑骨骼进行传导,出现视神经管骨折,从而导致视神经受到冲击[7-9] 。视神经管骨折所引发的视力减退甚至失明有以下两种可能。第一,外伤直接导致视神经离断,这种损伤往往会直接导致失明。第二,外伤时可能出现一过性视神经急性扭转、挫伤或者视神经管局部骨折,导致视神经持续被压迫,进而导致视神经水肿。同时,由于患者的视神经管本身狭窄或骨折,迫使视神经管更加狭窄,不能及时缓解压力,又进一步加重视神经水肿。水肿的视神经压迫血管,形成恶性循环,导致视力严重减退甚至失明。
二、视神经损伤的治疗方法
尽管目前关于TON的观点较多,但神经外科、眼科和耳鼻喉科医生对于针对不同患者制定的最佳疗法仍未达成共识,目前常见的争议有是否治疗、是否使用激素治疗及何种激素及其用量、手术干预的必要性、手术方式、手术干预的时间窗及其他营养神经药物的选择、有效性等问题。
目前主要有以下治疗方式:
1.保守治疗:临床给予营养神经、改善颅内微循环、脱水降颅压、能量合剂等对症支持治疗。自20世纪80年代即有研究表明皮质醇激素可被用于治疗创伤神经,其具有改善微循环、加速代谢、抗炎作用以及抗氧化作用。常规方法为甲基强的松龙初始剂量1000 mg/d,持续3d。
激素在人体中具有稳定细胞膜、减少自由基形成等作用。它可直接作用于细胞表面的钠离子与钙离子,从而抑制细胞电位传导,达到阻断炎症介质及相关血管活性物质的释放,进而起到减轻血管痉挛的作用。Lasunin 等[10]通过短时间内给予患者甲泼尼龙琥珀酸钠冲击治疗,消除视神经炎症、水肿状况,改善视神经周围组织循环,减少视神经细胞的凋亡,从而达到保护视神经的目的[11]。本研究中对部分患者应用甲泼尼龙琥珀酸钠冲击治疗后,其视力得到一定程度的恢复,但有效率不高。考虑可能的原因为,第一,激素减轻血管痉挛及水肿的效力可能低于外伤带来的损伤,单纯的激素治疗不足以减轻视神经所受的压力。第二,外伤导致视神经离断。但因无明确的相关检查或查体予以确认,故本研究未能对激素治疗的使用量进行准确界定[12-16]。
2.手术治疗:手术治疗的目的旨在去除损伤部位的异物和骨折片及清除周围血肿,去除视神经管骨性结构,为视神经管膨胀创造空间,限制压迫及破坏作用,保存现有视神经及促进重建神经功能,以便达到保护视力或改善预后的效果。而手术适应证主要取决于术前视力、视野和VEP评估结果,评测的内容大多由临床医生进行经验性的判断。常用的手术方式有开颅手术和经鼻内镜下视神经管减压术。
2.1开颅视神经管减压术:视神经管包括上、下、内及外下四个壁腔,以内壁最长,外下壁最短;外侧壁和上壁以及视神经孔的骨质较致密。多数视神经管会在最后筛房或蝶窦的外侧壁上形成向窦内突出的隆起,这是医师在行视神经管减压术中寻找视神经管的主要标志。视神经管内有视神经、视神经三层鞘膜、眼动脉及来自颈交感丛的交感神经纤维通过。视神经的主要血液供应来自眼动脉及其分支下的视网膜中央动脉和睫状动脉。大多数眼动脉始于视神经管的颅口处,行走于视神经的内下方,至视神经管的眶口处,绕行到视神经的外下方。入鞘后的眼动脉能够发散出多支滋养动脉,因此,行视神经管减压术时,在鞘膜切开后不宜在此处进行过多操作。视神经损伤占颅脑外伤的0.7% ~5%,其中,78%的病例是由钝性损伤所致[17-18]。根据视神经的解剖结构和生理学特点,90%以上的视神经损伤为视神经管段的间接性损伤,而直接性损伤及视神经其他部位的损伤在临床上比较少见。间接性视神经损伤是由于额面部特别是眉弓颞上部受到撞击而产生的,伤侧眼局部和眼底可无异常表现;受伤时或受伤后发生视力下降甚至失明。损伤常发生在单眼(亦可为双眼),为传入神经障碍,视力障碍并不能反映颅脑外伤的严重程度。
2.2 经鼻内镜下视神经管减压术:主要有经蝶筛入路和经蝶入路两种手术方式。随着手术设备和技术的不断进步,内镜下视神经管减压术因其具有创伤小、恢复快、手术时间较短、并发症相对少、病死率低和不留头面部瘢痕的优点,得到越来越多人的认可。
三、嗅鞘细胞功能及作用
嗅鞘细胞(olfactory ensheathing cells,OECs)在19世纪后叶由 Golgi和 Blanes 在嗅球中发现,是介于雪旺细胞(Schwann cells) 和少突胶质细胞之间的一种胶质细胞,起源于嗅基板,是嗅神经的支持细胞,具有神经再生、抑制胶质增生、促进髓鞘化等功能[19]。研究表明,OECs 具有分泌多种神经营养因子、促进星形胶质细胞瘢痕形成、减少硫酸软骨素蛋白多糖(chondroitin sulfate proteoglycans,CSPGs) 沉积、诱导轴突生长及髓鞘化、炎症调节等作用,在 SCI的损伤后改变局部微环境而促进脊髓功能发挥重要作用[20-21]。OECs 在移植后直接迁徙到受损伤部位,进而诱导轴突的延长和控制神经元突触上特定关于桥接的靶点,直接参与轴突的髓鞘化[22]。在体外培养的胶质瘢痕模型中,OECs 的加入并没有改变星形胶质细胞的反应性,而是穿过沿着其形成的边界区;因此,OECs 具有穿越胶质瘢痕到达病变中心的能力。有研究表明,OECs 是吞噬细胞,能吞噬凋亡的嗅觉受体神经元轴突。因此,OECs 移植后使免疫反应程度及峰值改变,即通过减少损伤部位巨噬细胞浸润来调节炎症反应[23]。
由于 OECs 的获取相对较容易,且自体OECs 移植的临床治疗安全性高,无免疫排斥反应的发生,无伦理问题。此次开展的“经颅视神经管减压联合带蒂嗅束移植治疗外伤性视神经损伤”手术将传统手术与OECs 的功能相结合,对外伤后视力下降具有良好的治疗效果,但具体机制及确切效果需进一步探讨。
参考文献:
[1]秦虎,汪永新,李亚宾,刘冬,朱晓锋,徐丹书,王增亮. 视神经管减压术与激素冲击疗法治疗视神经损伤的疗效比较[J]. 中华眼科医学杂志,2017,06:263-268.
[2]Schwartz M.Optic nerve crush:protection and regeneration.[J]Brain Research Bulletin, 2004, 62 (6) :467-471.
[3]Wu DY,Zheng JQ, Mcdonald MA, et al.PKC isozymes in the enhanced regrowth of retinal neurites after optic nerve injury[J].Invest Ophthalmol Vis Sci, 2003,44(6) :2783-2790.
[4]Nishiyama M,Hoshino A,Tsai L,et al.Cyclic AMP/GMPdependent modulation of Ca2+channels sets the polarity of nerve growth-cone turning[J].Nature, 2003423 (6943) :990-995.
[5]Park K,Luo JMHisheh s,et alCellular mechanisms associated with spontaneous and ciliary neurotrophic factorc AMP-induced survival and axona regeneration of adult retinal ganglion cells[J].Journal of Neuroscience the Official Journal of the Society for Neuroscience, 2004, 24 (48) :10806-10815.
[6]Chung HTPae HO.Choi BM.et al.Nitric oxide as a bioregulator of apoptosis [J]. Biochemical&Biophysical Research Communications. 2001, 282 (5) :1075-1079.
[7]曾加龙,朱义兴,陆晶,等.HRCT对诊断外伤性视神经管骨折的价值分析[J1中国实用医药,2014,4(8):75-76.
[8]肖前锋.单排螺旋CT三维重建对视神经管骨折检查的临床诊断价值[J/CD]世界最新医学信息文摘:电子版,2014,14(14):169.
[9]陈汉民薄层CT扫描及三维重建在诊断视神经管骨折中的应用[J].实用医学杂志,2014,30 (22):3691-3692.
[10JLasunin NV,Cherekae VA,Serova NK,et al.Optic nerve decompression in treatment of neoplasms involving optic canal[J].Zhurnal Voprosy Neirokhirurgii lmeni Nnburdenko.2014.78 (4):31-41.
[11JKennerdell JS,Amsbaugh GAMyers EN.Transantral-ethmoidal decompression of optic canal fracture[J]Arch Ophthalmol, 1976,94 (6) :1040-1043.
[12]Haciyakupo4lu G,Dzdemir N,Polt set al.Ultrastructural Findings and SOD Levels in Experimental Optic Nerve Injury:Effect of Thyroid-Releasing Hormone on the Degenerative and Regenerative Processes[J].Ophthalmologica,1994.208 (5) :270-277.
[13]Vedin AM,Karlsson H, Fink C,et al.Presenting features and long-term effects of growth hormone treatment of children with optic nerve hypoplasia/septo-optic dysplasia[J].International Journal of Pediatric Endocrinology, 2011, 2011 (1) :17.
[14]Santacana M,Ag DLV, Heredia M,et al.Presence of LHRH (luteinizing hormone-releasing hormone) fibers in the optic nerve, optic chiasm and optic tract of the adult rat[J].Brain Research Developmental Brain Research1996.91(2):292-299.
[15]Leaf AA, Ross RJ, Jones RB,et al.Response to growth hormone-releasing hormone as evidence of hypothalamic defect in optic nerve hypoplasia[J].Acta Paediatrica.1989.78 (3):436-439.
[16]Witkin JW.Nervus terminalis. olfactory nerve. and optic nerve representation of luteinizing hormone-releasing hormone in primates[J].Annals of the New York Academy of Sciences, 1987, 519 (1) :174-183.
[17]Xinias l. Papadopoulou M.Papastavrou T.et al.Optic Nerve Hypoplasia and Growth Hormone Deficiency in a Cholestatic Infantl[J].Pediatric Neurology, 2006.34(4) :319-322.
[18]Wilhelm H.Traumatic optic neuropathy.Laryngorhinootologie,2009,88 (3):204-207.
[19] Gorrie CA,Hayward I,Cameron N,et al. Effects of human OEC-derived cell transplants in rodent spinal cord contusioninjury[J].Brain Research,2010,1337(1337):8-20.
[20]Hu R,Zhou J,Luo C,et al.Glial scar and neuroregeneration:histological,functional,and magnetic resonance imaging analysis in chronic spinal cord injury[J].Neurosurg Spine,2010,13(2):169-180.
[212]Fitch MT,Silver J.CNS injury,glial scars,and inflammation:
Inhibitory extracellular matrices and regeneration failure[J].Exp Neurol,2008,209(2):294-301.
[22] Santos Silva A,Fairless R,Frame MC,et al.FGF/heparin
differentially regulates Schwann cell and olfactory ensheathing cell interactions with astrocytes: a role in astrocytosis[J].Neurosci,2007,27(27):7154-7167.
[23]Nazareth L,Tello VJ,Lineburg KE,et al.Differing phagocytic capacities of accessory and main olfactory ensheathingcells and the implication for olfactory glia transplantationtherapies[J].Mol Cell Neurosci,2015,65:92-101.

汪永新 二级教授 博士生导师
新疆医科大学第一附属医院神经外科中心主任
新疆医学会神经外科分会副主任委员
新疆神经外科研究所副所长
中国医师协会神经外科医师分会委员
中华医学会数字医学分会委员
中国神经重症管理协作组常委
中国医师协会神外医师分会小儿神外专家委员会委员
中国抗癌协会神经肿瘤分会委员
《中华神经外科杂志英文版》通讯编委
擅长应用内镜及显微镜治疗各种神经系统肿瘤、狭颅症、复杂颅面畸形综合征、脊髓脊膜膨出、颅脑寄生虫病、脑积水、脑瘫和重型颅脑损伤等疑难病种。

王增亮,主任医师,教授,医学博士后,硕士生导师
巴州人民医院党委委员、副院长
新疆医科大学第一附属医院神经外三科副主任
中华医学会创伤学分会青年委员会委员
新疆医学会神经外科专委会青年委员会副主任委员
新疆医学会创伤外科与急救专业委员会神经外科专业学组副组长
中国医师协会神经外科分会专科医师师资培训委员会委员
自治区卫健委规范化培训督导专家
新疆医科大学优秀青年教师、优秀教师
全国住院医师规范化培训优秀带教老师
入选新疆“天山英才工程”。

秦虎,男,博士,副主任医师、讲师,主要从事颅脑创伤、胶质瘤、脑膜瘤、颅内感染、植物人促醒等疾病的诊治。
目前主持自治区级、厅局级自然科学基金2项、校级课题2项,参与国家自然科学基金3项、省部级自然科学基金1项,先后在国内外杂志上发表论文15篇。

吴鹏飞,男,硕士,主治医师,主要从事颅脑创伤、颅内感染、颅内肿瘤等疾病诊治。
目前担任新疆医科大学第一临床学院外科教研室秘书、神经外科中心教学秘书,先后参与国家自然科学基金2项,省部级自然科学基金2项,在国内核心杂志发表论文2篇。

王凯,男,硕士,住院医师,主要从事脑血管介入、颅脑创伤、颅内肿瘤等疾病诊治。
2018年6月 新疆医科大学第一附属医院住院医师规范化培训医师。
2019年8月 新疆医科大学第一附属医院神经外科中心住院医师。









